猪支原体肺炎控制和净化评价方法研究进展
2012-11-14华利忠刘茂军冯志新张小飞邵国青
华利忠,刘茂军,冯志新,张小飞,邵国青
(1.江苏省农业科学院兽医研究所·农业部兽用生物制品工程技术重点实验室·国家兽用生物制品工程技术研究中心,南京 210014;2.南京天邦生物科技有限公司,南京 211102)
猪支原体肺炎(Mycoplasma Pneumonia of Swine,MPS)防控和净化是当今养猪业面临的难题之一。临床上主要依靠药物控制、疫苗免疫以及改善饲养管理方式如全进全出、早期隔离断奶,多点式生产模式等进行猪气喘病的防控和净化[1-3]。无论采用哪些方法,都必须建立相应的评价指标来衡量这些控制或净化措施的效果,以便于猪场今后更好的控制猪支原体肺炎。目前,临床上对猪支原体肺炎控制与净化的评价指标主要有临床症状,肺部肉变评分,生产指标(料肉比、出栏重、日增重等),经济效益等,如果涉及疫苗免疫,各项免疫学指标也是评价指标之一。
1 常规评价指标
1.1 临床症状及发病率 猪支原体肺炎防控和净化效果的评价,临床症状和发病率是最表观的指标。临床症状主要包括咳嗽和呼吸困难两项[4]。Nathues H等[5]对59个育肥猪群的咳嗽次数以及血清抗体和支气管肺泡灌洗液病原检出率进行了相关性分析,发现在育肥群中咳嗽次数的统计,尤其是干咳次数的统计有时可以替代Mhp的PCR病原检测。刘茂军等[6]在猪支原体肺炎活疫苗(168株)免疫效益的研究中,分别统计了哺乳期、保育期和育肥期的发病率,结果发现试验的三个猪场三个时期免疫猪的发病率均显著下降。国外所有猪肺炎支原体净化成功的案例,无一例外均需对净化后猪群乃至后代的临床症状进行持续性的监测[7],甚至还引进SPF级猪同群饲养,再观测SPF级猪的临床症状[8],以达到更精确的结果。在国内,邵国青[9]建议无猪支原体肺炎健康猪场鉴定标准为:观察3个月以上,未发现支原体肺炎症状并同时放入易感健康小猪2头,同群饲养,也不被感染;一年之内整个猪群未发现支原体肺炎症状,检查所宰杀的肥猪、淘汰猪、死亡猪的肺部均无喘气病病变,实验室PCR检测病原阴性。可见发病率的降低是猪支原体肺炎防控效果的最主要指标之一。不仅是猪支原体肺炎本身,由于混合感染和继发感染的存在,其他猪呼吸道疾病的发病率,特别是猪呼吸道疾病复合征发病率的降低,也可以作为评价猪支原体肺炎防控效力的主要临床指标之一。
1.2 肺脏病变评分 肺脏肉变评分主要有55分法和28分法两种(见图1)。55分法即Goodwin评价法[10],根据不同肺叶所占的比例进行病变程度打分,其中,每个心叶,尖叶最大值为10分,膈叶和副叶最大值为5分,最高55分。评定后将各肺叶评定的得分相加即为肺病变得分(不考虑各肺叶的大小),分数越高,肺炎症面积越大,损伤越严重,其中5分为轻微,10分为中度,15分为重度,20分为严重。28分法即Madec和Kobisch评分法[11],是根据对7个肺叶病变程度按猪支原体肺炎特异性损伤的肺叶面积(其中副叶只观察腹面,其他6个肺叶腹面和背面均需观察)占该肺叶表面积的比例进行评定[11],每个肺叶最高为4分,其中,无损伤为0,损伤面积占肺叶面积的1% ~25%为1分,26% ~50%为2分,51% ~75%为3分,大于75%为4分。各得分用如下公式进行计算总得分:(各肺叶背面观察得分之和+各肺叶腹面观察得分之和)/2+副叶观察得分。最终结果进行四舍五入取整,最大得分为28分。肺部病变积分对于平均日增重和饲料转化率有直接联系,特别在与其它病原混合感染后可导致严重的肺部病变。这些评价系统可用于呼吸系统疾病的流行情况调查以及疫苗免疫效果评价。
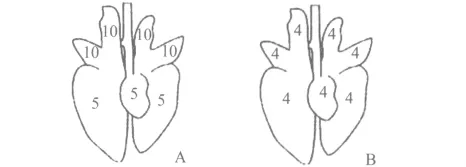
图1 肺脏肉变评分图
1.3 效益核算 猪支原体肺炎控制和净化的中效益核算指控制前后猪场所增加的收入和所增加的成本之差。其中成本的核算较为简单,主要涉及所用的疫苗和药物,增加的人工、设备和建筑,清群的猪群等。然效益的评估和计算较为复杂,其主要评价指标除了猪支原体肺炎及其他呼吸道疾病的发病率和死亡率的减少之外[11],料肉比,平均日增重[13]和出栏时间也是评价猪支原体肺炎控制和净化的主要指标之一。Bara[14]在进行瑞士减群法净化猪支原体肺炎的评价中,统计了一个猪场净化前后连续四年的平均日增重和出栏时间,发现四年内育肥猪的平均日增重从净化前的585 g上升到713 g,出栏时间从净化前的179 d下降到141 d,而每年猪气喘病的控制和净化费用从最初的每头母猪87.2澳元/年逐渐下降到0澳元/年。Tzivara A等[15]将临床症状,酮体重和出栏屠宰后的肺脏病变作为使用猪肺炎支原体灭活疫苗后的评价指标,结果发现两个监测的猪场虽然未观察到临床症状,但免疫组比非免疫组的酮体重分别重6 kg和4 kg。这些数据表明料肉比,平均日增重和出栏时间作为猪支原体肺炎防控和净化的效益指标比临床症状的观察更为精确。
1.4 血清学检测 在未使用疫苗免疫的情况下控制和净化猪支原体肺炎,血清中猪肺炎支原体特异性抗体的下降也可作为评价指标之一。Ciprián A等[4]在口服氟苯尼考控制人工感染猪肺炎支原体的疗效研究中发现,口服氟苯尼考组的血清抗体在30日龄时相比未加药物组显著降低。Yeske E[16]采用全群注射泰拉菌素的方法净化猪肺炎支原体的评价方法有临床症状,育肥猪出栏前的血清抗体浓度,达到没有临床症状,血清抗体皆为阴性时判定为净化成功。这些均表明在未使用疫苗免疫的情况下血清猪肺炎支原体特异性抗体浓度的降低可作为猪支原体肺炎控制和净化效果的评价指标。
1.5 猪肺炎支原体病原检测 猪支原体肺炎控制和净化后,肺炎支原体病原的检测是最根本的指标。病原检测方法有各种PCR法,免疫组化法,免疫荧光法等等。其中套式PCR法和荧光定量PCR法检测最为敏感,且样品的采集部位有鼻拭子、口咽拭子、气管拭子、气管灌洗液和肺组织等多种[17],可根据具体情况选择不同的采样部位进行采样。Fablet C等[18]用鼻拭子、口咽拭子、支气管拭子和支气管肺泡灌洗液这四种方法对同一批猪进行活体采样,分别用套式PCR和荧光定量PCR检测猪肺炎支原体以探讨四种方法的敏感性,发现支气管拭子和支气管灌洗液敏感性较前两者高,说明检测猪肺炎支原体,支气管采样是比较好的部位,但这两种方法的样品采集较为复杂,一般适合个体样本的采集,群体样本采集鼻拭子较为常用。Tamiozzo PJ[19]在瑞士减群法净化猪肺炎支原体后对其后代的监测上,采用了血清抗体和病原检测的评价指标,先间隔一定时间采集血清和鼻拭子分别进行ELISA和N-PCR检测,到150日龄时屠宰猪如果发现有肺部病变,再用免疫组化法进行病原检测,可见病原检测在猪支原体肺炎控制和净化评价指标的重要地位。
2 疫苗免疫后的免疫学评价方法
疫苗免疫是猪支原体肺炎控制和净化的关键措施之一,临床上也需要对疫苗使用前后的各项指标进行充分的评估和效益分析,才能更好的指导疫苗的临床应用。除了上述常规评价方法之外,各种免疫学指标也是疫苗免疫独特的评价内容。目前市场上有灭活疫苗和弱毒活疫苗两种猪肺炎支原体疫苗,由于这两种疫苗的主要免疫机理有所不同,故评价参数的侧重点也有所不同。
2.1 灭活疫苗以体液免疫为主的评价方法 接种猪肺炎支原体灭活疫苗能够降低肺炎的发生率、影响血清抗体生成量。Villarreal等[20]在5种猪肺炎支原体灭活疫苗免疫效果的研究中发现虽然所有疫苗组肺部肉变指数与对照组相比差异均不显著,但这些苗均能引起猪肺炎支原体特异性抗体的升高。Reynolds SC等[21]在研究猪支原体肺炎灭活疫苗疗效的试验中,也发现无论是阴性场还是阳性场,用过疫苗的试验组抗体滴度均比非免疫组高。这些结果均表明灭活疫苗免疫后以血清抗体的升高作为其主要评价指标较为敏感。虽然灭活苗依靠佐剂也能激发机体的细胞免疫,引起一些细胞因子的变化[22],然而,检测这些指标的代价昂贵,且针对性差,所以除人为试验以外,临床上基本不把细胞因子的变化作为猪肺炎支原体灭活疫苗免疫效果的评价指标。
2.2 弱毒活疫苗以黏膜免疫为主的评价方法
猪肺炎支原体弱毒活疫苗的免疫途径为肺内注射,以激发机体的黏膜免疫和细胞免疫为主。Feng ZX等[23]建立了上呼吸道猪肺炎支原体特异性可溶性IgA(sIgA)的ELISA检测方法,敏感度高,且鼻拭子采样即可,操作简单。后来Feng ZX等[24]通过动物实验证明了免疫猪支原体肺炎活疫苗(168株)后sIgA浓度显著升高,临床症状及肺部病变显著下降,说明sIgA可以作为评价弱毒活疫苗免疫效力的主要指标。
3 气溶胶中猪肺炎支原体检测指标的应用前景
作为呼吸道传播的疾病,将气溶胶检测猪肺炎支原体作为猪场气喘病的诊断和阴性群判定指标的研究已初见端倪。Dee S和Otake S等[25-27]都利用液体气旋式采样器检测空气中的Mhp气溶胶,以此来判定猪肺炎支原体的阴阳性。所以猪场在猪支原体肺炎的防控和净化中,如未用猪支原体肺炎弱毒活疫苗,猪舍单位体积空气中的猪肺炎支原体浓度的下降可能可以作为猪支原体肺炎防控效果的评价指标之一。目前,猪肺炎支原体强毒株和商品化的猪支原体肺炎弱毒活疫苗(168株)的分子生物学鉴别诊断虽未见报道,但商品化弱毒疫苗猪支原体肺炎(168株)的全基因序列已经测出[28],如能通过病原检测的方法区分猪肺炎支原体野毒株和弱毒疫苗株(168株),猪舍内气溶胶中野毒株和疫苗株浓度的变化将可能成为一个较好的猪支原体肺炎弱毒活疫苗的免疫评价参数。
4 结语
猪场进行猪支原体肺炎的控制和净化,其根本目的是经济效益,所以进行各种防控措施前后,必须对防控措施的效益进行详细的评估。不同防控措施的具体评价指标略有不同,以药物控制为主要措施的评价指标有:猪支原体肺炎及其他呼吸道疾病的发病率和死亡率的减少,育肥猪平均日增重的增加,存栏时间的减少,血清抗体滴度的变化,猪肺炎支原体病原的减少等等。以疫苗免疫为主的评价指标除了上述指标之外,各种免疫学指标如血清抗体滴度,上呼吸道可溶性IgA浓度的增加等等。所以,进行经济效益评价时一定要细致和全面,并进行必要的实验室检测。
[1]Maes D,Segales J,Meyns T,et al.Control of Mycoplasma hyopneumoniae infections in pigs[J].Vet Microbiol,2008,126(4):297-309.
[2]Evans.Elimination of Mycoplasma hyopneumoniae and actinobacilus pleuropneumonia by“Swiss depopulation”combined with segregated medicated early weaning[C].Proceedings of the 19th IPVS congress.Copenhagen,Denmark,2006:316.
[3]Alfonso A,Geiger J O,Freixes C.Mycoplasma hyopneumoniae and PRRSV elimination in a 1700 sow multi-site system[C].Proceedings of the 19th IPVS congress.Copenhagen,Denmark,2006:174.
[4]Ciprian A,Palacios J M,Quintanar D,et al.Florfenicol feed supplemented decreasetheclinicaleffects ofMycoplasma hyopneumoniae experimental infection in swine in Mexico[J].Res Vet Sci,2012,92(2):191-196.
[5]Nathues H,Spergser J,Rosengarten R,et al.Value of the clinical examination in diagnosing enzootic pneumonia in fattening pigs[J].Vet J,2012,Inpress.
[6]刘茂军,苗连叶,赵永前,等.猪支原体肺炎活疫苗(168株)临床试验[J].畜牧与兽医,2009,41(8):93-95.
[7]华利忠,冯志新,刘茂军,等.瑞士减群法在猪肺炎支原体净化中的应用研究进展[J].中国农学通报,2012,28(14):73-78.
[8]Marco E,Quiroga M,Menjón R,et al.Eradication of Mycoplasma hyopneumoniae in a head using aivlosin[C].Proceedings of the 20th IPVS Congress.Durban,South Africa:Hein jonker media management,2008:197.
[9]邵国青.猪喘气病的控制与净化方法的建议[J].养猪,2010,(6):65-69.
[10]李祥健,刘有昌,赵东升.猪支原体肺炎免疫效果的评价[J].今日养猪业,2009,(5):25-27.
[11]张 亚.基于黏膜免疫的Mhp间接ELISA检测方法的建立及应用[D].南京,南京农业大学,2011:21-30.
[12]Zimmermann W.Eradication of chronic lung diseases(EP &APP)of swine herds on a regional basis in Switzerland[M].2005 Swine information CD-ROM.American association of swine veterinarians,2001:39-41.
[13] Christiansen S,Szancer J.Attempt to eradicate Mycoplasma hyopneumoniae,actinobacillus pleuropneumoniae,and PRRS virus from an infected head by strategic medication[C].Proceedings of the 19th IPVS congress.Copenhagen,Denmark,2006:315.
[14]Bará.Eradication of Mycoplasma pneumonia first reported Swiss depopulation in Australia[C].Proceedings of the 17th IPVS Congress.Lowa,USA:2002:107.
[15]Tzivara A,Kritas S K,Bourriel A R,et al.Efficacy of an inactivated aqueous vaccine for the control of enzootic pneumonia in pigs infected with Mycoplasma hyopneumoniae[J].Vet Rec,2007,160(7):225-229.
[16]Yeske P E.Mycoplasma eradication from an acute outbreak heard using DRAXXIN.(Tulathromycin)[C].Proceedings of the 20th IPVS Congress.Durban,South Africa:Hein jonker media management,2008:110.
[17]张 旭,白方方,武昱孜,等.PCR技术检测猪肺炎支原体研究进展[J].生物技术通报,2012,(5):54-60.
[18]Fablet C,Marois C,Kobisch M,et al.Estimation of the sensitivity of four sampling methods for Mycoplasma hyopneumoniae detection in live pigs using a Bayesian approach[J].Vet Microbiol,2010,143(2-4):238-245.
[19]Tamiozzo P J,Sernia C H,Carranza A I,et al.Monitoring the presence of Mycoplama hyopneumoniae in the offspring of sows on a farm that used the“Swiss Method”for mycoplasma hyopneumoniae eradication[C].Proceedings of the 19th IPVS congress.Copenhagen,Denmark:Narayana Press,2006:398.
[20]Villarreal I,Vranckx K,Calus D,et al.Effect of challenge of pigs previously immunised with inactivated vaccinescontaining homo-logousand heterologous Mycoplasma hyopneumoniae strains[J].BMC Vet Res,2012,8:2.
[21]Reynolds S C,St Aubin L B,Sabbadini L G,et al.Reduced lung lesions in pigs challenged 25 weeks after the administration of a single dose of Mycoplasma hyopneumoniae vaccine at approximately 1 week of age[J].Vet J,2009,181(3):312-320.
[22]Procajlo Z,Srzweda W,Siwicki A K,et al.Indices of nonspecific and specific humoral immunity in pigs immunomodulated with the bioimmuno preparation and/or immunised with the respisure one vaccine against Mycoplasmal pneumonia of swine[J].Pol J Vet Sci,2010,13(3):447-455.
[23]Feng Z X,Shao G Q,Liu M J,et al.Development and validation of a SIgA-ELISA for the detection of Mycoplasma hyopneumoniae infection[J].Veterinary Microbiology,2010,143(2-4):410-416.
[24]Feng Z X,Shao G Q,Liu M J,et al.Immune Responses to the Attenuated Mycoplasma hyopneumoniae 168 Strain Vaccine by Intrapulmonic Immunization in Piglets.Agricultural Sciences in China[J].2010,9(3):423-431.
[25]Dee S,Otake S,Deen J.Use of a production region model to assess the efficacy of various air filtration systems for preventing airborne transmission of porcine reproductive and respiratory syndrome virus and Mycoplasma hyopneumoniae:results from a 2-year study[J].Virus Res,2010,154(1/2):177-184.
[26]Dee S,Otake S,Oliveira S,et al.Evidence of long distance airborne transport of porcine reproductive and respiratory syndrome virus and Mycoplasma hyopneumoniae[J].Vet Res,2009,40(4):39.
[27]Otake S,Dee S,Corzo C,et al.Long-distance airborne transport of infectious PRRSV and Mycoplasma hyopneumoniae from a swine population infected with multiple viral variants[J].Vet Microbiol,2010,145(3/4):198-208.
[28]Liu W,Feng Z X,Fang L R,et al.Complete genome sequence of Mycoplasma hyopneumoniae strain 168[J].J Bacteriol,2011,193(4):1016–1017.
