液相色谱串联质谱法测定饲料中黄霉素A的含量
2012-11-14李金强沙美兰李晓玉尹大路
李金强,沙美兰,李晓玉,尹大路
(烟台出入境检验检疫局,山东烟台 264000)
黄霉素(Flavomycin)又名斑伯霉素、莫诺霉素[1-2],至少含有5种活性成分,以黄霉素A为主,其分子量为1582,主要对革兰氏阳性菌有抗菌作用[3-7]。中国于1993年允许使用,目前在养殖业中被广泛应用,早在2005年欧盟农业部长会议就决定,黄霉素等四种抗生素自2006年起禁止使用,其他许多国家也相继出台了禁用规定[8-9]。目前检验检疫部门已将黄霉素列为饲料和动物源性食品残留监控计划,因此该方法的制定将为饲料中黄霉素检测及监控计划提供技术支持。由于黄霉素预混剂主要成分为黄霉素A,含量大于总活性的成分的 50%[10],农业部兽药质量标准中也有规定[11],可以通过检测黄霉素A的含量间接监控样品中黄霉素的添加量。黄霉素对动物骨骼的发育有影响,大量摄入对造血功能有损害,其对动物及人体的其他危害尚在研究中[12-14]。
1 材料与方法
1.1 仪器与试剂 分析天平(感量0.1 mg);6490液相色谱-串联质谱仪ESI源(美国安捷伦公司);固相萃取装置;milli-Q超纯水系统;0.45 μm滤膜;漩涡混合器;离心机(安亭)。500 mg/6 mL HLB固相萃取柱,购自Waters公司;甲醇、乙腈均为色谱纯,购自德国Meker公司;乙酸铵为分析纯;实验用一级水由Millipore超纯水系统制备;乙酸铵溶液(10 mmol/L):称取0.77 g乙酸铵加适量水溶解,最后定容至1000 mL,用前过0.45 μm的滤膜,现用现配;提取液:25%氨水+甲醇(1+9)体积比。
1.2 试验方法
1.2.1 黄霉素A标准溶液 黄霉素标准品购自德国Dr.Ehrenstorfer公司,为预混剂,含量 8.0%,C 13655300,Lot:91105。称取相当于含黄霉素A的标准品50 mg(准确至0.1 mg)的预混剂,用甲醇溶解并定容至50 mL,配制成浓度为1000 mg/L的标准储备液,储存于-18℃冰箱中(保存期6个月),标准工作液和系列标准工作液根据需要现用现配。
1.2.2 样品处理 样品充分混匀后,称取5 g(精确至0.1 g),置于50 mL离心管中,准确加入提取液15 mL,盖好试管盖,在漩涡混合器上混匀2 min,5000 r/min离心5 min。将上清液转移到另一个离心管中,残渣中加入15 mL提取液,重复操作一次,合并两次上清液,混匀备用。对于含油脂高的动物性饲料,将5 mL正己烷加入到提取液中,漩涡混合2 min,静置分层后弃去上层正己烷层。准确移取15 mL上清液,于旋转蒸发仪上45℃水浴蒸发至近干,加1 mL甲醇15 mL水溶解残渣,充分混匀后注入经5 mL甲醇和5 mL水预先活化的HLB柱,控制过柱速度不超过1 mL/min,待样液全部流过净化柱后,用5 mL水淋洗柱子,抽干2 min后,用2 mL氨水甲醇(9+1)洗脱,洗脱液经氮气吹至近干,用甲醇定容至1 mL,充分混匀后10000 r/min离心10 min,取上清液过0.25 μm的滤膜,滤液供质谱测定。
1.2.3 液相色谱条件 色谱柱:Agilent Ecillps C18 150 mm ×2.1 mm,内径1.7 μm,或相当者;柱温 25℃;流动相:A为乙腈,B为10 mmol/L乙酸铵溶液,梯度洗脱(表 1);流速 0.3 mL/min;进样量 10 μL。

表1 流动相梯度参数
1.2.4 质谱条件 离子源:ESI源;扫描方式:负离子模式(negative);检测方式:多反应监测(MRM);雾化气温度:350℃;毛细管电压:4.0 kV;离子驻留时间:200 ms;碰撞能(CE值):22;碎裂电压(fragmentor):135;选择离子:m/z 789.9/553.8(定性离子),m/z 789.9/575.7(定量离子)。
2 结果与分析
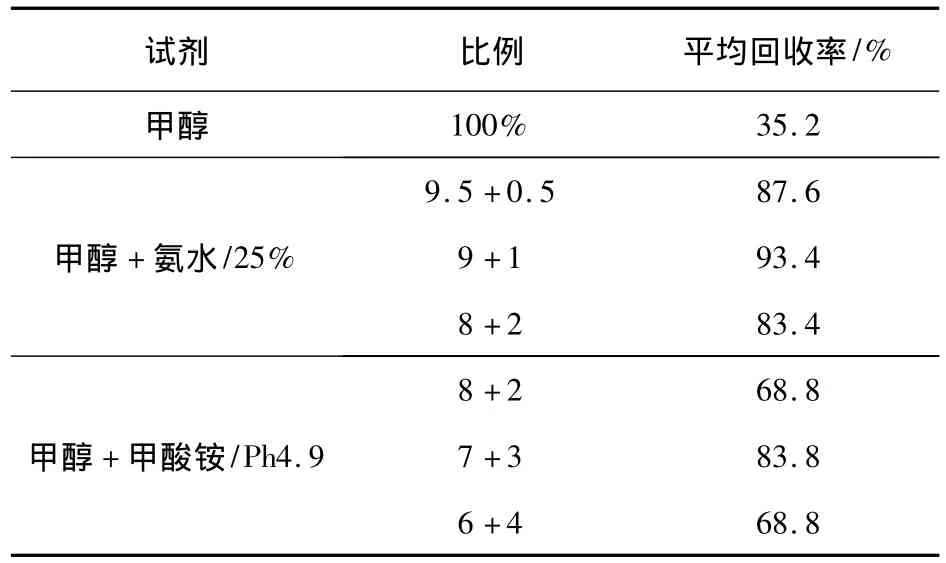
表2 不同提取试剂黄霉素A的检测结果(n=5)
2.1 提取试剂与净化条件的选择 由于黄霉素为强极性化合物,易溶于水,在提取方式的选择上,文献中采用超声提取的方式[1],试验中采用漩涡混合和水浴超声两种提取方式进行了对比,对同一添加浓度的样品,提取时分别采用漩涡混合2 min和超声10 min,结果两种方法的回收率没有显著差别,但漩涡混合节约提取时间。提取溶剂的选择上,有文献采用甲醇甲酸铵提取[2],也有用氨水甲醇提取[1],对此方法设计了三种不同的提取试剂组合,结果见表2,由表2可见,三种不同的提取试剂组合中,1+9的氨水甲醇平均回收率为93.4%,其他的最高只有87.6%,因此选择1+9的氨水甲醇作为饲料中黄霉素A检测的提取试剂。净化方法上,由于饲料成分复杂,基质干扰严重,在这种情况下,对一低浓度添加样品(500μg/kg)设计了4种不同的净化方法,一是过C18固相萃取柱,甲醇洗脱[2];二是过HLB净化柱,氨水甲醇洗脱[1]。结果见表3,由表3可见,提取液经HLB柱净化所测得的黄霉素A的回收率高,几乎无基质干扰,所以选用500 mg/6 mL HLB柱作为净化柱。

表3 两种不同的净化柱对黄霉素A净化提取的回收率(n=5)
以固体饲料为例,称样5 g,30 mL试剂提取一次。
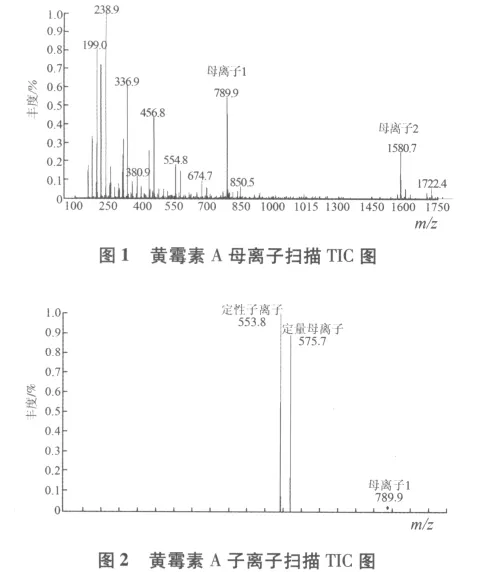
2.2 质谱条件的确定 选择质谱条件时,发现黄霉素A在电离时产生两个母离子,即[M-H]-m/z 1580.7 和[M-H]2-m/z 789.9 见图 1,离子[M-H]2-m/z 789.9的响应值较高,所以用选用[M-H]2-为检测母离子,其子离子分别为 m/z 575.7(定量离子)和 m/z 553.8(定性离子),子离子扫描TIC图见图2,MRM质谱色谱图见图3。
2.3 方法的线性范围与检出限 移取一定量的黄霉素A标准工作液,用甲醇稀释成100、250、500、1250、5000 μg/L 的系列标准工作液,每次进样10 μL进行测定,以质量浓度x为横坐标,峰面积Y为纵坐标,绘制标准工作曲线,线性图见图4,结果表明黄霉素A在该浓度范围线性良好,线性方程为Y=37.0145x-269.2284,相关系数 r=0.999725。以S/N=3所对应的黄霉素A的含量30 μg/kg,作为方法的检出限(LOD),以S/N=10所对应的黄霉素A的含量100 μg/kg,作为方法的最低定量限(LOQ)。
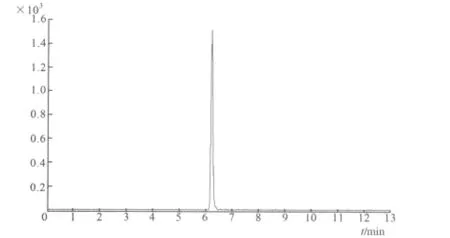
图3 黄霉素A标准(MRM)质谱色谱图
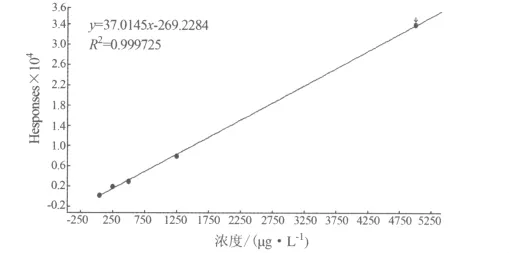
图4 线性图
2.4 方法的回收率和精密度 为了确定方法的回收率和精密度,在动物性饲料和植物性饲料两种基质中进行了不同浓度的黄霉素A添加回收试验,结果见表4。由表4可见,两种基质添加样品的测定结果平均回收率均在70%以上,批内及批间相对标准偏差均小于10%,说明该方法有良好的精密度。
3 结论
检测过程中的提取和净化是关系到方法回收率和检出限的关键所在,对方法的准确度和精密度均有较大的影响,另外仪器条件的选择也关系到方法的灵敏度和检出限。本项目在参考文献的基础上,经过优化,建立了饲料中黄霉素A的液相色谱串联质谱检测方法,方法简便,数据重复性好,检出限和定量限均能满足日常检测的要求,适合饲料中黄霉素A的测定。

表4 方法的回收率和精密度
[1]Gallo P,Fabbrocino S,Serpe L,et al.Determination of the banned growth promoter moenomycin A in feed stuffs by liquid chromatography coupled to electrospray ion trap mass spectrometry[J].rapid communcation in mass spectrometry,2010,24(7):1017-1024.
[2]李会荣,刘继明,强 莉,等.饲料中黄霉素A的测定[J].中国畜牧杂志,2010,46(14):37-38.
[3]Butaye P,Devriese L A,Haesebrouck F.Clin Microbiol[R].Rev.Cross Ref,Pub Med,CAS,Web of ScienceⓇ.2003,16:175.
[4]Pfaller M A.Diag Microbiol.Infect Dis[R].Cross Ref,Pub Med,CAS,Web of ScienceⓇ.2006,56:115.
[5]Edwards J E,Mcewan N R,Mckain N,et al.Microbiology[J/OL].Cross Ref,Pub Med,CAS,Web of ScienceⓇ.2005,151:717.
[6]Edwards J E,Mcewan N R,Wallace R J.Appl Microbiol[J/OL].Direct Link:Abstract Full Article(HTML)PDF(199K)References.2008,104:1617.
[7]Kurz M,Guba W,Vertesy L.Eur Biochem[J/OL].Direct Link:Abstract PDF(690K).1998,252:500.
[8]Commission of the European Communities.Update(situation as 30 April 2004)of the list of the authorised additives in feedingstuffs published in application of Article 9t(b)of Council Directive 70/524/EEC concerning additives in feedingstuffs.[EB/OL].Off J Eur Commun,2004,50:1.
[9]European Commission.Regulation 1831/2003/EC of the European Parliament and of the council on additives for use in animal nutrition.[EB/OL].Off J Eur Commun,2003,L268:29.
[10]杨秀玉,吴好庭,张秀英.高效液相色谱法检查不同厂家的黄霉素中黄霉素A的相对量[J].中国兽药杂志2003,37(12):22-24.
[11]农业部兽药质量标准2003年增补版[S].
[12] Boxall A B A,Kolpin D W,Halling-Serensen B,et al.Environ Sci Technol[J/OL].Cross Ref,Pub Med,CAS,Web of ScienceⓇ.2003,37:286A –294A.
[13] Pérez S,Mcjury B E,Eichhorn P,et al.Chromatogr A [J/OL].Cross Ref,Pub Med,CAS,Web of ScienceⓇ.2007,1175:234.
[14] Jeong S H,Song Y K,Cho J H.Regul Toxicol Pharmaceut[J/OL].Cross Ref,CAS,Web of ScienceⓇ.2009,53:209.
