中药制剂对大肠杆菌耐药性逆转的作用研究
2012-11-14张秀英赵富华段文龙孙玉梅
张秀英,宋 立,赵 晖,赵富华,段文龙,孙玉梅,范 强
(中国兽医药品监察所,北京 100081)
在养殖业发展过程中,抗菌药物发挥了重要的作用,但抗菌药物长期滥用和低剂量使用,使动物源耐药病原菌的产生与扩散,造成治疗失败,对养殖业带来很大的损失。有证据表明,自允许在食品动物中使用氟喹诺酮类抗菌药物后,耐氟喹诺酮类菌明显增多,出现了多重耐药,耐药性已经成为二十一世纪人们亟待解决的难题[1-2]。在中药抗感染治疗中,细菌对抗感染中药及其复方不易产生耐药性,且部分中药具有延缓、消除耐药性的现象,增加了对抗细菌耐药性的措施与策略[3]。本文从我国传统中药入手,以突变恢复为理论依据,选择复方苍术口服液和复方十大功劳颗粒作用恩诺沙星耐药菌株,使耐药大肠杆菌恢复对恩诺沙星的药物敏感性。
1 材料与方法
1.1 试验菌 大肠杆菌5株:均分离于健康猪肛拭子,1#(2009年分离于天津某健康猪场)、2#(2009年分离于天津某健康猪场)、3#(2008年分离于南宁某健康猪场)、4#(2007年分离于江苏某健康猪场)和5#(2007年分离于江苏某健康猪场),由中国兽医药品监察所耐药性监测实验室分离和鉴定;标准质控菌株CMCC 44113,购自中国药品生物制品检定所。
1.2 培养基 营养琼脂培养基、营养肉汤培养基和水解酪蛋白肉汤,从中国兽医药品监察所基础保障室提供。
1.3 药品和试剂 恩诺沙星对照品(批号H0080807,含量 99.5%)、硫 酸小檗碱 (批号20080201,含量 90.0%)和盐酸小檗碱(批号Z0220712,含量:98.7.0%)由中国兽医药品监察所提供;巴马汀对照品(批号:110732-200907,含量:100.0%)和盐酸药根碱(批号:0733-200005,含量:100.0%),购自中国药品生物制品检定所;复方苍术口服液(每100 mL相当于原生药366 g,批号20080802)和复方十大功劳颗粒(每50 g相当于原生药500 g,批号20080802),由某单位提供;乙腈和甲醇为色谱纯试剂;磷酸二氢钾、磷酸等为国产分析纯试剂。
1.4 药物溶液的制备
1.4.1 恩诺沙星贮备液 准确称取恩诺沙星对照品约51.3 mg,先加约一半的水,然后滴加0.1 mol/L的氢氧化钠溶液溶解后,用水稀释至10 mL,配制成5120 μg/mL的溶液。
1.4.2 硫酸小檗碱贮备液 取硫酸小檗碱210.5 mg,用水稀释至25 mL,配制成8 mg/mL的溶液。
1.4.3 复方十大功劳贮备液的制备 取复方十大功劳颗粒1 g,加灭菌水10 mL溶解,制成每1 mL中含生药1 g的溶液。
1.4.4 复方苍术口服液贮备液 取原液作为贮备液
1.4.5 液相对照品溶液 准确称取盐酸小檗碱对照品、盐酸巴马汀对照品和盐酸药根碱对照品适量,加乙腈-水(3∶7)混合溶液制成每1 mL含100 μg、50 μg 和50 μg 的溶液。
1.4.6 液相药物溶液 取供试品1 g,精密称重,精密加入盐酸-甲醇(1∶100)混合溶液50 mL。超声处理30 min,放冷,摇匀,滤过,即得。
1.5 主要仪器 高效液相色谱仪:Waters 2695色谱仪、2487紫外检测器、自动进样器;数字比浊仪99234,威泰科学有限公司。
1.6 中药制剂中生物碱含量的测定[4]以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.05 mol/L磷酸二氢钾缓冲液(用磷酸调pH值至3.0)(30∶70)为流动相;检测波长为265 nm。理论板数按小檗碱峰计算应不低于5000。取液相对照品溶液和药物溶液,分别用0.22 μm滤膜过滤后,精密量取20 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算,即得。
1.7 最小抑菌浓度测定[5]取测试菌用划线法涂布普通琼脂平板,35℃培养16~24 h,挑取3~4个单个菌落,用4 mL无菌生理盐水配成0.5麦氏单位的菌悬液,用M-H肉汤稀释100倍,配制成约5×105~106CFU/mL浓度。将各药物贮备液用M-H肉汤稀释10倍后,在96孔板的第1个孔中加入0.1 mL,然后按2倍稀释法逐步稀释至一系列所需浓度,每孔抗生素溶液体积为0.1 mL,设阴性和阳性对照。然后往各孔板中分别加入0.1 mL菌液,混匀。置35℃培养16~20 h,取出培养后的板,观察结果,在标准质控菌株的最低抑菌浓度符合规定范围[6](恩诺沙星的 MIC 为 0.008 ~ 0.03 μg/mL)的前提下,以无菌生长的最低抗菌药物溶液的浓度为最低抑菌浓度(MIC)。
1.8 中药制剂的耐药逆转作用研究 取复方苍术口服液0.25 mL和复方十大功劳颗粒0.25 g,分别加营养肉汤至1 L,加入各试验菌从1代连续传代培养。培养条件为:35±2℃,培养16~20 h。同时用肉汤培养基传代作为阴性对照(营养肉汤中不含药物)。每代培养后测定耐药菌对恩诺沙星的MIC,观察MIC的变化。
1.9 染色体耐药基因突变的检测 根据Genbank公布的 gyrA、gyrB、parC和 parE这四种基因的QRDRs序列,采用Primer 5.0软件设计相应引物,引物序列为:gyrA F:TGCGATGTCGGTCATTGTT,R:CGTTCACCAGCAGGTTAGG。gyrB F:AAAAGCCAAAGTTAGCGCCACCG,R:CACGACCGATACCACAGCCAAGC。parC F:CGTGCGTTGCCGTTTATT,R:GCAGGTTATGCGGTGGAAT。ParEF:CGATGCGTGAGTTCTGTGA,R:GTTCGGCTTGCCTTTCTT。以煮沸法提取大肠杆菌DNA作为模板,进行PCR扩增,反应条件为:94℃预变性5 min,94℃变性45 s,各对引物退火45s,72 ℃延伸1 min,32个循环;最后72℃延伸5 min。将阳性基因片段测序,确认染色体DNA的突变状况。
2 结果
2.1 中药制剂中生物碱的含量 复方十大功劳颗粒中含有小檗碱、巴马汀和药根碱的浓度为0.01 mg/mL、0.006 mg/mL 和 0.02 mg/mL;复方苍术口服液中未检出上述3种成分。
2.2 大肠杆菌的MIC 采用从不同地区筛选分离得的5株猪源大肠杆菌测定,5株菌均对恩诺沙星不同程度的耐药,测定的 MIC范围为32~640 μg/mL,选择5株作为测试菌株,耐药状况见表1。测定5株耐药菌株对硫酸小檗碱、复方苍术口服液和复方十大功劳颗粒的MIC,结果硫酸小檗碱对5株菌株的MIC均大于2 mg/mL;复方苍术口服液和复方十大功劳颗粒对5株菌均无抑菌作用。
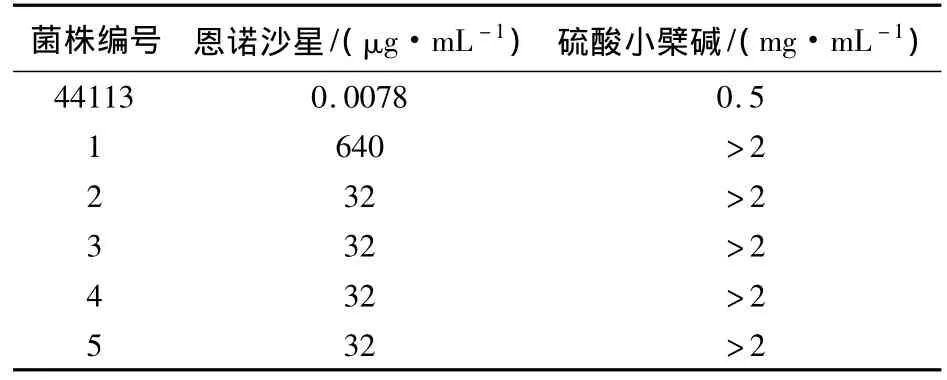
表1 5株菌对恩诺沙星和硫酸小檗碱的MIC
2.3 中药制剂的耐药逆转作用 结果3株菌株在加有2种药物培养基中传代7代后,MIC均降低了8倍以上,耐药株逆转率为60%。阴性对照的MIC均在质控范围内。
2.4 染色体耐药基因的测定结果 经过中药作用后,MIC降低的菌株,GyrA和ParC上发生了有意义的变化,由原来的耐药突变状态,恢复到了敏感的正常状态。表3中列出了变化的碱基和氨基酸位点。2号菌株经药物作用以后,MIC降低的同时,GyrA上的83位氨基酸恢复为正常的氨基酸序列(Leu→Ser)。3号菌株ParC基因80位氨基酸也由原来的氟喹诺酮耐药性突变状态转变为正常状态(Ile→Ser),其他位点的氨基酸突变与氟喹诺酮耐药性无关。

表2 中药培养后恩诺沙星的MIC变化汇总表
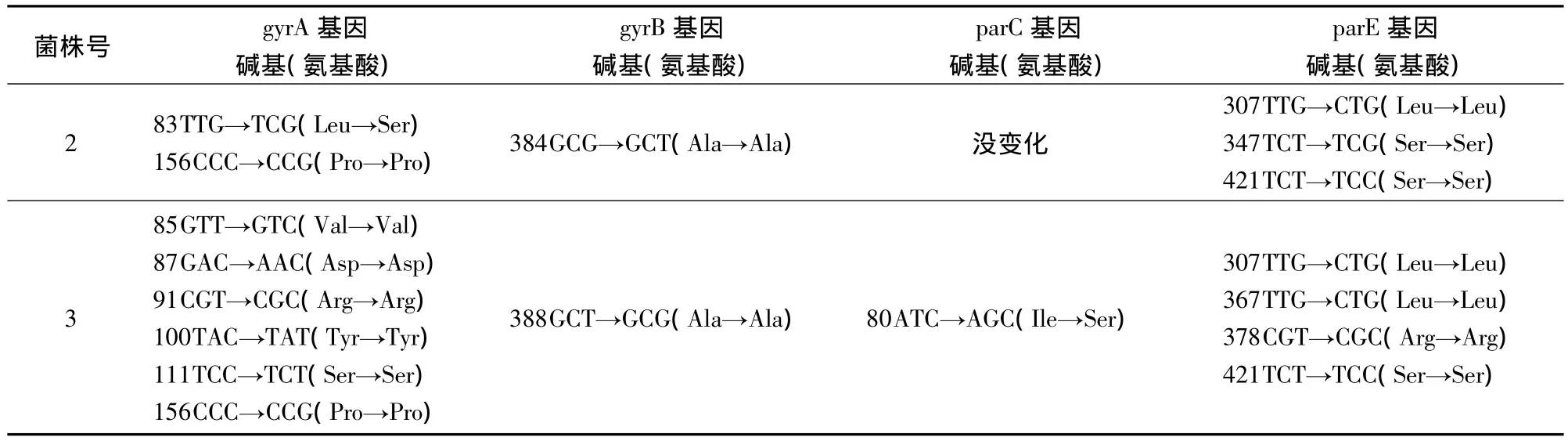
表3 中药作用前后菌株染色体碱基(氨基酸)的变化
3 讨论
3.1 采用棋盘稀释法考察中药制剂与恩诺沙星联用对5株大肠杆菌的抑菌效果,但联用后无明显的增效作用;而通过将中药制剂加入大肠杆菌培养基中,选择性培养耐药性大肠杆菌,经过一定代次后,细菌的耐药性逆转,MIC降低8倍以上,说明复方十大功劳颗粒或复方苍术口服液与恩诺沙星联用不能增强恩诺沙星对耐药大肠杆菌的敏感性,但中药制剂单独作用却可使耐药细菌恢复敏感性,此时再用恩诺沙星治疗就能取得较好疗效。
3.2 复方十大功劳颗粒中含有小蘖碱、巴马汀和药根碱等有效中药成分,复方苍术口服液中不含上述成分,两者虽然成分不相同,但均可逆转大肠杆菌对恩诺沙星的耐药性,看来本试验中耐药性的逆转与上述3种成分无直接关系,可能是中药各成分的综合抗菌能力对细菌作用的结果,中药通过消除R质粒、抑制主动外排泵和改变细菌生物膜的通透性等作用机制,从而使细菌恢复敏感性[7-9]。喹诺酮类药物的一个主要耐药机制:编码DNA旋转酶gyrA和gyrB及编码拓扑异构酶IV parC和parE的基因突变(gyrB和parE较少见),临床分离的鸡大肠杆菌对喹诺酮类药物的耐药水平与GyrA和ParC的突变密切相关,3株细菌耐药染色体基因突变导致的gyrA和ParC上的氨基酸替换是细菌恢复药物敏感性的根本原因。秦春明等也通过试验研究,证明大黄素能逆转耐药细胞株对顺铂的耐药性,对顺铂的逆转倍数分别为1.91 倍和1.30 倍[10],这是因为与耐药基因表达下调有关。李乾学等提示临床分离的鸡大肠杆菌O78的耐药水平与喹诺酮类药物的选择性压力有关,它诱导了DNA旋转酶和拓扑异构酶IV的基因突变[10]。
3.3 细菌耐药性和耐药菌感染是当前急待解决的问题,但仅凭抗菌药物又一时难以解决问题。中药抗感染的历史经验和优势,已经为动物的疾病治疗发挥了重要作用。虽然中药作为耐药抑制剂还处于初级阶段,中药的作用机制探讨不深,在今后的研究中应当以中医辩证论治作理论指导,结合中药四性五味,以现代药物研究方法为手段,抓住治疗耐药细菌感染研究的契机,开拓中药制剂治疗耐药菌感染的领域。
[1]Thomson C J.The global epidemiology of resisfauce to ciprofloxacin and the changing nafure of antibiotic resistance:a 10 year perspective[J].Journal of Antinicvobial chemotherapy.1999,43(suppl.A):31-40.
[2]林居纯,卓家珍,蒋江霞,等.不同地区猪源和禽源大肠杆茵耐药性监测[J].华南农业大学学报,2009,30(1):86-93.
[3]雷连成,韩文瑜,乔江伟.大肠杆菌耐药性中药抑制剂的初步研究[J].吉林农业大学学报,2003,25(4):429-433.
[4]国家药典委员会.中国药典二O一O年版一部[S].
[5]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial disk and dilution susceptibility tests for baterial isolated from animals[S].Approved Standard Third Edition:NCCLS,2008.
[6]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial disk and dilution susceptibility testing[S].Eighteenth:NCCLS,2008.
[7]李睿明,雷朝霞.细菌耐药性策略[J].医学与哲学,2006,27(8):45-47.
[8]虞 红,李英伦.中药逆转细菌耐药性的研究进展[J].中国畜牧兽医,2005,32(4):54-56.
[9]王 静,张淑文.中药逆转细菌耐药的研究进展[J].临床和实验医学杂志,2007,6(1):153-155.
[10]秦春明,侯华新,程道海,等.大黄素对顺铂耐药卵巢癌细胞的逆转作用及其相关基因表达研究[J].天然产物研究与开发,2011,23:638-624.
[11]李乾学,邓旭明,郭建顺,等.鸡大肠杆菌O78对喹诺酮类药物高耐药株的分子鉴定[J].中国兽医学报,2006,26:192-196.
