伊维菌素微胶囊的制备及其体外释放的研究
2012-11-14徐玉芸李宗阳齐阳光张传兵
冯 海,徐玉芸,李宗阳,齐阳光,张传兵
(1.浙江工业大学药学院,杭州 310014;2.浙江永宁制药厂,浙江台州 318020;3.杭州爱力迈动物药业有限公司,杭州 310013)
伊维菌素(Ivermectin,IVM)是阿维菌素选择性加氢的衍生物,具有较高的安全性和稳定性,是广谱、高效、低毒抗生素类抗寄生虫药,对体内外寄生虫特别是线虫和节肢动物均有良好驱杀作用,已经广泛应用于抗寄生虫的防治[1-2]。大环内酯类抗寄生虫药对线虫及节肢动物的驱杀作用,在于增加虫体的抑制性递质γ-氨基丁酸的释放,以及打开谷氨酸控制的Cl离子通道,增强神经膜对Cl的通透性,从而阻断神经信号的传递,最终神经麻痹,使肌肉细胞失去收缩能力,而导致虫体死亡。但是目前市售的伊维菌素制剂,药效维持时间短,体外释放半衰期约为30 h,体内持效期约为5~21 d,生物利用度不高,频繁过量使用导致动物产品药物残留严重,综合养殖成本增加,危害公共环境,体内药物浓度峰谷变化剧烈增加了寄生虫抗药性产生的可能性,不符合安全合理的用药原则[3-4]。所以兽用抗寄生虫制剂[5]急需研究更加长效缓释的类型,减少投药次数,降低成本,提高药物的有效性。本文采用单凝聚法和复凝聚法分别制备了低释放的伊维菌素微胶囊,并对其进行了稳定性和体外释放度的研究,旨在提高其生物利用度,降低其毒副作用的目的,制备长效缓释的新型伊维菌素制剂。
1 材料与方法
1.1 材料
1.1.1 试药 伊维菌素(杭州爱力迈动物药业有限公司,含量>96%);伊维菌素对照品(由中国兽药监察所提供,含量>99%);市售伊维菌素注射液(杭州爱力迈动物药业有限公司);明胶(国药集团化学试剂有限公司);其他试剂均为分析纯。
1.1.2 仪器 Spectramax M2e型多功能酶标仪(Molecular Devices);752单光束紫外可见分光光度计(上海菁华科技仪器有限公司);JY92-Ⅱ超声波细胞粉碎机(成都市生科仪器有限责任公司)。
1.2 方法
1.2.1 伊维菌素微胶囊的制备[6-8]单凝聚法制备工艺:取处方量明胶及表面活性剂并加入适量蒸馏水约10 g,溶胀8 h,制成溶胶。加入处方量IVM微粉,10000 r/min高速匀浆3 min。然后在 300 r/min下水浴搅拌,滴加稀盐酸溶液至 pH值为3.0~4.5后加入适量20%无水硫酸钠溶液,显微镜下观察。冰水浴冷却1~2 min,搅拌下倒入三倍量的10% 无水硫酸钠稀释液,搅拌分散,静置沉降,稀释液用蒸馏水洗涤1~2次,将微囊沉淀移至40 mL稀释液中,冰水浴继续搅拌,加适量甲醛固化2 h,静置沉降,抽滤,沉淀用异丙醇浸洗2次,抽干备用。
复凝聚法制备工艺:称取处方量伊维菌素加入到3%阿拉伯胶溶液中,超声10 min后缓慢滴入50℃等体积的3%明胶溶液中,200 r/min搅拌5 min,并同时滴加5%醋酸溶液至镜检观察成囊完好,保持溶液 pH=4。加入蒸馏水80 mL以450 r/min搅拌降温到28℃以下,冰水浴降至10℃以下,37%甲醛3 mL固化15 min,用5%NaOH溶液调节pH在8~9,冷却,300 r/min保温固化3 h后,用水和异丙醇2次洗去甲醛,抽干备用。
取两种方法制得的少量微囊,在显微镜下观察形态。结果显示单凝聚法和复凝聚法制得的微囊囊形圆整,显微镜下观察多为圆形球,表面较光滑,粒径也较均匀,复凝聚法所制微囊局部有粘连,且制备方法较单凝聚法繁琐,条件不易控制,成本较高,故选择单凝聚法制备伊维菌素微囊并进行工艺优化。
1.2.2 单凝聚法正交试验 经预实验及单因素实验结果分析,选定对制备伊维菌素微胶囊影响较显著的因素:明胶浓度、囊芯比、介质pH值和成囊温度4个因素,以包封率为考察指标,按L9(43)设计正交试验。正交设计因素和水平见表1。
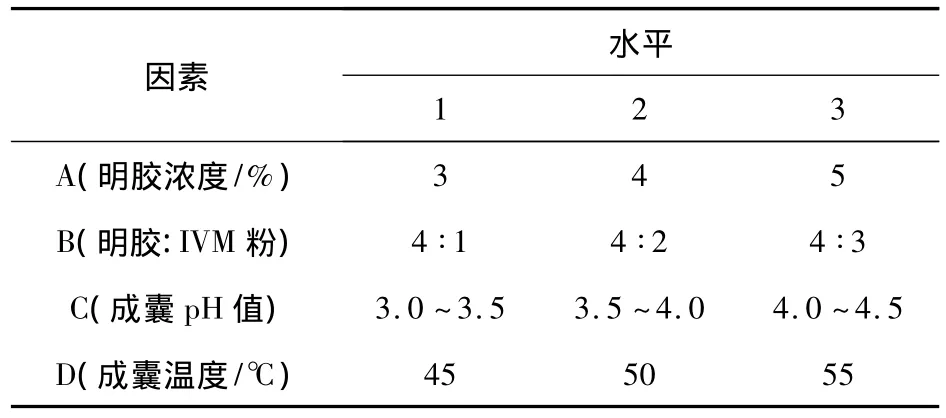
表1 单凝聚法优化正交设计因素水平表
1.2.3 微胶囊的形态观察和粒径的测定 取适量伊维菌素微囊溶液滴于250 μm格宽的细胞计数板上,在400倍显微镜下进行观察,随机选取10个视野,每个视野中的微囊不少于50粒,观察其外观形态,包括微球分散性、表面光滑度等。并采用Coolview软件进行粒径统计和正圆度分析,估算其平均粒径大小范围。
1.2.4 微囊中伊维菌素含量的测定[9]标准曲线的制备:称取伊维菌素对照品10 mg,置于100 mL容量瓶中,用甲醇定容配置100 μg/mL的储备液,分别用无水甲醇溶液稀释成 2、4、6、8、10、20、40、60 μg/mL的标准溶液,在242 nm波长处测定吸光度A242,进行线性回归。
方法精密度的测定:配制伊维菌素低、中、高浓度为4、10、40 μg/mL的伊维菌素对照品甲醇溶液三组,分别在 0、2、4、6、8 h 时刻处测定其 A242。
加样回收率的测定:向空白微胶囊溶出液中分别加入低、中、高浓度为 4、10、40 μg/mL 的伊维菌素对照品甲醇溶液,检测A242,计算回收率。回收率=实测药物含量/实际投药量×100%
微囊中IVM含量测定:精密称取40 mg微囊,加入无水甲醇,置于超声波细胞破碎机中,冰浴,电压条件为500 V,超声时间3 s,间隙时间4 s,工作次数为100次,按分光光度法测定吸光度A242。包封率(encapsulation efficiency,EE)的测定:包封率(EE%)=[微囊中伊维菌素含量/(微囊中伊维菌素的含量+介质中伊维菌素含量)]×100%。
1.2.5 伊维菌素微胶囊表征及稳定性考察 干燥失重:按照《中国药典》2010年版二部附录ⅧL测定。
红外光谱分析:分别测定伊维菌素对照品、空白明胶微囊以及伊维菌素微囊红外的谱图进行对比。
稳定性研究:包括60℃高温加速试验,75.0%高湿试验,测定主药含量变化。
1.2.6 伊维菌素的体外动态释药[10]取适量的伊维菌素市售制剂及等药量伊维菌素微囊制剂,分别装于透析袋中,采用中国药典2010版溶出度第二法,溶出介质为1%十二烷基硫酸钠溶液(SDS),温度为(37±0.5)℃,转速100 r/min,定时取样10 mL,同时补充等量的新鲜介质。根据各时间点累积的释药百分率,绘制伊维菌素市售制剂及伊维菌素微囊制剂的体外累积释药曲线。伊维菌素累积释放率:P=Qn/Q0×100%,式中Qn为第n次取样时伊维菌素的量Q0为初始伊维菌素的量。
2 结果与讨论
2.1 单凝聚法制备最优条件及其影响因素 单凝聚法微囊正交实验设计和结果见表2。

表2 伊维菌素微囊L9(43)正交实验结果
由表2分析表明A3B2C1D3为最佳制备条件,即明胶浓度为5%、囊芯比为2∶1、介质pH值为3.0~3.5、反应温度55℃时所制备的IVM微囊药物包封率最高,镜检所制得微囊为球状物,粒径分布较为均匀,表面光滑,平均粒径约为50 μm。
2.2 伊维菌素微胶囊的含药量和包封率 按1.2.4伊维菌素含量测定方法求得线性回归方程为A=0.0305C+0.0139(R2=0.9992);线性范围为4.0 ~60.0 μg/mL。回收率为 98.2%(n=5),RSD为0.6%。测得最优处方伊维菌素微胶囊的平均载药量为18.3%,包封率为63.2%。
2.3 伊维菌素微胶囊表征及稳定性考察结果
2.3.1 分别称取不同批次的伊维菌素微囊2.53 g和2.60 g,测得微胶囊的含水量为1.26% ~1.47%之间,符合2010版药典规定。
2.3.2 伊维菌素微囊的红外图谱见图1-图3。
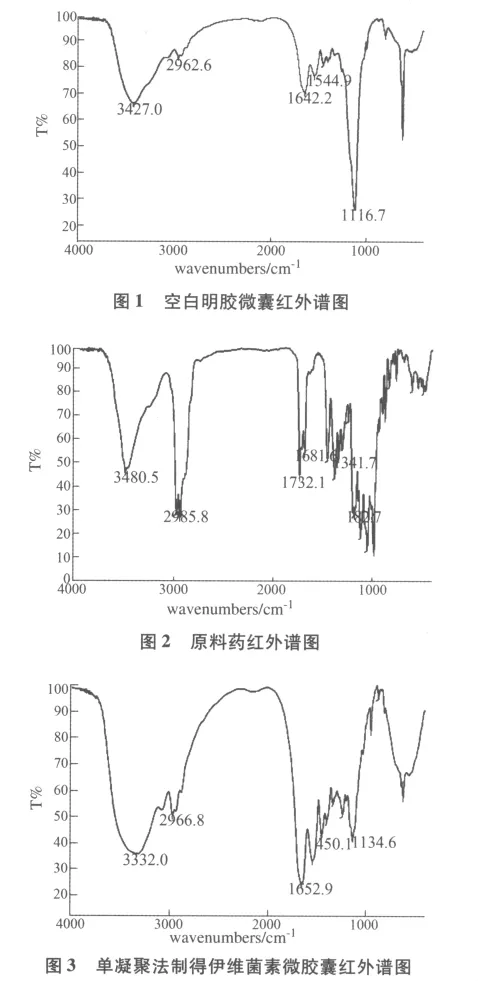
经红外光谱图分析可知最优处方其包被较为完全,伊维菌素结构无变化。
2.3.3 微囊加速稳定性测定结果如表3。
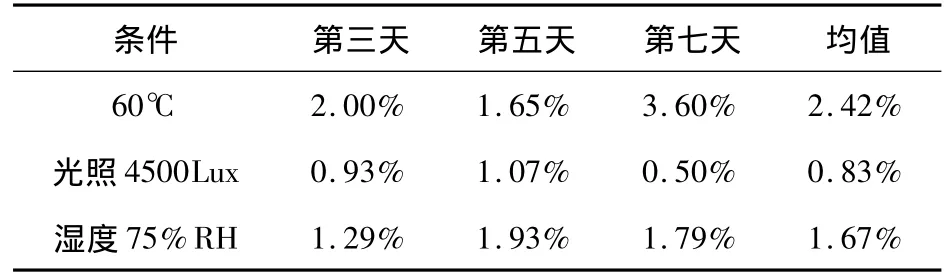
表3 伊维菌素微囊含量变化表
由上表可知,光照条件对微囊载药量影响不大,相对来说温度和湿度是对微囊稳定性有较显著的影响,微囊制剂应在干燥、阴凉处保存。
2.4 伊维菌素微胶囊体外释药的研究结果 伊维菌素为水溶性较差的药物,为满足漏槽所需条件的要求,分别选择了0.5%、1.0%两种浓度的SDS作为溶出介质进行相应的药物溶解度测定。根据测定结果,最终选择1.0%SDS水溶液为释放介质。
在1.0%SDS 释放介质中,采用 1.2.4 所述方法进行药物体外释放实验,伊维菌素微囊和伊维菌素市售制剂在释放介质中的伊维菌素累计释放率见如图4。

图4 体外平均累计释放曲线
可以看出,市售伊维菌素制剂75 h后,药物累积释放量达到93.3%。而实验室自制伊维菌素微囊18 h时释放量为30.0%,44 h后药物释放量达到51.0%,而在75 h累积释放量为60.1%,之后药物呈缓慢持续释放,所制微囊缓释效果明显。利用常用模型拟合探讨微囊的释药机制,对固化伊维菌素微囊的累积释药曲线进行拟合。可知固化伊维菌素微囊体外药物释放最符合扩散-溶蚀(Q=k0t1/2+k1t+k2t2+k3t3)数学模型。
采用单凝聚法制备伊维菌素微胶囊,影响成囊的因素较多,如明胶浓度,药物的含量,囊芯比,搅拌速度,成囊温度以及反应体系的pH值和固化时间等。在本实验中采用5%的明胶为囊材,囊芯比为1∶2,pH 为3.0~3.5左右时易成较为满意的微胶囊,凝聚后用10%的Na2SO4稀溶液进行洗涤。既保证了微囊的较高产率和良好的微囊形状,又可避免微囊的粘连,我们认为合适的搅拌速率是提高包封率的关键。本文采用单凝聚法和复凝聚法分别制备了缓慢释放的伊维菌素微胶囊,并对其进行了稳定性和体外释放度的研究,旨在提高其生物利用度,降低其毒副作用,制备长效缓释的新型伊维菌素制剂。
[1]操继跃,徐小兰,伍 治.埃维菌素类抗寄生虫药物药理学研究进展[J].中国兽药杂志,2000,34(3):47-51.
[2]Shoop W L,Mrozlk H,Fisher M H.Structure and activity of avermectins milbermycins in animal health[J].Veterinary Parasitology,1995,59:139-156.
[3]游锡火.阿维菌素类药物的药理作用及毒理作用[J].吉林农业,2000,(5):35.
[4] 朱模忠.伊维菌素[J].中国兽药杂志,2003,37(3):53-54.
[5]朱延生,王多军,吴维平,等.伊维菌素明胶缓释微囊组合剂驱虫效果研究[J].中国畜牧兽医,2009,36(2):1-3.
[6] 王毓明.微胶囊技术[J].化学教育,1999,24(4):4-6.
[7]宋 健,刘东志,张天永,等.微胶囊及微胶囊化技术的研究进展[J].化工进展.1999,1.
[8]王玉万,戴晓曦,潘贞德,等.含阿维菌素类药物长效注射剂的研究概况[J].中国兽药杂志,2007,41(12):4-9.
[9]刘 群,卢 芳,艾 青.紫外分光光度注测定伊维菌素预混剂的含量[J].中国兽药杂志,2002,36(1):21-22.
[10]黄佳英.阿霉素磁性明胶微球的制备表征及体外释放性能的研究[D].2008.
