猪肺炎支原体和猪鼻支原体双重PCR检测方法的建立与应用
2012-11-14刘茂军王占伟韦艳娜马庆红杨莉莉周勇岐邵国青
刘茂军,王占伟,韦艳娜,马庆红,杨莉莉,周勇岐,,邵国青
(1.江苏省农业科学院兽医研究所·农业部兽用生物制品工程技术重点实验室·国家兽用生物制品工程技术研究中心,南京 210014;2.南京天邦生物科技有限公司,南京 211102)
猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)是猪支原体肺炎(Mycoplasmal pneumonia of swine,MPS)的主要病原,该病又称猪气喘病或猪地方流行性肺炎(EPP),是一种猪的慢性呼吸道传染病,在全世界广泛存在,长期以来被认为是最常发生和经济意义重大的猪病之一。该病常继发或混合感染其他细菌性或病毒性疾病,引起猪呼吸道病综 合 征 (Porcine respiratory disease complex,PRDC)[1]。 猪 鼻 支 原 体 (Mycoplasma hyorhinis,Mhr)也是猪呼吸道病综合征的病原之一,并可引起多发性浆膜炎和多发性关节炎,临床上与副猪嗜血杆菌病易混淆,使鉴别诊断难度增大[1-3]。Mhr可通过滤器,在细胞培养过程中,Mhr是最主要和最常见的污染源之一,使细胞凋亡或者细胞活力下降,最终导致细胞废弃;Mhr易生长且生长快,常掩盖Mhp,导致 Mhp分离和培养失败[4-6]。目前,检测Mhp的常用方法有分离培养、微粒凝集、荧光抗体法、核酸探针法和PCR法。Mhr的检测方法报道较少,主要是分离培养和PCR等。Mhp的培养条件比Mhr要求苛刻,常被Mhr所掩盖。血清学检测方法两者之间存在交叉反应,难以区分,从而给Mhp的鉴别诊断带来了困难[7]。PCR法较其他方法敏感、快速,适宜于大批样品的检测以及流行病学的调查,目前两个病原都分别建立了普通PCR方法[8-9]。本文在先前研究的基础上,建立了Mhp和Mhr的双重PCR检测方法,为这两个病原的检测提供了快速、准确的方法。
1 材料
1.1 菌株和样品 Mhp、Mhr、絮状支原体(Mf)、鸡毒支原体(Mg)、副猪嗜血杆菌(HPs)、胸膜肺炎放线杆菌(App)、猪链球菌2型(SS-2)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV2)和蓝耳病病毒(PRRSV)为江苏省农业科学院兽医研究所保存。69批次猪支原体肺炎活疫苗(168株)由南京天邦生物科技有限公司生产。120份MPS临床肺组织于2011年采集自南京某屠宰场。5份细胞样品来源于江苏省农业科学院兽医研究所。
1.2 试剂 PCR引物由上海捷瑞生物工程有限公司合成。PCR试剂购自TaKaRa公司。
2 方法
2.1 模板制备 按照参考文献的采样方法采样,采集待检猪肺脏的病变组织与健康组织交界部位,研磨、反复冻融、煮沸提取 DNA,作为模板,置于-20 ℃ 保存[8]。
2.2 引物设计 根据GenBank Mhp 16S rRNA基因(Y00149.1)和 Mhr 16S rRNA 基因(M24658.1)的序列设计引物,引物序列为:
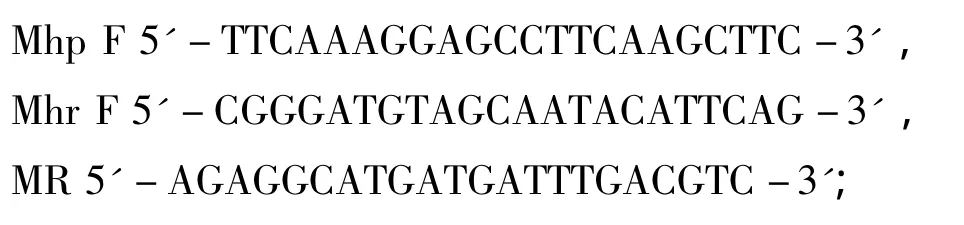
以上引物均由上海捷瑞生物工程有限公司合成。
2.3 双重PCR方法的建立 PCR扩增体系为:10 × PCR Buffer(Mg2+Free)2 μL,25mmol/L MgCl21 μL,各 2.5 mmol/L dNTPs Mixture 2 μL,20 pmol/μL Mhp 引物 0.5 μL,20 pmol/μL Mhr引物0.5μL,20 pmol/μL MR 引物1 μL,模板 DNA 2 μL,5 U/μLTaq 酶 1 μL,加 ddH2O 至20 μL。反应条件为:95℃预变性5 min,94℃变性30 s,54℃退火1 min,72℃延伸1 min,30个循环,72℃终延伸10 min。取10 μL PCR扩增产物,用1%的琼脂糖凝胶在120 V电压下电泳鉴定。若出现1000 bp条带的样品,判为Mhp阳性;若出现1129 bp条带的样品,判为Mhr阳性。
2.4 PCR 的特异性试验 取 Mhp、Mhr、Mf、Mg、HPs、App、SS-2、CSFV、PCV2 和 PRRSV,获得基因组DNA或cDNA,同上体系进行PCR反应,来确定PCR的特异性。
2.5 PCR扩增的敏感性试验 Mhp和Mhr模板用紫外分光光度计测得浓度分别为3.3 μg/mL和2.9 μg/mL,然后进行一系列10倍梯度稀释到10-5,然后按照同上的PCR扩增体系和条件进行PCR,以检测此方法的敏感性。
2.6 样品检测 使用上述建立的双重PCR法对猪场采集肺组织120份、69批次猪支原体肺炎活疫苗(168株)和5份疑似支原体污染细胞进行检测。
3 结果与分析
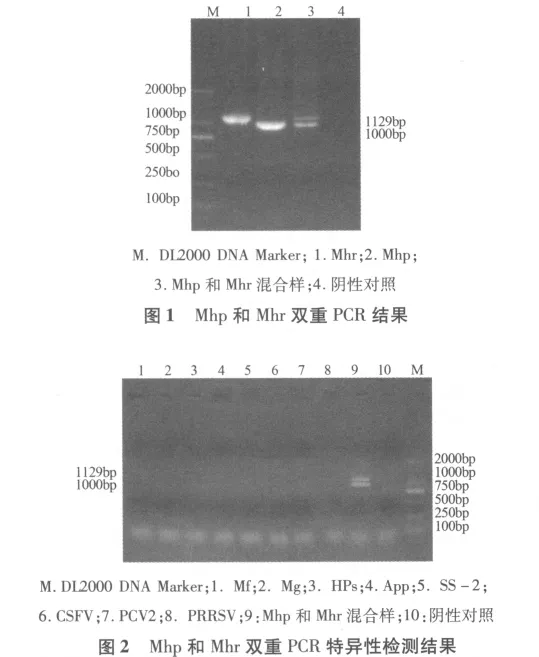
3.1 PCR扩增结果 用Mhp和Mhr阳性样品作为模板进行PCR扩增,琼脂糖凝胶电泳结果表明,PCR成功地扩增出1000bp(Mhp)和1129bp(Mhr)大小的条带(图1),与预期结果相符。
3.2 PCR 特异性实验结果 以 Mhp、Mhr、Mf、Mg、HPs、App、SS-2、CSFV、PCV2 和 PRRSV 的基因组DNA或cDNA为模板,利用已经建立的双重PCR进行检测。琼脂糖凝胶电泳结果如图2,Mhp和Mhr均扩增出目的条带,Mf、Mg、HPs、App、SS-2、CSFV、PCV2和PRRSV均未出现相应条带。
3.3 双重PCR的敏感性试验结果 将Mhp DNA模板(浓度为3.3 μg/mL)和 Mhr DNA 模板(浓度为2.9 μg/mL)进行一系列10倍梯度稀释,按照同上的PCR扩增体系和条件进行PCR,琼脂糖凝胶电泳结果如图3,显示Mhp和Mhr最低可从10-4倍稀释的模板中扩增到目的条带,说明该双重PCR的最低检出量 Mhp 为0.66 ng,Mhr为 0.58 ng。
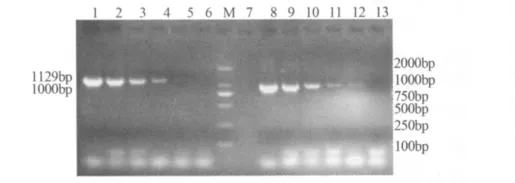
图3 Mhp和Mhr的敏感性试验结果
3.4 样品的双重PCR检测结果 利用Mhp和Mhr双重PCR法检测120份临床猪肺可疑样品、69批次猪支原体肺炎活疫苗(168株)和5份疑似支原体污染细胞。结果显示,临床样品中,28份是Mhp 阳性(23.3%),17 份是 Mhr阳性(14.1%);69批次猪支原体肺炎活疫苗(168株)全部为Mhp阳性,无Mhr污染;5份疑似支原体污染细胞全部为Mhr阳性。以上试验结果均与建立的 Mhp P36 PCR和Mhr P37 PCR[7-9]方法检测结果一致。部分琼脂糖凝胶电泳结果如图4。

图4 样品的双重PCR检测结果
4 讨论
近年来,猪病的发生多以混合感染出现,这在疾病的诊断上带来了困难。Mhp的感染常常是引起猪呼吸道病综合征发生的重要条件。在Mhp感染猪时,常伴有Mhr的感染,而Mhr感染猪的临床表现与HPs极其相似,且目前HPs发病率较高,易导致误判。目前的检测方法主要有分离培养、PCR、血清学等。由于Mhp较Mhr培养条件苛刻,在分离培养Mhp时常被Mhr所掩盖,给分离培养带来困难和错误。在血清学上Mhp与Mhr具有一定的交叉性,因此,血清学方法具有一定的假阳性。本研究利用16S rRNA在细菌种间的保守性,设计了3条针对Mhp和Mhr 16S rRNA基因的特异性引物,可特异性的扩增到Mhp和Mhr,这将为Mhp和Mhr的可疑病料以及Mhp和Mhr污染样本的检测提供了快速简便准确的方法。
本研究建立的Mhp和Mhr双重PCR法,经特异性试验证明,能特异性的检测出Mhp和Mhr,而与供试的其他病原均不反应。敏感性试验证明,该方法最低可以检测到0.66 ng的Mhp基因组DNA和0.58 ng的Mhr基因组DNA;目前报道了P36的敏感性为0.426 ng Mhp基因组 DNA,P46为0.5 ng Mhp基因组DNA,该方法与先前的报道相近[8-9]。因此,集高特异性和高敏感性于一体的Mhp和Mhr双重PCR法将在其检测和鉴别中发挥重要的作用。
猪支原体肺炎在大多数猪场长期存在,Mhp和Mhr是其主要病原。王贵平报道长沙市中小猪场和散养户病料中Mhp阳性率为 24.4%,Mhr阳性率为22.3%;Lin J H 等报道等[10]台湾 Mhp和 Mhr的感染率分别为15.9%和19.0%。本次试验从采集的屠宰场样品中检出Mhp阳性率23.3%,Mhr阳性率14.1%,这可能是采样时间、范围及对象的差异所致。这也说明Mhp和Mhr在猪群中也有感染,其对养猪业的危害值得进行调查。
Mhr由于其可感染动物和人,且培养要求较低,所以成为了支原体和细胞培养的头号敌人。据报道污染细胞的支原体主要来源于人、猪和牛,对495株细胞的检测,发现最常见的包括:发酵支原体(47%)、猪鼻支原体(19%)、口腔支原体(10%)、精氨酸直言体(9%)莱氏无胆甾原体(6%)、人型支原体(3%)[6]。本试验中从南京天邦生物科技有限公司生产的15批次猪支原体肺炎活疫苗(168株)中均检测到了Mhp,而未检测到Mhr,说明疫苗在污染控制上严格。试验中检测的疑似支原体污染细胞均检测到了Mhr,这也验证了Mhr在细胞培养污染中的较为常见。
本试验中设计的双重PCR了3条引物特异性良好,敏感度与普通PCR接近,是一个较为简便快速的Mhp和Mhr检测和鉴定的方法。但本试验中Mhp和Mhr扩增产物在1000 bp以上,使PCR的延伸时间较短片段长,另两个目标片段大小相差129 bp,给两者的鉴别带来了一些困难。通过条件优化,2 h内即可完成检测,与常规PCR基本相当,目前也正在进行改进研究。
总之,采用双重PCR法检测可疑MPS病料,以及疫苗和细胞是否感染Mhp或者Mhr,是一种快速准确的检测诊断方法,对Mhp和Mhr的检测具有一定的应用价值。
[1]Elieen L T.Mycoplasmal Diseases[M]//.赵德明,张仲秋,沈建忠译.猪病学第9版.北京:中国农业大学出版社,2008:795-802.
[2]Maes D,Segales J,Meyns T,et al.Control of Mycoplasma hyopneumoniae infections in pigs[J].Veterinary Microbiology,2008,126(4):297-309.
[3]沈青春,宁宜宝,覃青松.猪肺炎支原体的研究进展[J].中国兽药杂志,2003,37(6):26-30.
[4]Lin J H,Chen S P,Yeh K S,et al.Mycoplasma hyorhinis in Taiwan:Diagnosis and isolation of swine pneumonia pathogen.[J].Veterinary Microbiology,2006,115(1-3):111-116.
[5]Hans G Drexler and Cord C Uphoff.Mycoplasma contamination of cell cultures:Incidence,sources,effects,detection,elimination,prevention[J].Cytotechnology,2002,39(2):75-90.
[6] 吴移谋,叶元康.支原体学[M].第2版.北京:人民卫生出版社,2008:95-100.
[7]Freeman M J,Armstrong C H,Sands- Freeman L L,et al.Serological cross-reactivity of porcine reference antisera to Mycoplasma hyopneumoniae,M.flocculare,M.hyorhinis and M.hyosynoviae indicated by the enzyme-linked immunosorbent assay,complement fixation and indirect hemagglutination tests[J].Canadian Journal of Comparative Medicine,1984,48(2):202-207.
[8]Caron J,Ouardani M,Dea S.Diagnosis and differentiation of Mycoplasma hyopneumoniae and Mycoplasma hyorhinis infections in pigs by PCR amplification of the p36 and p46 genes[J].Journal of Clinical Microbiology,2000,38(4):1390 ~1396.
[9]刘茂军,张 映,邵国青,等.猪支原体肺炎可疑肺组织PCR检测方法的建立[J].山西农业大学学报(自然科学版),2009,29(5):444-447.
[10]王贵平,戴 玮,贾小雅,等.用PCR检测长沙市猪肺炎支原体和猪鼻支原体的感染情况[J].养猪,2011,(3):81-82.
