三种布鲁氏菌病疫苗株的毒力比较
2012-11-14程君生吴梅花赵丽霞彭小兵丁家波夏业才毛开荣
程君生,吴梅花,赵丽霞,彭小兵,丁家波,王 楠,夏业才,毛开荣
(1.中国兽医药品监察所,北京 100081;2.金宇保灵生物药品有限公司,呼和浩特 010030)
布鲁氏菌病(简称布病)是一种世界范围流行的人畜共患病,严重威胁人类和多种动物的生命健康,造成巨大的经济损失。布病导致动物流产、不孕和奶产量减少等,同时也引起严重的公共卫生安全问题[1-2]。绝大多数布鲁氏菌菌株都可以感染人,并引起严重的疾病,需要长时间的抗生素治疗,而且往往会留下严重的后遗症[3]。截至2007年的十五年中,布病疫情呈持续增长态势,愈演愈烈[4]。根据卫生部网站上的疫情公告,从2009年至2011年,我国人间布病新发病人数均超过3万人,处于历史最高水平。
疫苗免疫是防控家畜布病的主要措施。我国现有兽用布病疫苗制苗菌株有3种,分别为羊种布鲁氏菌M5或M5-90弱毒株、猪种布鲁氏菌S2弱毒株和牛种布鲁氏菌A19弱毒株[4]。20世纪70-90年代,以上3种疫苗对我国布病疫情的控制起了至关重要的作用。至今,这3种疫苗仍在我国被广泛使用。布鲁氏菌病属不同种型的菌株在外界各种因素的影响下可以发生变异,特别是在实验室里,由于长期菌株保存的不当而发生变异的现象更为常见[5]。作为一种重要的人畜共患细菌病活疫苗,菌株的遗传稳定性是确保疫苗质量的前提。毒力测定是监测菌株是否变异的方法之一,也是确保疫苗安全的重要保证。国际上通常有3种方法反映布鲁氏菌的毒力:对豚鼠的最小感染量、感染豚鼠的脾脏含菌量以及感染小鼠体内的存活时间,其中对豚鼠的最小感染量通常用于对强毒株布鲁氏菌毒力的测定。为了系统比较以上3种疫苗株的毒力,本研究用小鼠体内存活时间和豚鼠脾含菌量2种方法,对上述3种布病疫苗株的毒力进行了测定和分析。
1 材料与方法
1.1 菌株及试剂 牛种布病疫苗(A19株)、猪种布病疫苗(S2株)均来自国家兽医微生物菌种保藏中心;羊种布病疫苗(M5株)来自国内某兽用生物制品生产企业。胰眎琼脂培养基、蛋白胨水、PBS、生理盐水等由中国兽医药品监察所基础保障处参照《中国兽用生物制品规程》二○○○年版制备。PCR反应试剂盒(Lot:DR001B)、DNA Marker DL2000(Lot:D501A)均购自TAKARA公司。
1.2 实验动物 雌性 Balb/c小鼠(SPF级)和Hartley豚鼠(SPF级)均购自北京维通利华实验动物技术有限公司。
1.3 菌液制备与浓度测定 分别将各冻干布病疫苗菌株用生理盐水溶解后,划线接种于胰眎琼脂培养基,置37℃培养48 h,用生理盐水冲洗培养物制成悬液,立即置于冰水中。充分混匀后,取0.1 mL菌液在96孔酶标板上用生理盐水作2倍梯度稀释至第11孔,用分光光度计测定OD600值。将原始菌液稀释至OD600=0.1后,再用生理盐水作连续10倍梯度稀释至10-6,取该稀释管接种胰眎琼脂平皿,每皿接种0.1 mL,每个样品接种3块平皿。将计数的平皿置于37℃温箱培养72 h,根据菌落计数结果计算菌液浓度。
1.4 疫苗株在小鼠体内的存留时间测定 将16~18 g的健康雌性BALB/c小鼠120只,随机分为3组,分别腹股沟皮下接种疫苗株A19、M5、S2,每组40只,注射剂量均为1×105CFU/只。接种后每隔2周扑杀5只小鼠,取出脾脏,加入1 mL无菌生理盐水后,用小型组织匀浆机(IKA)将其捣碎。分别取匀浆按原液0.1 mL涂布胰眎琼脂平板,置于37℃温箱培养72 h,观察细菌生长情况。参照已发表的文献[6-7],设计表1所示的各引物,用于对分离菌进行特异性鉴定。
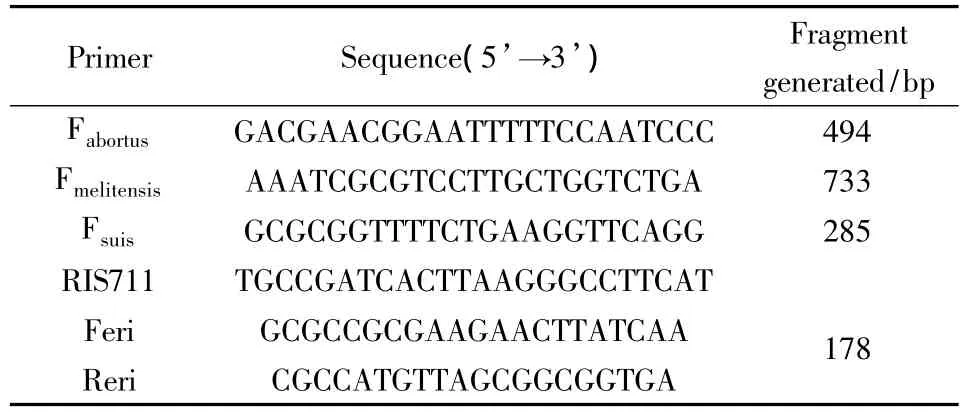
表1 用于区分布鲁氏菌种属的PCR引物序列
1.5 疫苗株对豚鼠的毒力 参照《中华人民共和国兽医生物制品规程》二〇〇〇年版对布病疫苗菌种毒力的测定方法[8],取350~400 g的健康雌性豚鼠15只,随机分为3组,每组5只,分别腹股沟皮下接种疫苗株 A19、M5、S2,注射剂量均为1×109CFU/只。接种后15 d扑杀各组豚鼠,无菌采集脾脏混合称重。根据称重结果,分别加入等量灭菌生理盐水,用小型组织捣碎机将各组样品捣碎,制成悬液。吸取0.1 mL,用生理盐水10倍梯度连续稀释,分别取1∶10和1∶100稀释液涂布胰眎琼脂平板,置于37℃温箱培养72 h,选择合适的稀释度计算每克脾脏细菌含量。
2 结果
2.1 菌液制备与浓度测定 各疫苗株在胰眎琼脂培养基上均能良好生长。按1.3中描述的方法,计算OD600=0.1时三种布鲁氏菌的浓度。结果在此浊度下,A19、M5 和 S2的浓度均约为2.5 ×109CFU/mL。
2.2 各疫苗株在小鼠体内的存留时间 疫苗免疫后实验小鼠脾脏内分离细菌生长情况见表2。
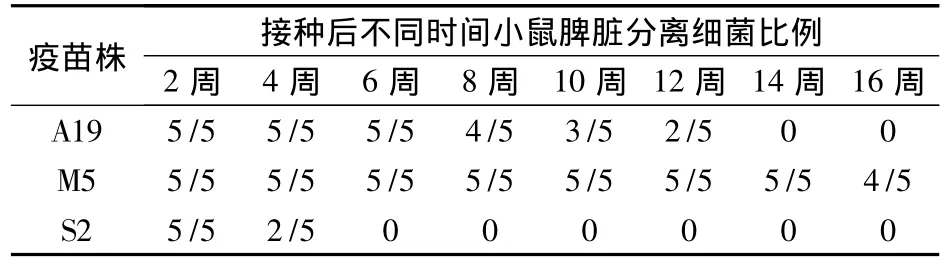
表2 各布鲁氏菌疫苗株在小鼠体内不同时间分离细菌情况
从平板上随机挑取3个菌落,用AMOS-PCR方法对分离菌进行特异性鉴定。PCR电泳结果显示,从小鼠脾脏中分离的各细菌均与免疫株一致,即牛种布鲁氏菌S19株出现大小为178 bp和494 bp的特异性条带,羊种布鲁氏菌M5株出现大小为178 bp和733 bp的特异性条带,猪种布鲁氏菌S2株出现大小为178 bp和285 bp的特异性条带(图1)。
2.3 各疫苗株对豚鼠的毒力 疫苗免疫后15 d,取豚鼠脾脏计数克脾脏含菌量,结果见表3。A19疫苗株感染的豚鼠克脾脏含菌量最高为17万,S2最高为1.5万,均不超过20万,符合我国《兽用生物制品规程》中对布病疫苗种毒的毒力规定[7]。M5疫苗株感染的豚鼠克脾脏含菌量最低为67万,高于规定标准。
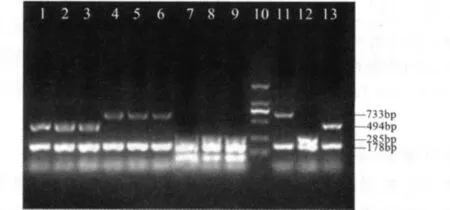
图1 小鼠脾脏分离菌的PCR种属鉴定结果

表3 不同疫苗株免疫的豚鼠脾脏含菌量测定结果
3 讨论
布鲁氏菌是一种细胞内寄生菌,其感染动物后,会激发机体的体液免疫和细胞免疫反应,其中细胞免疫对抗感染起着主要作用。由于活疫苗可以激起有效的细胞免疫,产生良好的保护效果,因此迄今为止,绝大多数成功应用的疫苗都是弱毒疫苗。我国目前使用的A19、M5和S2疫苗株,均为光滑型弱毒疫苗。不同布病疫苗株其毒力也各不相同,其毒力的大小决定了该疫苗的安全性。
豚鼠对布鲁氏菌具有高度的敏感性,是研究布病的良好试验模型,常用于分离布鲁氏菌,测定布鲁氏菌毒力,检定布病疫苗的效力等[9]。《兽用生物制品规程》中对布病疫苗种毒的毒力规定,以10亿剂量的活菌免疫豚鼠14~15 d后,每组(5只/组)豚鼠的克脾脏含菌量应不超过20万个[8]。本研究结果显示,M5毒力最强,A19次之,S2最弱。
小鼠体内持续期也是常用作评价布病疫苗株安全性的重要指标之一,其对布鲁氏菌的敏感性仅次于豚鼠。一般来说,强毒布氏菌具有在体内持续感染的特征,体内持续感染的时间越长,对机体的损伤会越大。对于弱毒菌株,体内感染时间的增加,有提高免疫保护力的有利作用,但也增加了毒力变强的可能性。本研究中A19和S2疫苗株在小鼠体内的持续时间分别为14周和6周,而M5却超过了16周,同样证明了M5疫苗的毒力超过了其他2个疫苗株。
相对于其他种的光滑型布鲁氏菌疫苗株,羊种布鲁氏菌疫苗株的稳定性相对较差。有报道称,国际上较早使用的羊种布病疫苗株Rev.1在适当的条件下毒力可以完全恢复[10-11]。因此,对这类疫苗菌株的繁殖制备需要严格控制。我们的试验研究显示,M5疫苗在小鼠体内存活时间较长,在豚鼠体内含菌量较高,是否与疫苗菌株在制备繁殖中控制不当或在一定条件下有毒力返强有关,需进一步证实。
为保证疫苗使用的安全性和有效性,有必要对布鲁氏菌病疫苗菌株的遗传稳定性,特别是对毒力和免疫原性的稳定等进行进一步评价,更深入地了解各个疫苗菌株的特性,有效控制其毒力稳定性和免疫原性,为家畜布鲁氏菌病免疫预防提供更可靠的保障。
[1]Paranavitana C,Zelazow S E,Izad-Joo M,et al.Interferongamma associated cytokines and chemokines produced by spleen cells from Brucella-immune mice[J].Cytokine,2005,30:86-92.
[2]Hamdy M E,El-Gibaly S M,Montasser A M.Comparison between immune responses and resistance induced in BALB/c mice vaccinated with RB51 and Rev1 vaccines and challenged with Brucella melitensis bv.3[J].Vet Microbiol,2002,88:85-94.
[3]Moriyon I,Grillo M J,Monreal D,et al.Rough vaccines in animal brucellosis:Structural and genetic basis and present status[J].Vet Res,2004,35:1-38.
[4]崔步云.中国布鲁氏菌病疫情监测与控制[J].疫病监测,2007,22(10):649-651.
[5] 刘秉阳.布鲁氏菌病学[M].第1版.北京:人民卫生出版社,1989:36.
[6]丁家波,张存帅,彭小兵,等.布鲁氏菌种属鉴定多重PCR方法的建立及初步应用[J].中国兽医学报,2009,29(5):594-597.
[7]彭小兵,程君生,夏业才,等.多重PCR方法鉴别牛、羊、猪种布鲁氏菌株[J].中国兽药杂志,2010,44(2):12-14.
[8]中华人民共和国兽用生物制品规程[M].二○○○年版.北京:化学工业出版社.154-160.
[9]Davis D S,Elzer P H.Brucella vaccines in wildlife[J].Vet Microbiol,2002,90(11):533-544.
[10]Bosseray N.Brucella melitensis Rev.1 living attenuated vaccine:Stability of markers,residual virulence and immunogenicity in mice[J].Biologicals,1991,19:355-363.
[11] Grilló M J,Bosseray N,Blasco J M,et al.In vitro markers and biological activity in mice of seed lot strains and ommercial Brucella melitensis Rev.1 and Brucella abortus B19 vaccines[J].Biologicals,2000,28:119-127.
