发酵藕带中优良乳酸菌的筛选及生理性能研究
2012-11-12舒丽平王清章严守雷李洁
舒丽平,王清章,严守雷,李洁
(华中农业大学食品科技学院,武汉,430070)
藕带(Lotus sprout),学名莲鞭,又叫藕鞭、藕梁、藕桩子等,是荷的地下茎,横生于泥中,并不断分枝蔓延。藕带一般是在野生莲藕或子莲出芽后抽取,以防止地下部分过密(类似疏叶)而影响上部生长从而影响莲籽产量。藕带是生长在淤泥中的天然绿色蔬菜,也是春夏餐桌上的美味佳肴。新鲜藕带脆性较好、风味佳、营养丰富,但在贮藏中极易褐变和变软,产品外观、营养价值和风味品质变差[1]。
泡菜是一种传统的乳酸发酵蔬菜制品,可作为保健食品出售,经常食用可调节肠道微生态平衡、降低胆固醇、提高机体免疫力。蔬菜泡制又是一种古老的冷加工及保藏方法,对蔬菜的营养成分、色、香、味、体的保持都极为有利。
发酵蔬菜的主要菌群——乳酸菌一直是人们研究的热点。乳酸菌的发酵性能对缩短发酵时间、降低亚硝酸盐含量、提高泡菜品质和延长泡菜食用期等方面都有重要影响。一般接种发酵所使用的乳酸菌菌种都是从优良的泡菜发酵体系中分离得到的,因为将常用的酸奶等产品的专用菌接种于泡菜,可能存在适应性差,生长繁殖困难,生产出的产品无发酵泡菜独有的味道等问题。选择适宜的菌种作发酵剂是得到优良发酵制品的先决条件。因此,根据自身特点研究特定条件下菌种的发酵速度、产酸量、对不同发酵环境的适应能力以及评价其最终的口感与风味对优良菌种的筛选以及确保纯接种快速发酵技术的成功至关重要。
本试验主要从自然泡制藕带中分离筛选出发酵产酸快、降解亚硝酸盐能力强、风味好的乳酸菌,并对其进行鉴定和其发酵性能进行研究。
1 材料与方法
1.1 材料与试剂
①试验材料 泡菜原料(藕带)、泡菜坛、食盐,均市购。
②主要试剂和仪器设备 MRS肉汤培养基;多价蛋白胨-酵母膏(PY)培养基;氯化钠;琼脂;无水乙醇;无水氯化钙;冰醋酸;盐酸;亚硝酸钠;对氨基苯磺酸;盐酸萘乙二胺;氢氧化钠;氢氧化钾;葡萄糖;D-果糖;蔗糖;麦芽糖;乳糖等。
DSX-280型不锈钢手提式灭菌器;SW-CJ-1FD型超净工作台;DNP-9272型电热恒温培养箱;722可见分光光度计;Leica DME显微镜;Panasonic彩色闭路监控摄像机等。
1.2 试验方法
①乳酸菌的分离、纯化和初步鉴定筛选 藕带发酵工艺流程如下∶藕带→清洗、切分护色[2]→漂洗沥干→5%食盐水入坛泡制→水封、自然发酵。每隔2~3 d用无菌吸管和消毒器具在无菌操作下取样,测定泡菜汁的pH值、藕带的总酸和亚硝酸盐含量。当酸度达到 0.40%~0.80%或 pH 值 3.20~3.60 时,判断其发酵成熟[3]。总酸含量按 GB/T 12456-90测定;亚硝酸盐含量按 GB/T 5009.33-2010测定。
在无菌操作下,对成熟泡菜汁进行梯度稀释,选取适宜的稀释度,用混合法倒平板,于自制厌氧装置中,30℃恒温培养2 d后,选一定稀释度的可计数平板,挑取可疑典型特征菌落,进行2~3次划线纯化至单菌落,单菌落经革兰氏染色镜检、过氧化氢酶反应,筛选出G+,过氧化氢酶试验阴性的菌株;进一步进行产乳酸定性测定,将乳酸纸层析阳性菌株接种MRS 斜面,4℃下保存备用[3,4]。
乳酸菌检验按 GB/T 4789.35-2008操作;产乳酸定性试验采用乳酸纸层析法[5~8];测 Rf(比移值)∶将待测菌株的Rf值与标准乳酸的Rf值进行比较,Rf=原点到层析点中心的距离/原点到溶剂前沿的距离。
②乳酸菌的筛选[6,9]分别以产酸速度、亚硝酸盐降解率、发酵藕带风味为指标对分离的乳酸菌菌株进行筛选。a.产酸速度。取经活化的菌液以1%的接种量接种于10 mL MRS液体培养基中,30℃培养48 h,每隔12 h测定1次pH 值。
b.亚硝酸盐降解率。以无菌水代替NaNO2溶液为空白,将产酸速度快的活化菌液以1%的接种量接种到装有1 mL 1 000 μg/mL NaNO2溶液和 9 mL液体培养基的试管中,另以1 mL NaNO2溶液和9 mL液体培养基的试管为对照,30℃培养72 h。过滤菌体,测定培养基中残存的亚硝酸盐含量。
c.接种发酵藕带风味试验。接种发酵工艺路线为∶

然后对成熟泡菜进行感官评分[9,10],感官品尝小组由3~6人组成。
③筛选菌株的鉴定 a.形态学鉴定。观察筛选菌株在平板上的菌落特征形态;对菌株进行涂片革兰氏染色,油镜下观察菌体形态。
b.生化特征鉴定。对筛选的优良菌株分别进行16种碳水化合物发酵产酸、过氧化氢酶、硝酸盐还原、淀粉水解、明胶液化、V-P试验、硫化氢产生、氨基酸脱羧及精氨酸产氨等试验[11,12,15~18]。
④菌株生理性能研究[6,9,13]a.生长曲线的测定。将活化后的菌液按10%的比例分别接种到12支MRS液体试管中,30℃培养,每隔2 h取出一支,在600 nm处测定培养液的吸光值(OD值),以相同条件下的空白培养基为对照。
b.菌株最适生长pH值测定。用乳酸或乳酸钠将MRS液体培养基调至pH 值 1.6、3.0、4.0、5.0、6.0、7.0、9.0的不同pH值梯度系列,将培养到对数生长期的菌液以1%的接种量接种于其中,30℃培养48 h后测定其吸光值,以相同条件下的空白培养基作对照。
c.菌株盐浓度适应性试验。用NaCl将MRS液体培养基调至0%、2%、4%、6%、8%、10%的不同盐浓度梯度系列,把培养到对数生长期的菌液以1%的接种量接种于其中,30℃培养48 h后测定其吸光值,以相同条件下的空白培养基作对照。
d.菌株最适生长温度测定。把培养到对数生长期的菌液以1%的接种量接入MRS液体管中,分别在4、15、20、30、37、45℃培养,以同温下不接种的空白培养基作对照,48 h后测定其吸光值。
2 结果与分析
2.1 乳酸菌的分离、纯化和初步鉴定筛选
从成熟泡菜汁中初步分离纯化得到22株具有可疑典型特征菌落的菌株。单菌落经革兰氏染色镜检、接触酶反应,筛选出9株均为G+,接触酶阴性的菌株,编号为 L1~L9。
在层析滤纸上,底版呈蓝色而有机酸呈黄色斑点。被测9株菌株斑点的Rf值与标准乳酸斑点的Rf值比较,相对误差都小于 1%(表1),可判断为乳酸[5,8]。
2.2 乳酸菌的筛选
通过发酵产酸和降解亚硝酸盐试验以及发酵藕带感官评定,依次对L1~L9进行筛选。
①发酵产酸速度 根据9株菌株产酸结果,筛选出 L1、L2、L3、L5、L6、L8、L9共 7 株产酸速度较快的菌株,在36~48 h内,使培养液的pH值均降到3.60以下,适合纯种发酵泡菜,发酵前期(24 h)产酸较快,后期由于高酸的抑制作用发酵速度减慢[14]。L4和L7产酸较慢,48 h后pH值均大于3.60。
②降解亚硝酸盐能力 从7株产酸速度较快的乳酸菌菌株中得到5株亚硝酸盐降解能力较强的菌 株 L1、L3、L6、L8、L9,其亚硝酸盐降解率分别为73.73% 、89.65% 、97.40% 、91.78% 、79.69%,其余两株菌对亚硝酸盐降解能力较小。

表1 乳酸定性试验结果(发酵液的Rf值)
③接种发酵藕带感官评价 将5株亚硝酸盐降解能力强的菌株对接种藕带发酵,筛选出发酵风味好的优良菌株。
本试验中泡菜制作过程未添加任何佐料,风味来源仅为原料本身具有和发酵剂作用产生。对成熟泡菜进行感官评分见表2,最终筛选出L3和L6两株优良菌株。这两菌株纯种发酵藕带时,接近自然发酵的总体口味。
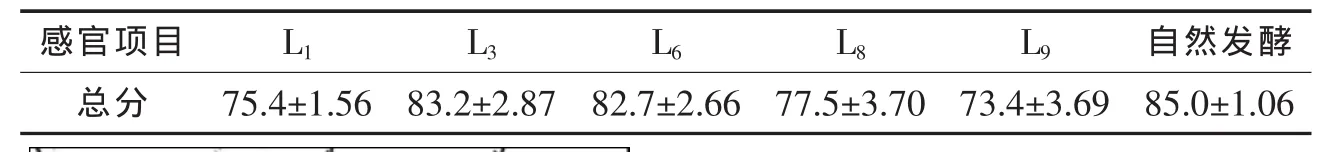
表2 藕带泡菜感官评定结果(平均值±标准偏差)

图1 L3(左)和 L6(右)菌株的光学显微镜观察(×1 000)
2.3 筛选菌株的鉴定
筛选出的L3和L6菌株经形态特征鉴定(图1),可初步确定为乳酸菌。对L3和L6进行碳水化合物发酵试验(表3)和生化试验(表4),并对照《伯杰氏细菌鉴定手册》,判定L3为植物乳杆菌(Lactobacillus plantarum简写为 LP),L6为短乳杆菌(Lactobacillus brevis简写为Lb),均来自成熟藕带泡菜汁,是发酵中后期的主导菌。

表3 两株菌株的碳水化合物发酵试验结果
2.4 菌株生理性能研究
①菌株的生长曲线 由图2可以看出,两株菌的生长周期较短,起始生长速度快,培养4 h后就进入对数生长期,12~16 h后即进入稳定期,以后生长趋于平缓。
②菌株生长的最适pH值 由图3可以看出,菌株生长的最适pH值均为 5.0~6.0。相对来说,短乳杆菌有较强的耐酸性,在pH值3.0的环境中仍可生长良好,而植物乳杆菌生长很慢,两株菌株对碱的耐受能力都较差,短乳杆菌在 pH值大于8.0时生长受到抑制,而植物乳杆菌耐碱能力较强,pH值大于9.0仍能一定程度存活。
③菌株的耐盐性 图4显示,两菌株对盐均有较好的耐受能力,在含盐量6%时仍能正常生长。随着盐浓度的升高,生长受到抑制,且植物乳杆菌较短乳杆菌耐盐能力强,能在8%的盐浓度中生长,而后者生长缓慢,但盐浓度大于10%以后,两株菌均基本不生长。

表4 两株菌株的生化试验结果

图2 菌株的生长曲线
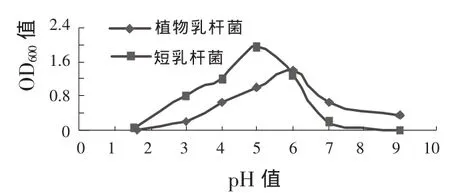
图3 不同pH值下菌株的生长情况

图4 盐浓度对菌株生长的影响

图5 不同培养温度下菌株的生长情况
④菌株生长的最适温度 由图5可知,两菌株的生长温度范围(20~37℃)较宽,且生长良好,最适生长温度均为30℃左右,它们在15℃时也能缓慢生长。
3 结论
①从自然泡制藕带水中分离筛选出两株发酵藕带产酸能力强、亚硝酸盐含量低、风味好的乳酸菌菌株,生理生化鉴定为植物乳杆菌(Lactobacillus plan-tarum)和短乳杆菌(Lactobacillus brevis)。
②两株菌株最适生长 pH 值范围均在 5.0~6.0,短乳杆菌在pH值3.0时生长良好,pH值大于8.0时生长受到抑制,植物乳杆菌在pH值3.0时生长很慢,而pH值大于9.0时仍能一定程度存活;在盐浓度低于6%时两菌株均能正常生长,10%含盐量抑制其生长,植物乳杆菌能耐8%的盐浓度;两株菌株生长温度范围较宽(20~37℃),最适生长温度均为 30℃,在15℃时也能缓慢生长。在MRS液体培养基中,两株菌株对初始浓度为100 μg/mL的亚硝酸盐的降解率分别为 89.65%和 97.40%。
[1]刘玉蝶,张长峰,高梦祥,等.藕鞭褐变与软化的控制及其机理的研究[J].食品科技,2007,32(5)∶95-98.
[2]方维明,范明红,仇立亚,等.抑制剂与硬化剂对水煮莲藕褐变及品质的影响[J].扬州大学学报∶农业与生命科学版,2007,28(4)∶90-94.
[3]杜小琴.泡菜软化控制措施研究[D].成都∶西华大学,2008.
[4]赵斌,何绍江.微生物学实验[M].北京∶科学出版社,2002.
[5]李焕荣,傅力,白凤英,等.泡菜储藏期间品质变化规律的研究[J].食品科技,2004(9)∶28-30,39.
[6]吴蕊,田洪涛,孙纪录,等.泡菜中乳酸菌优良菌株的分离鉴定及发酵性能的研究 [J].食品研究与开发,2009,30(2)∶51-54.
[7]黄诚,黄群,麻成金,等.湘西传统酸豆角优势乳酸菌分离及鉴定[J].中国酿造,2009(5)∶35-38.
[8]李凤梅,王晓,张双灵,等.自然发酵酸菜汁中乳酸菌分离鉴定[J].中国酿造,2008(5)∶33-35.
[9]张冬梅,于康宁,涂强,等.泡菜纯种发酵优良乳酸菌的筛选及菌株特性研究[J].中国酿造,2008(16)∶22-26.
[10]陈功.中国泡菜的品质评定与标准探讨[J].食品工业科技,2009,30(2)∶335-338.
[11]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京∶中国轻工业出版社,1999.
[12]张刚.乳酸细菌——基础、技术和应用[M].北京∶化学工业出版社,2007.
[13]汪红,曹瑜,罗时宇,等.四川泡菜乳酸菌的分离鉴定及其特性研究[J].四川大学学报∶自然科学版,2008,45(6)∶1 509-1 512.
[14]李增利.发酵方式及起始pH值对泡菜亚硝酸盐及硝酸盐含量的影响[J].食品研究与开发,2008,29(4)∶132-135.
[15]Sánchez I,Palop L,Ballesteros C.Biochemical characterization of lactic acid bacteria isolated from spontaneous fermentation of‘Almagro’ eggplants[J].International Journal of Food Microbiology,2000,59(1/2):9-17.
[16]Urso R,Comi G,Cocolin L.Ecology of lactic acid bacteria in Italian fermented sausages:isolation,identification and molecular characterization [J].Systematic and Applied Microbiology,2006,29(8):671-680.
[17]Mohd Adnan A F,Tan I K P.Isolation of lactic acid bacteria from Malaysian foods and assessment of the isolates for industrial potential[J].Bioresource Technology,2007,98(7):1 380-1 385.
[18]Chao S H,Wu R J,Watanabe K,et al.Diversity of lactic acid bacteriain suan-tsaiand fu-tsai,traditional fermented mustard products of Taiwan[J].International Journal of Food Microbiology,2009,135(3/15):203-210.
