LW-AFC对饮食和链佐星联合诱导糖尿病大鼠的治疗作用
2012-11-12徐智宇迟晓丽周文霞张永祥
徐智宇,迟晓丽,马 渊,周文霞,张永祥
(军事医学科学院毒物药物研究所中药和神经免疫药理学研究室,北京 100850)
六味地黄汤(Liuweidihuang decoction,LW)是滋补肾阴的经典名方,由熟地、山茱萸、山药、泽泻、牡丹皮和白茯苓以 8∶4∶4∶3∶3∶3的质量比例配伍组成,主治腰膝酸软、头晕目眩、耳聋耳鸣、盗汗自汗、发热、瘦弱、小便淋秘和口渴失音等肾阴不足之证。糖尿病症状与传统医学中消渴病基本一致,患者阴津亏耗,阴损及阳,导致气阴两伤和阴阳俱虚。因此,消渴病常以主治肾阴虚的LW为基础方。现代临床医学研究也表明,LW对糖尿病有较好的疗效[1]。目前现有的LW制剂几乎都是粗制剂,缺乏可靠的质量控制方法。本课题组以免疫和内分泌活性评价为导向,从LW中分离获得了多糖、寡糖和糖苷等活性物质并按一定比例组成复方,即LW-AFC。本研究观察LW-AFC对饮食和链佐星(streptozocin,STZ)联合诱导的糖尿病模型大鼠的肥胖、糖脂代谢紊乱和胰岛素抵抗的治疗作用,以期为LW-AFC作为防治糖尿病的新药研发提供实验依据。
1 材料与方法
1.1 动物、药物、试剂和仪器
SPF级 Wistar大鼠,雄性,180~220 g,由军事医学科学院实验动物中心提供,动物合格证号:SCXK-(军)2002-001,12 h光照/12 h黑暗,室温23~25℃,相对湿度50%~70%,自由摄食和饮水。二甲双胍(metformin,Met),北京四环制药有限责任公司,国药准字H11020127;LW-AFC由本室制备,经过滤、减压浓缩和灭菌后保存于4℃备用[2],根据预实验结果,LW-AFC 0.28,0.56 和1.12 g·kg-1,临用前用蒸馏水配制成相应浓度的溶液。STZ、柠檬酸(FM=192.14)和柠檬酸钠(FM=294.10)系美国Sigma公司产品,临用前将柠檬酸和柠檬酸钠溶液混合配制成pH4.0的缓冲液,过滤除菌后与STZ配制成相应浓度的注射液;葡萄糖、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)和甘油三酯(triglycerides,TG)测定试剂盒,北京中生北控有限责任公司;胰岛素放射免疫分析试剂盒,北京北方生物技术研究所;高热量饲料,中国医学科学院动物研究所提供,由酪蛋白(25.8%)、D-L-蛋氨酸(0.4%)、麦芽糊精(16.2%)、蔗糖(8.9%)、纤维素(6.5%)、猪油(35%)、复合矿物质(1.5%)、一水合柠檬酸钾(2.1%)、磷酸钙盐(1.7%)和复合维生素(1.3%)等成分组成,每100 g饲料可提供524.3 kcal的能量。Sn-69513型免疫计数器,上海核所日环光电仪器有限公司;Napco2200型37℃恒温箱,美国Napco公司。POLARstar Galaxy多功能酶标仪,德国BMG公司。
1.2 动物分组、模型制备和给药
Wistar大鼠适应性饲养后,按体质量随机分为正常对照组(12只)和模型组(70只)。正常对照组大鼠每天饲以标准饲料,模型组每天饲以高热量饲料,饮食诱导共持续5周。随后模型组大鼠过夜禁食12 h后一次性 ip给予 STZ 30 mg·kg-1。
注射STZ 1周后模型组大鼠测定空腹血糖,血糖>16.65 mmol·L-1的大鼠(约为 85%)按血糖和体质量随机平均分为 5个组,即模型组、Met 0.2 g·kg-1、LW-AFC 0.28、0.56 和 1.12 g·kg-1,每组12只。大鼠分组后分别ig给予蒸馏水、Met或LW-AFC,每天1次,连续8周。除正常对照组饲以标准饲料外,其余各组大鼠均继续以高热量饲料喂食。给药期间每2周动态监测空腹血糖、胰岛素、TC、LDL-C和 TG水平,并计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)。HOMA-IR是反映胰岛素抵抗状态的重要指标。HOMA-IR=空腹血糖(mmol·L-1)×胰岛素(mIU·L-1)/22.5。大鼠采血前过夜禁食12 h,采血后恢复饮食。采集的血液在室温静置60 min后,1500×g 4℃离心30 min,分离血清在 -20℃低温保存,备用。给药结束后处死大鼠,称取腹腔、肾囊和睾丸处脂肪,检测内脏脂肪质量(visceral fat mass,VFM),并计算内脏脂肪系数(visceral fat coefficient,VFC),以反映腹型肥胖水平。VFC=VFM(g)/体质量 (g)×100%。
1.3 相关血清生化指标的测定
葡萄糖、TC和TG采用酶比色法检测[3],LDL-C采用清除法检测[4],胰岛素采用放射免疫分析法检测[5]。其中胰岛素采用双孔法检测,每孔100 μl血清,检测结果取算数平均值得到最终结果。
1.4 统计学方法
2 结果
2.1 LW-AFC对糖尿病大鼠肥胖的影响
表1可见,与正常对照组比较,模型组大鼠VFM和VFC均明显升高(P<0.01),呈现出腹型肥胖。与模型组比较,Met 0.2 g·kg-1,LW-AFC 0.56和1.12 g·kg-1给药8周均可显著降低VFM 和VFC(P<0.05),表明LW-AFC可改善腹型肥胖。
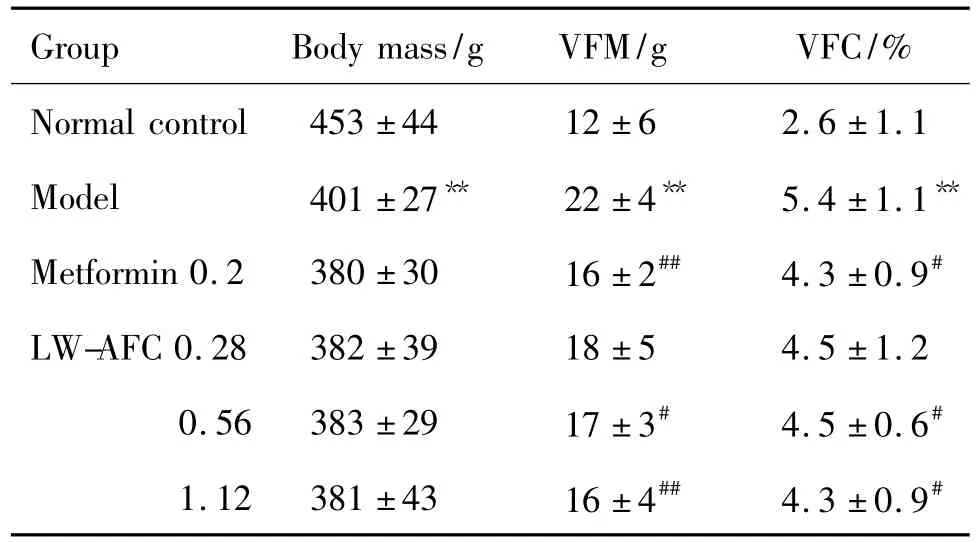
Tab.1 Effect of LW-AFC on obesity formation in diabetic model rats
2.2 LW-AFC对糖尿病大鼠糖代谢的影响
2.2.1 LW-AFC对糖尿病大鼠空腹血糖的影响
与正常对照组相比,模型组大鼠空腹血糖显著升高(P<0.01)。与模型组比较,Met 0.2 g·kg-1在8 周的给药周期内均可明显降低空腹血糖(P<0.01);LW-AFC 3个剂量给药4~8周亦可明显降低空腹血糖(P<0.05,P<0.01),改善糖代谢紊乱(表2)。
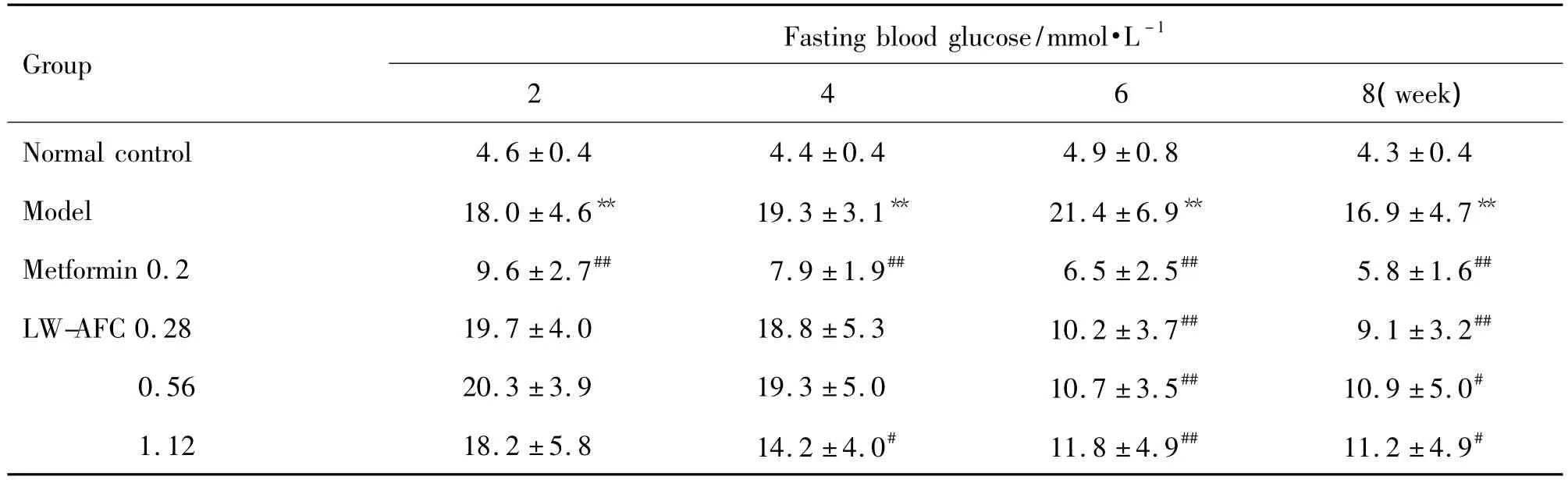
Tab.2 Effect of LW-AFC on fasting blood glucose level in diabetic model rats
2.2.2 LW-AFC对糖尿病大鼠胰岛素水平的影响
与正常对照组相比,模型组大鼠胰岛素水平在2和6周时明显升高(P<0.05),4周时则显著降低;LW-AFC在给药4和6周时与模型组比较胰岛素水平明显降低(表3)。
2.2.3 LW-AFC对糖尿病大鼠胰岛素抵抗指数的影响
与正常对照组相比,模型组大鼠HOMA-IR在2~8周明显升高(P<0.01),形成明显而稳定的胰岛素抵抗。与模型组相比,Met在给药后2~8周可明显降低HOMA-IR(P<0.01);LW-AFC 3个剂量给药4~8周亦可显著降低HOMA-IR(P<0.01),改善胰岛素抵抗状态(表4)。
2.3 LW-AFC对糖尿病大鼠脂代谢的影响
2.3.1 LW-AFC对糖尿病大鼠总胆固醇的影响
与正常对照组相比,模型组TC水平在4~8周明显升高(P<0.01),呈现出严重的脂代谢紊乱。与模型组相比,Met给药6~8周可明显降低TC水平,LW-AFC 3个剂量给药4~8周亦可明显降低TC水平(P<0.05),改善高胆固醇血症(表5)。

Tab.3 Effect of LW-AFC on fasting blood insulin level in diabetic model rats

Tab.4 Effect of LW-AFC on homeostasis model assessment of insulin resistance(HOMA-IR)of diabetic model rats
2.3.2 LW-AFC对糖尿病大鼠低密度脂蛋白胆固醇的影响
与正常对照组相比,模型组LDL-C水平在2,6和8周明显升高(P<0.05)。与模型组相比,Met给药8周,LW-AFC 3个剂量给药2~8周可持续稳定地降低LDL-C水平(P<0.05),改善脂代谢紊乱(表6)。
2.3.3 LW-AFC对糖尿病大鼠甘油三酯的影响
由表7可见,与正常对照组相比,模型组TG水平在2周明显升高(P<0.01),在4~8周无明显变化。与模型组相比,LW-AFC 0.56 和1.12 g·kg-1给药2周可显著降低TG水平(P<0.05)。
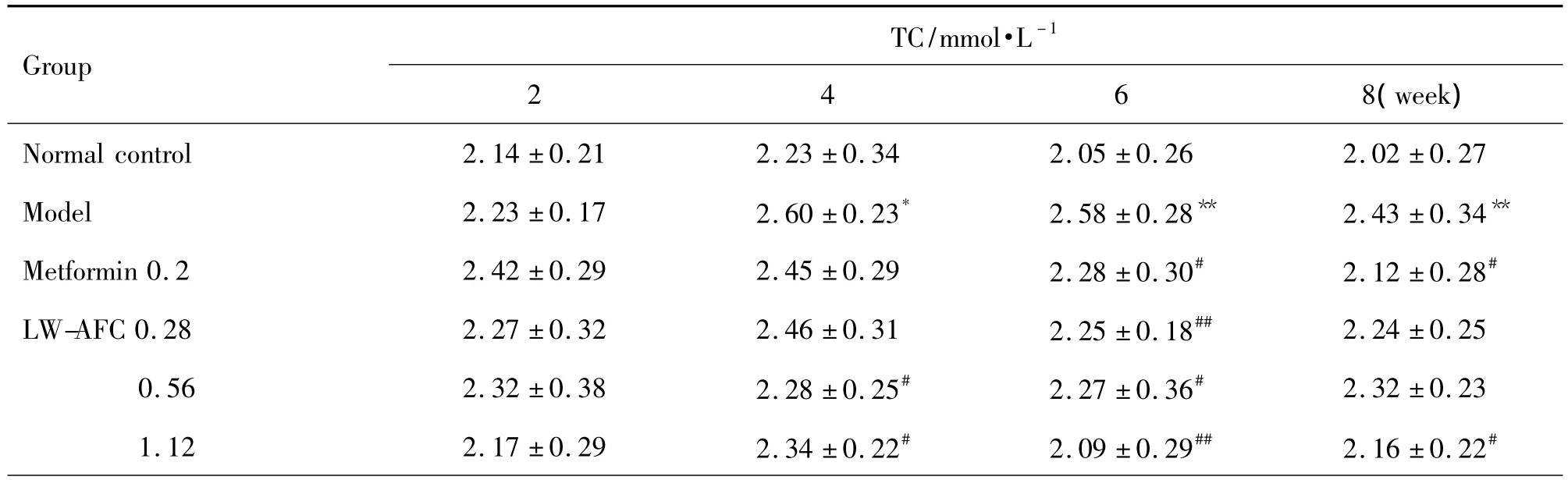
Tab.5 Effect of LW-AFC on total cholesterol(TC)level of diabetic model rats

Tab.6 Effect of LW-AFC on low density lipoprotein-cholesterol(LDL-C)of diabetic model rats

Tab.7 Effect of LW-AFC on triglycerides(TG)of diabetic model rats
3 讨论
既往研究表明,腹型肥胖患者较整体型肥胖患者其代谢障碍和心血管疾病发生率更高[6],并已成为心脑血管病变的最重要的独立危险因素之一[7]。同时,鉴于脂质异位沉积已成为诱发胰岛素抵抗重要的因素之一[8-9],内脏脂肪水平增加对内分泌系统糖脂代谢紊乱起到了越来越重要的作用。本研究发现,模型大鼠的体质量有所下降,与文献报道一致[10]。但VFM和对照组相比仍然明显增加,此外VFC亦明显升高,上述实验结果提示,模型大鼠呈现出严重的腹型肥胖。给予LW-AFC 0.56和1.12 g·kg-18周可以显著降低模型大鼠的VFM和VFC,改善腹型肥胖。这种腹型肥胖的改善可能对胰岛素抵抗的缓解和改善[11-12]、炎症反应[13]及动脉粥样硬化[14]等糖尿病并发症的防治都具有重要和积极的意义。
胰岛素抵抗和(或)胰岛β细胞分泌障碍是糖尿病的主要病理特征,而胰岛素抵抗又是2型糖尿病整个发病过程中的核心环节。本研究观察到模型组大鼠在2~8周的实验周期内表现出以稳定的高血糖和胰岛素抵抗为特征的糖代谢紊乱。给予LWAFC 4~8周可显著降低血糖并明显改善胰岛素抵抗状态,提示LW-AFC对饮食和STZ联合诱导的糖尿病大鼠高血糖和胰岛素抵抗均具有明显的改善作用。LW-AFC对胰岛素抵抗表现出明显的改善作用,提示LW-AFC可能通过促进外周组织利用葡萄糖,从而降低血糖,并增加胰岛素受体的数量和功能发挥作用,间接降低了胰岛素的需求量,使机体分泌胰岛素的水平下降,但具体作用机制有待进一步研究。
本研究观察到正常对照组大鼠胰岛素水平存在波动现象,可能与胰岛素测定方法不是非常稳定有关。本研究采用放射免疫分析法检测胰岛素,从方法学上看,采用放免法检测胰岛素比酶联免疫法灵敏度高,但受不同批次试剂盒同位素标记水平存在差异的影响,批间误差较大。在本研究中,为了随时获得实验过程中血糖和胰岛素水平,以动态了解模型指标变化和药物的效应,本研究对各周次的指标采取了采血完成后立即进行检测的方法,因此实验期间胰岛素水平波动较大。大鼠胰岛素的基础值一般在 15~56 mIU·L-1之间波动[15-17],本研究结果与文献报道基本是一致的,尚在可接受的范围内。本课题组在实验后期采用了瘦素基因缺乏的自发遗传性糖尿病小鼠——ob/ob小鼠作为模型动物对LW-AFC的药理作用进行了进一步的深入研究。ob/ob小鼠由于瘦素缺乏,进而表现出明显的高胰岛素血症和胰岛素抵抗,给予LW-AFC对ob/ob小鼠的高胰岛素血症和胰岛素抵抗均具有明显的改善作用(待发表)。
胰岛素抵抗还可以诱发以高血脂为代表的脂代谢紊乱。胰岛素抵抗导致胰岛素抑制血浆中脂肪酸的作用降低,脂肪酸浓度升高,并最终分解为LDL-C。高胰岛素血症通过兴奋交感神经,刺激α-受体使脂蛋白脂酶减少,而脂蛋白脂酶的主要作用是降低肝脏极低密度脂蛋白的分泌,增加极低密度脂蛋白的清除。因此,胰岛素抵抗进一步导致极低密度脂蛋白浓度的升高。此外,胰岛素抵抗还可以通过使LDL-C受体活性下降和高密度脂蛋白合成受阻等多条途径进一步加重脂代谢紊乱。本研究发现模型组大鼠血清TC和LDL-C水平明显升高,形成了严重的脂代谢紊乱。LW-AFC给药2~8周可不同程度地显著降低TC和LDL-C,改善糖尿病大鼠的脂代谢紊乱。本研究亦发现,模型组大鼠TG水平在注射STZ后2周显著升高,在6~8周则恢复至正常对照组水平,提示模型组未能形成稳定的高TG血症。有文献报道,TG的升高出现在造模2~3周内[18],此后可降低甚至恢复至对照组水平,其具体机制有待进一步研究。LW-AFC给药2周可以显著降低TG水平。本课题组在后期实验中也采用ob/ob小鼠观察了LW-AFC对其脂代谢的影响,实验期间各周次ob/ob小鼠的TG水平均显著升高且没有大的波动,给予LW-AFC对ob/ob小鼠的高TG血症具有明显的改善作用(待发表)。
现有研究表明,高血脂症与引起糖尿病并发症的主要因素——动脉粥样硬化的关系十分密切[19-20]。在糖尿病的临床治疗过程中,《美国胆固醇教育计划成人治疗组第三次指南(NCEP ATPⅢ)》[21],将各项血脂指标中的LDL-C作为最主要调脂靶点,其主要的理由为高胆固醇血症,特别是LDL-C增高仍为致冠心病和动脉粥样硬化最重要的血脂改变[22]。本研究发现,LW-AFC对LDL-C的改善作用非常明显,不但起效时间早,而且作用也较持久。据此初步推测,LW-AFC在改善糖脂代谢紊乱的同时对动脉粥样硬化也可能具有潜在的预防作用。
上述研究结果表明,LW-AFC可同时改善糖尿病模型大鼠的腹型肥胖、降低血糖和血脂水平,并改善胰岛素抵抗状态。其中对腹型肥胖和LDL-C的改善作用提示其可能对糖尿病并发症具有一定的预防作用。因此,LW-AFC用于防治糖尿病具有进一步研究开发的价值。
[1]Qi CH,Zhang YX,Shen BF.Advances in study on modern pharmacology of Liuwei Dihuang decoction[J].Bull Acad Mil Med Sci(军事医学科学院院刊),2002,26(1):57-61.
[2]Zhang YX,Zhao YM.Research of Modern Pharmacology and Chemistry of Liuwei Dihuang Decoction(六味地黄汤现代药理学与化学研究)[M].Beijing:Science Publishing Press,2006:209-217.
[3]Yin XM.Effects of Pyrrolidine Dithiocarbamate on islet β-cell apoptosis in type 2 diabetic rat(吡咯烷二硫代氨基甲酸盐对2型糖尿病大鼠胰岛β细胞的凋亡作用)[D].Hebei Medical University.2011.
[4]Li DQ. Clinicalevaluation of two kinds of enzymatic clearance assay for determination of low-density lipoprotein cholesterol[J].J North Sichuan Med Coll(川北医学院学报),2004,19(1):98-100.
[5]Luo XJ,Lu HK,Gao CY,Lu JX,Gu CC,Jia WP.Comparative study of serum insulin immunoassays and its clinical significance[J].Chin J Endocrinol Metab(中华内分泌代谢杂志),2009,25(6):622-625.
[6]Pi-Sunyer FX.The epidemiology of central fat distribution in relation to disease[J].Nutr Rev,2004,62(7 Pt 2):S120-S126.
[7]Pankow JS,Kwan DK,Duncan BB,Schmidt MI,Couper DJ,Golden S,et al.Cardiometabolic risk in impaired fasting glucose and impaired glucose tolerance:the Atherosclerosis Risk in Communities Study[J].Diabetes Care,2007,30(2):325-331.
[8]Lee Y,Lingvay I,Szczepaniak LS,Ravazzola M,Orci L,Unger RH.Pancreatic steatosis:harbinger of type 2 diabetes in obese rodents[J].Int J Obes(Lond),2010,34(2):396-400.
[9]Zyromski NJ,Mathur A,Gowda GA,Murphy C,Swartz-Basile DA,Wade TE,et al.Nuclear magnetic resonance spectroscopy-based metabolomics of the fatty pancreas:implicating fat in pancreatic pathology[J].Pancreatology,2009,9(4):410-419.
[10]Wang BW,Li Y,Liu XH,Liu S,Sun CH.Effect of the duration of high-fat diet and the dosage of streptozotocin on establishing experimental animal model of type 2 diabetes mellitus[J].J Hyg Res(卫生研究),2011,40(1):99-102,106.
[11]Cai D,Yuan M,Frantz DF,Melendez PA,Hansen L,Lee J,et al.Local and systemic insulin resistance resulting from hepatic activation of IKK-beta and NF-kappaB[J].Nat Med,2005,11(2):183-190.
[12]Yudkin JS,Eringa E,Stehouwer CD."Vasocrine"signalling from perivascular fat:a mechanism linking insulin resistance to vascular disease[J].Lancet,2005,365(9473):1817-1820.
[13]Shin JY,Kim SY,Jeung MJ,Eun SH,Woo CW,Yoon SY,et al.Serum adiponectin,C-reactive protein and TNF-alpha levels in obese Korean children[J].J Pediatr Endocrinol Metab,2008,21(1):23-29.
[14]Kotronen A,Yki-Järvinen H.Fatty liver:a novel component of the metabolic syndrome[J].Arterioscler Thromb Vasc Biol,2008,28(1):27-38.
[15]Du YZ, Gu ZY, Li CL, Liu Y,Ma LC,Gong YP,et al.Exploration of effect of aging on insulin sensitivity of Wistar rats by using the euglycaemic-hyperinsulinaemic clamp[J].Chin J Geriatr Heart Brain Vessel Dis(中华老年心脑血管病杂志),2009,11(5):369-372.
[16]Zhang M,Zhao D,Wang MY,Ren LM.Effect of urethane on insulin level in rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2003,17(5):370-374.
[17]Cusin I,Rouru J,Rohner-Jeanrenaud F.Intracerebroventricular glucocorticoid infusion in normal rats:induction of parasympathetic-mediated obesity and insulin resistance[J].Obes Res,2001,9(7):401-406.
[18]Fang LH,Kim HI,Hu JJ,Wang YH,Du GH.Antidiabetic effect and mechanisms of gemfibrozil in experimental diabetes mellitus rats[J].Chin Pharm J(中国药学杂志),2009,44(6):426-431.
[19]Mulè G,Cottone S,Mongiovì R,Cusimano P,Mezzatesta G,Seddio G,et al.Influence of the metabolic syndrome on aortic stiffness in never treated hypertensive patients[J].Nutr Metab Cardiovasc Dis,2006,16(1):54-59.
[20]Tzou WS,Douglas PS,Srinivasan SR,Bond MG,Tang R,Chen W,et al.Increased subclinical atherosclerosis in young adults with metabolic syndrome:the Bogalusa Heart Study[J].J Am Coll Cardiol,2005,46(3):457-463.
[21]Scott M,Grundy MD.Executive Summary of the Third Report of the National Cholesterol Education Program(NCEP)Expert Panel on Detection,Evaluation,and Treatment of High Blood Cholesterol in Adults[M].NIH Publication №.02-5215.2001,285:2486-2497.
[22]Saitoh M,Nishimura H,Tanaka T,Kondoh T.Genderrelated differences in target organ damage in untreated patients with essential hypertension[J].Intern Med,2006,45(6):377-383.
