黄芪多糖对腹主动脉缩窄致大鼠心肌肥厚能量代谢紊乱的抑制作用
2012-11-12王洪新喻晓春鲁美丽赵素玲周振华
宋 莹,王洪新,张 晶,喻晓春,鲁美丽,赵素玲,周振华
(1.辽宁医学院药物研究所心脑血管药物研究重点实验室,辽宁锦州 121001;2.中国中医科学院实验中心,北京 100700)
心肌肥厚发生过程中,心肌细胞能量代谢异常,游离脂肪酸(free fatty acids,FFA)的β氧化能力降低,细胞的葡萄糖摄取和酵解能力提高,造成FFA和糖酵解产物乳酸(lactic acid,LAC)积累、胞质酸化、线粒体功能降低和膜脆化,从而导致心肌肥厚和心衰[1]。黄芪多糖(Astragalus polysaccharide,APS)是黄芪的主要成分之一,由APSⅠ和Ⅱ组成;APSⅠ是杂多糖,由D-葡萄糖、D-半乳糖和L-阿拉伯糖组成;APSⅡ为葡聚糖,由α-(1→4)-D-糖苷键连接而成[2]。APS 具有提高免疫力、抗氧化[3]、抗自由基和降血糖血脂等[4]药理作用,对体外血管紧张素Ⅱ(AngⅡ)诱导心肌细胞肥大有一定的抑制作用[5]。本实验通过观察 APS对腹主动脉缩窄(abdominal aorta construction,AAC)致大鼠心肌肥厚、心肌结构、心肌细胞能量代谢及细胞线粒体功能的影响,探讨APS对心肌肥厚影响及相关机制。
1 材料与方法
1.1 药物、试剂与仪器
APS(陕西森弗生物技术有限公司),批号:HQ090312,纯度98%。LAC测定试剂盒,FFA测定试剂盒,总蛋白测定试剂盒(考马斯亮蓝法)(南京建成生物工程研究所)。线粒体膜电位测定试剂盒(江苏碧云天生物技术研究所)。RT-PCR所用试剂(大连宝生物公司)。TC-512型梯度PCR分析仪(英国Techine公司),全自动凝胶成像系统(英国Syngene公司)。Leica sp5型激光扫描共聚焦显微镜(德国Leica公司)。
1.2 动物、模型制备及分组
SD大鼠60只,清洁级,♀♂各半,体质量180~200 g,由辽宁医学院实验动物中心提供,动物合格证号:SCXK(辽)2003-0007。取大鼠48只,参照文献[6],采用结扎大鼠腹主动脉制备心肌肥厚模型。术前禁食12 h,自由饮水,ip给予水合氯醛3 mg·kg-1麻醉后,右侧卧位固定于手术台上,分离暴露左肾动脉上方腹主动脉,用针尖磨钝的8号注射针头与腹主动脉一起结扎,然后小心拔出针头,造成腹主动脉部分狭窄;手术动物分为4组:AAC 模型组,APS200,400 和800 mg·kg-1组。另取12只假手术对照组仅分离腹主动脉不行缩窄术。手术后1周APS组开始ig给药,AAC组及假手术组ig给予同等容量净水,连续11周。
1.3 监测血流动力学指标
大鼠禁食12 h后称取体质量(body mass,BM),用水合氯醛3 mg·kg-1麻醉,用 BL.420型四道生理记录仪测定大鼠的左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左心室内压最大升降速率(maximum rate of rise/decrease of LVSP,±d p/d tmax)。
1.4 心肌肥厚指数的测定
麻醉开胸取心脏,称全心湿重(heart mass,HM)和左心室湿重(left ventricle wet mass,LVM),计算心脏质量指数(heart mass index,HMI)=HM/BM(mg·g-1),左心室质量指数(left ventricular mass index,LVMI)=LWH/BM(mg·g-1)。
1.5 HE染色检测心肌组织改变
取心尖组织迅速固定于4%甲醛中,石蜡包埋。石蜡横断面连续切片5~6片,厚度约5μm,切片常规脱蜡脱水,做常规HE染色。
1.6 测定心肌生化指标
取心尖组织100 mg,置入含0.9%生理盐水0.9 ml的试管中,用匀浆器匀浆,得到组织匀浆。取心肌组织匀浆按试剂盒方法测定心肌FFA和LAC,考马斯亮蓝法测定心肌总蛋白。
1.7 RT-PCR测定心钠素(atrial natriuretic peptide,ANP)mRNA 表达
取约100 mg大鼠心脏组织放于玻璃研磨器内,加入Trizol溶液,按试剂盒要求操作,提取总RNA。取约1μg总 RNA,进行反转录。逆转录条件为:42℃ 60 min,99℃ 2 min,4℃保存。ANP 的引物序列(5'-3')为GGCTCCTTCTCCATCACCAA TGT TAT CTT CGG TAC CG,内参 GAPDH的引物序列(5'-3')为CAA AGT TGT CAT GGA TGA CCA TGG AGA AGG CTGGG。上述引物由北京奥科生物有限公司合成,灭菌水溶解并配制成100μmol·L-1的上下游引物混合液,使用浓度为20μmol·L-1。PCR反应条件:预变性94℃ 4 min,变性94℃ 45 s,退火60℃ 45 s,延伸 72℃ 45s,终末延伸 72℃ 5 min,4℃终止,32循环。循环扩增结束后,取6μl产物进行2%琼脂糖凝胶电泳。电泳结束后,置于凝胶成像系统进行观察和分析。置于凝胶成像系统进行观察,用凝胶图像分析系统软件GENETOOLS对RT-PCR产物电泳条带进行密度分析,以GAPDH为内参,根据ANP和 GAPDH密度分析结果比值,计算得到ANP的相对表达量。
1.8 心肌细胞线粒体膜电位(MMP)的测定
按照文献[7-8]方法制备肥厚心肌的单个心室肌细胞 。取(1~6)×105细胞,重悬于0.5 ml KB 液〔mmol·L-1:L-谷氨酸 70,牛磺酸 20,KCl 40,EGTA 0.5,KH2PO420,MgCl23,葡萄糖10,HEPES 10,KOH 70)中保存。加入0.5 ml JC-1(5,5',6,6'-四氯-1,1',3,3'-四乙基苯咪羰花青碘化物)染色工作液,混匀。细胞培养箱中37℃孵育20 min。参照说明书按试剂盒要求操作,最后用适量JC-1染色缓冲液重悬。用激光共聚焦显微镜观测。激光共聚焦显微镜检测JC-1单体时把激发光设置为490 nm,发射光设置为530 nm,得到绿色荧光图像;检测JC-1聚合物时,把激发光设置为525 nm,发射光设置为590 nm,观察得到红色荧光图像。以红色和绿色荧光强度的比值表示 MMP[9-10]。
1.9 统计学分析
2 结果
2.1 APS对心肌肥厚大鼠心脏指数的影响
表1结果显示,与假手术组相比,AAC模型组大鼠HMI和LVMI明显增加(P<0.01),表明大鼠已出现心脏功能障碍。与AAC模型组相比,APS 200,400 和800 mg·kg-1组大鼠 HMI和 LVMI明显降低(P<0.05,P <0.01),说明 APS可有效减轻AAC所致的心肌肥厚。
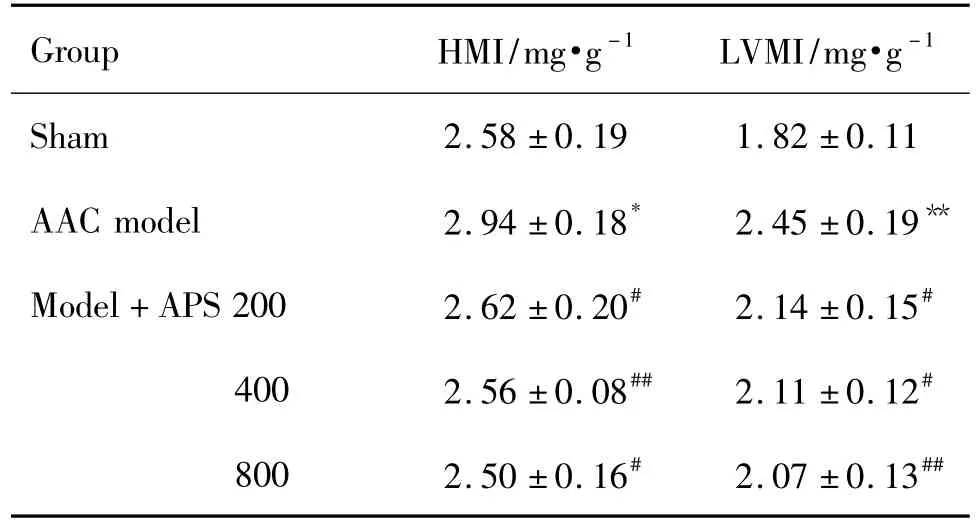
Tab.1 Effect of Astragalus polysaccharide(APS)on heart mass index(HMI)and left ventricular mass index(LVMI)in abdominal aorta constriction(AAC)rats
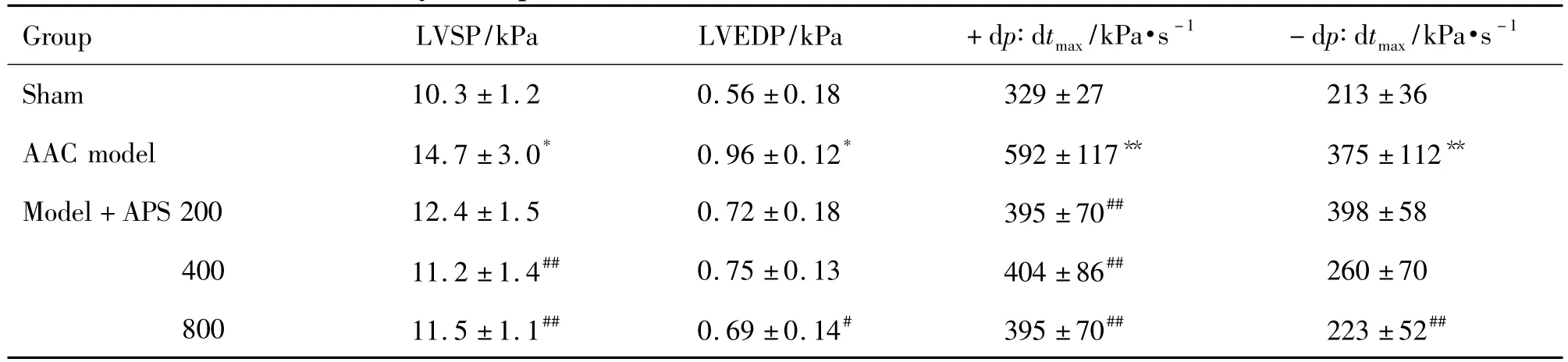
2.2 APS对心肌肥厚大鼠血流动力学的影响
表2结果显示,与假手术组相比,AAC模型组大鼠 LVSP,LVEDP和 ±d p/d tmax明显增加(P<0.05)。与 AAC 模型组相比,APS 800 mg·kg-1组大鼠LVEDP和 ±d p/d tmax明显降低(P <0.01,P <0.05),APS 400 mg·kg-1LVSP 和 +d p/d tmax明显降低(P <0.05),APS 200 mg·kg-1组无明显改变。
2.3 APS对心肌肥厚大鼠心肌病理变化的影响
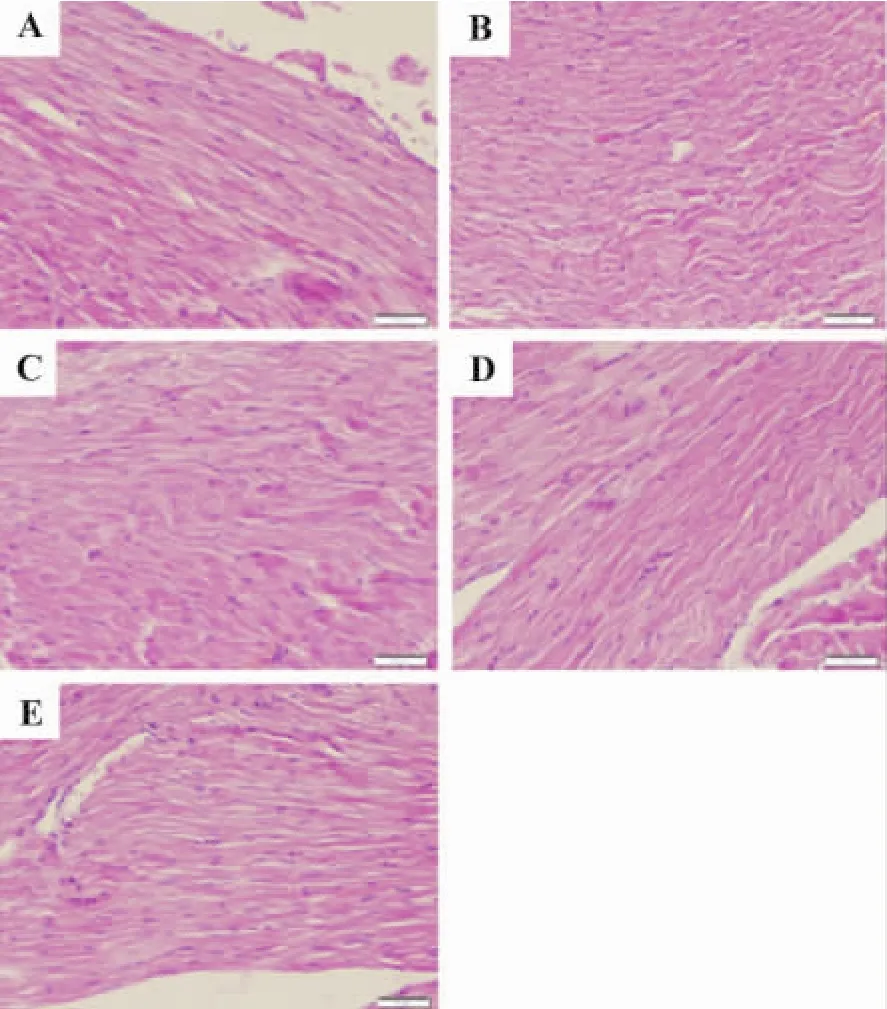
Fig.1 Effect of APSon myocardial tissue pathogenic changes of AAC rats(×200).A:sham group;B:AAC model group;C:model+APS 200 mg·kg-1;D:model+APS 400 mg·kg-1;E:model+APS800 mg·kg-1.
由图1可见,HE染色光镜下假手术组细胞形态正常,心肌纤维排列整齐(图1A);AAC模型组心肌纤维束较宽大,肌纤维间隙疏松水肿,间隙增宽,心肌细胞排列紊乱,肌纤维增粗肥大,组织中可见炎症细胞浸润间质增大(图 1B)。APS 400 mg·kg-1(图1D)和800 mg·kg-1(图1E)组病理变化与AAC模型组相比明显改善,心肌纤维束缩小,间隙变窄,心肌细胞排列较整齐,组织中炎症细胞浸润间质变小。
2.4 APS对心肌肥厚大鼠 ANP mRNA表达的影响
如图2和表3所示,与假手术组相比,AAC模型组 ANP mRNA的表达增加,为假手术组的3.4倍(P<0.01)。与模型组相比,APS 400 和800 mg·kg-1组ANP mRNA 表达明显下降,分别下降了58%和70%(P<0.05)。表明APS可以抑制AAC致肥厚心肌ANP mRNA表达。
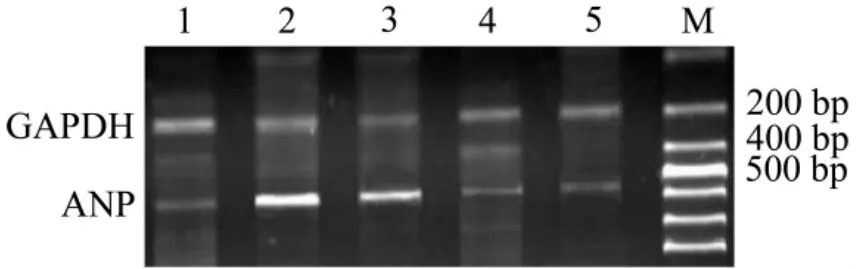
Fig.2 Effect of APS on atrial natriuretic peptide(ANP)mRNA level in AAC rats by RT-PCR.See Tab.1 for the legend.±s,n=5.Lane 1:sham group;lane 2:AAC model group;lane 3:model+APS 200 mg·kg-1;lane 4:model+APS 400 mg·kg -1;and 5:model+APS 800 mg·kg -1.
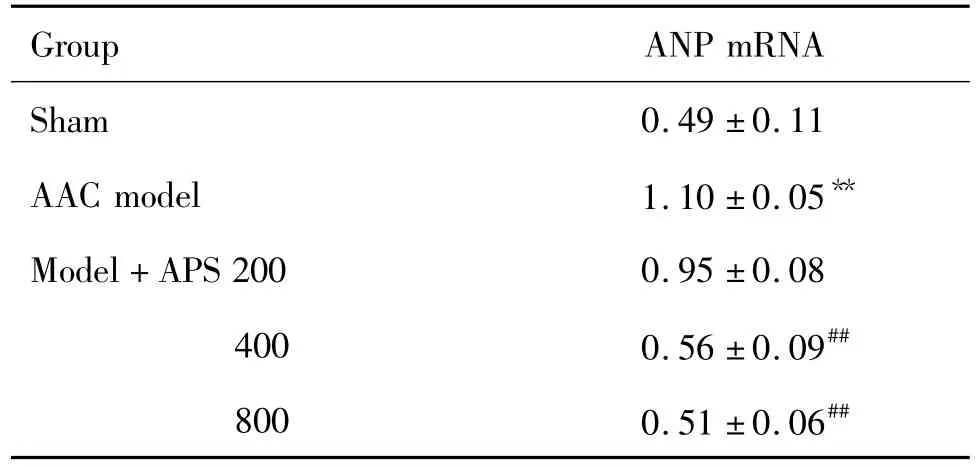
Tab.3 Effect of APSon mRNA level of ANP
Tab.2 Effect of APS on hemodynamic paramerters in AAC rats
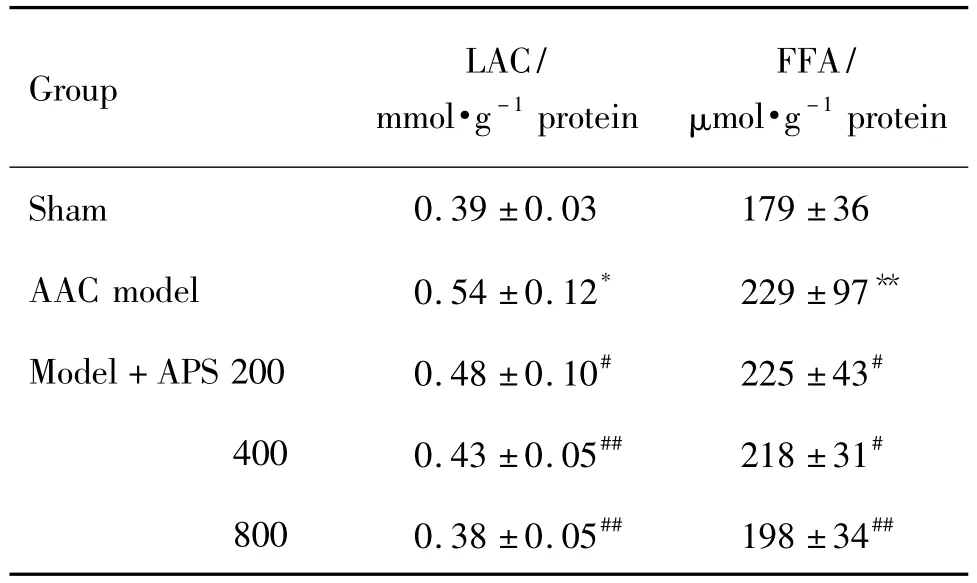
2.5 APS对心肌肥厚大鼠左心室肌组织LAC和FFA含量的影响
表4结果显示,与假手术组相比,AAC模型组大鼠左心室肌组织LAC含量是假手术组的1.38倍(P<0.01)。与模型组相比,APS 200,400 和800 mg·kg-1组 LAC 水平明显降低(P <0.05);APS 800 mg·kg-1组与假手术组水平相当。与假手术组相比,AAC模型组大鼠左心室肌组织的FFA含量显著升高,是假手术组的1.67倍。APS 200,400和800 mg·kg-1组可显著降低左心室肌组织FFA的含量(P <0.01)。
Tab.4 Effect of APSon contents of lactic acid(LAC)and free fatty acids(FFA)in AAC rats
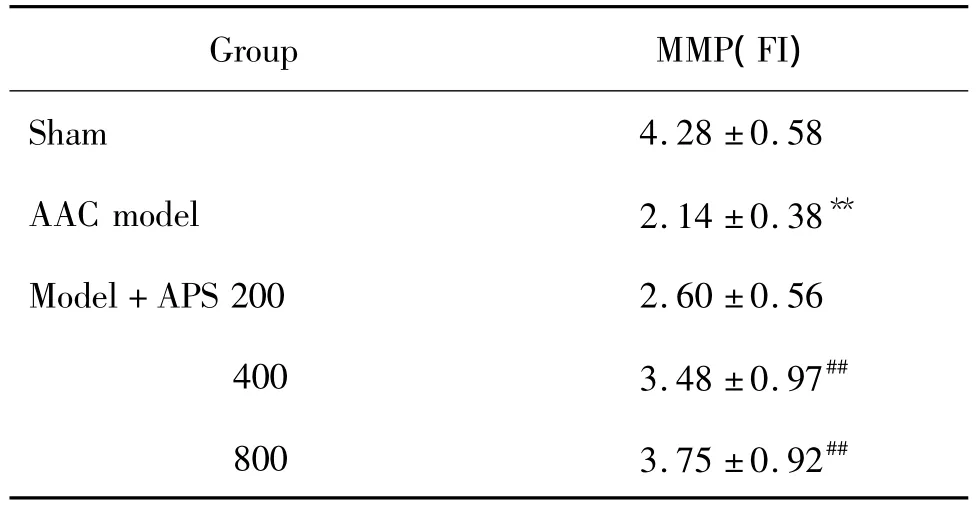
2.6 APS对心肌细胞线粒体膜电位影响
表5和图3显示,与假手术组相比,AAC模型组MMP显著降低(P<0.01);与AAC模型组相比,APS400和 800 mg·kg-1组 MMP显著增高(P<0.01),APS 200 mg·kg-1组差异不显著。
Tab.5 Effect of APS on mitochondrial membrane potential(MMP)in AAC rats
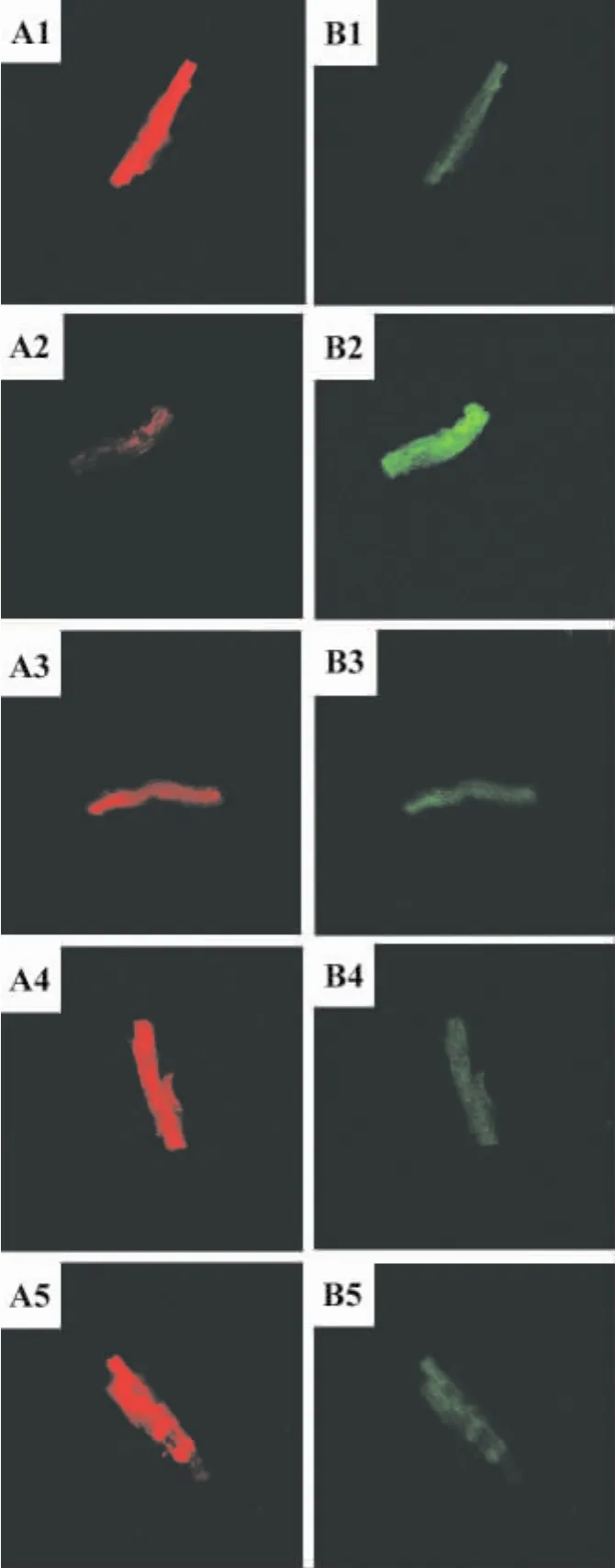
Fig.3 Effect of APSon mitochondrial membrane potential(MMP)of hypertrophic cardiomyocytes induced by AAC in rats.A:The red color shows the expression of MMP at λem=530 nm.B:The green color shows the expression of MMP atλem=590 nm.See Tab.1 for the legend.±s,n=5.1.sham group;2.AAC model group;3.model+APS 200 mg·kg-1;4.model+APS 400 mg·kg-1;5.model+APS 800 mg·kg-1.
3 讨论
心肌肥厚是多种心血管病的共同病理过程,也是心力衰竭发生的结果。腹主动脉狭窄是由手术阻碍心脏射血的后负荷增大,以后心脏出现的代偿反应,导致心肌肥厚。ANP的合成和释放增加是心肌肥厚、心肌细胞增大的一个标志性变化。12周时测定HMI和LVMI较正常对照组明显升高,ANP的mRNA表达显著增高,表明此时大鼠已经出现心肌肥厚,主要是左心室肥厚。大鼠腹主动脉缩窄后,机体为适应心脏后负荷明显增加,增高交感神经系统活性,此时心脏工作效率基本正常,处于心功能代偿期,在体观察表现为左心室收缩功能增强而舒张功能明显下降[11]。本实验研究发现,给予APS处理后,大鼠HMI和LVMI明显低于AAC模型组,血流动力学指标相对于AAC模型组明显改善,ANP的mRNA表达显著低于模型组,证明APS具有抑制腹主动脉狭窄大鼠心肌肥厚的作用。
在心肌肥厚发生过程中,心肌细胞的能量产生机制由正常情况下以脂肪酸氧化供能为主转而更多地依赖于葡萄糖氧化和酵解[12]。这些现象提示心肌肥厚发生中存在能量供应过分紧张的状态。产能机制的变化使FFA和葡萄糖酵解产物LAC的堆积在心肌肥厚中突出表现出来,引起胞质酸化导致线粒体膜脆化。本实验通过测定心肌FFA的含量,我们观察到AAC模型组的心肌FFA含量远高于假手术组,证明了之前对心肌肥厚FFA堆积的说法成立。另外AAC模型组的心肌LAC含量增高也可进一步说明心肌肥厚细胞产能机制由有氧氧化向无氧酵解转化,能量底物从以脂肪酸为主逐渐地更多转向葡萄糖;但葡萄糖产能的效率较脂肪酸低,导致心肌处于“能量饥饿状态”,造成了LAC含量过高[13]。对于APS组FFA和LAC的含量降低,由此推测APS可能通过回复正常心肌细胞产能机制的调节来抑制心肌肥厚。
线粒体是细胞进行能量代谢的主要场所。MMP是反映线粒体功能的重要生物能量学参数,其电位值大小可以直接反映线粒体功能的变化。MMP是线粒体保持稳定的重要条件,当线粒体膜完整性遭到破坏时,MMP下降,线粒体氧化磷酸化功能障碍,呼吸链解偶联,最终可导致细胞能量产生异常、凋亡或坏死。研究表明,FFA和LAC的堆积胞质酸化,线粒体膜两侧的pH梯度和电位梯度变化,使膜电位发生变化[14-15],同时线粒体膜完整性遭到破坏,最终可导致细胞能量产生异常、凋亡或坏死。本实验建立的AAC心肌肥大模型组的MMP明显低于假手术组,经过APS处理后MMP明显增高。提示APS能够通过提高MMP,对线粒体具有一定的保护作用,提高线粒体的活力。
综上所述,APS能够有效抑制AAC模型大鼠心肌肥厚,其机制可能与改善心肌能量FFA和LAC代谢紊乱和提高线粒体的活力有关,这为临床防治心肌肥厚提供新的思路。然而,APS是如何作用致FFA和LAC减少以达到保护线粒体的目的的具体机制有待进一步实验探讨。
[1]Koves TR,Ussher JR,Noland RC,Slentz D,Mosedale M,Ilkayeva O,et al.Mitochondrial overload and incomplete fatty acid oxidation contribute to skeletal muscle insulin resistance[J].Cell Metab,2008,7(1):45-56.
[2]Fang SD,Cheng Y,Xu XY,Ye CQ,Zhai SK,Shen ML.Studies of the active principies of Astragalus mongholicus Bunge.Ⅰ.Isolation,characterization and biological effect of its polysaccharides[J].Chin J Org Chem(有机化学杂志),1982,(1):26-31.
[3]Min Q,Bai YT,Yu W,Cai F,Ren P,Wu JL.Protective effects of Astragalus polysaccharide on cultured myocardial cells subjected to anoxia/reoxygenation injury in neonatal rats[J].Chin Pharmacol Bull(中国药理学通报),2010,26(12):1661-1664.
[4]Shao BM,Xu W,Dai H,Tu P,Li Z,Gao XM.A study on the immune receptors for polysaccharides from the roots of Astragalus membranaceus,a Chinese medicinal herb[J].Biochem Biophys Res Commun,2004,320(4):1103-1111.
[5]Su JZ,Nong YB,Wen ZH,Lin Q.Radix Astragali affect mRNA expression of isoenzyme creatine kinase of cultured neonatal myocyte hypetrophy induced by AngⅡin rats[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2008,14(5):40-43.
[6]Wang YZ,Sun S,Cai LR,Liu FY,Liu XH.Improvement of cardiac hypertrophy model induced by abdominal aortic coarctation in rats[J].Acad J PLAPostgrad Med School(军医进修学院学报),2004,25(3):231-232.
[7]Katoh H,Nishigaki N,Hayashi H.Diazoxide opens the mitochondrial permeability transition pore and alters Ca2+transients in rat ventricular myocytes[J].Circulation,2002,105(22):2666-2671.
[8]Saotome M,Katoh H,Satoh H,Nagasaka S,Yoshihara S,Terada H,et al.Mitochondrial membrane potential modulates regulation of mitochondrial Ca2+in rat ventricular myocytes[J].Am J Physiol Heart Circ Physiol,2005,288(4):H1820-H1828.
[9]Yuan L.The Confocal Laser Scanming Microscopy Technique Tutorials(激光扫描共聚焦显微镜技术教程)[M].Beijing:Beijing Medcal University Press,2004:91-99.
[10]Javadov S,Rajapurohitam V,Kili'c A,Zeidan A,Choi A,Karmazyn M.Anti-hypertrophic effect of NHE-1 inhibition involves GSK-3beta-dependent attenuation of mitochondrial dysfunction[J].J Mol Cell Cardiol,2009,46(6):998-1007.
[11]Su D,Yan HR,Wu DZ.Establishment and evaluation of pressure overload-induced hypertrophy model in rats[J].J Tongji Univ(Med Sci)〔同济大学学报(医学版)〕,2008,29(6):32-35.
[12]Marcil M,Ascah A,Matas J,Bélanger S,Deschepper CF,Burelle Y.Compensated volume overload increases the vulnerability of heart mitochondria without affecting their functions in the absence of stress[J].J Mol Cell Cardiol,2006,41(6):998-1009.
[13]Liedtke AJ.The origins of myocardial substrate utilization from an evolutionary perspective:the enduring role of glucose in energy metabolism[J].J Mol Cell Cardiol,1997,29(4):1073-1086.
[14]Savitha S,Panneerselvam C.Mitochondrial membrane damage during aging process in rat heart:potential efficacy of L-carnitine and DL alpha lipoic acid[J].Mech Ageing Dev,2006,127(4):349-355.
[15]Iijima T.Mitochondrial membrane potential and ischemic neuronal death[J].Neurosci Res,2006,55(3):234-243
