Liguzinediol的正性肌力作用机制及心脏安全性
2012-11-12罗卓卡刘泉明黄霏霏李雪华
徐 毅,罗卓卡,刘泉明,黄霏霏,李雪华,刘 磊,李 伟,陈 龙,4
(南京中医药大学药学院1.药理学教研室,2.中药化学教研室,江苏南京 210046;3.吴江市第一人民医院,江苏吴江 215200;4.泰州中国医药城中医药研究院,江苏泰州 225300)
2,5-二羟甲基-3,6-二甲基吡嗪(liguzinediol,LZDO),是对川芎嗪(ligustrazine)进行结构修饰而获得的水溶性化合物。前期研究表明,LZDO能增加大鼠在体和离体的心脏收缩力[1-2]。急性毒性实验表明,雄性小鼠尾静脉给药的LD50为1.692 g·kg-1[3];药物代谢动力学表明,LZDO具有良好的成药性,LZDO血药浓度(c)-时间(t)曲线呈二室模型,该药物可能通过肝药酶代谢[4]。本研究在此基础上,对LZDO正性肌力的作用机制进行初步探讨,并通过观察LZDO对豚鼠P-R间期,校正QT间期(QTc)间期,人类心脏钠通道(human cardiac sodium channel,hNav1.5)电流和人类果蝇相关基因(human ether-ago-go related gene,hERG)编码的钾电流的影响评价其心脏安全性。
1 材料与方法
1.1 试剂及仪器
Liguzinediol自制(纯度为 99.3%,结构经UV,IR,NMR 和 EI-MS 确证)[1-2]。尼莫地平(nimodipine,Nim)与 rethenium red均购自 sigma公司;RM6240B/C(四道)型多道生理记录仪,YP J01型压力换能器和HSS-1(B)型恒温浴槽均为成都仪器厂生产。膜片钳放大器(200B),数字-信号转换器(Digidata 1322A)和pClamp9.0软件均为美国Axon Instruments公司生产。微电极拉制仪(P-97)为美国Sutter Instrument公司生产。其他试剂均购自Sigma-Aldrich公司。
1.2 大鼠离体心脏实验
健康清洁级雄性SD大鼠,体质量280~320 g,动物使用许可证:SYXK(苏)2002-0053。大鼠ip给予20%乌拉坦5 ml·kg-1麻醉,快速开胸取出心脏,置于0~4℃灌流液中使之停搏,修剪分离主动脉,行主动脉插管后,采用 Langendorff装置,充氧(95%O2+5%CO2)条件下,灌流系统经主动脉行离体心脏灌流 (mmol·L-1:NaCl 117,KCl 5.7,CaCl21.8,MgCl21.7,NaHCO34.4,NaH2PO41.5,HEPES20,葡萄糖11),用NaOH调至7.4,温度为(37.5 ± 0.5)℃,灌流压 80 cmH2O(1 cmH2O=0.098 kPa)。采用插管法将压力感受器探头经左心房插入左心室,经压力换能器与RM6240型多道生理信号采集处理系统相连用于记录左心室收缩曲线。按照灌流液 (空白对照)→LZDO 100μmol·L-1→洗脱的顺序灌流,持续5 min并于灌流5 min末记录大鼠离体心脏左心室的各项心功能参数。再按照灌流液→Nim 1 μmol·L-1或 rethenium red 5 μmol·L-1→Nim 1 μmol·L-1+LZDO 100 μmol·L-1或 rethenium red 5 μmol·L-1+LZDO 100 μmol·L-1的顺序灌流。上一剂量灌流结束随后灌流下一剂量,每一组灌流持续5 min,分别记录各浓度组给药5 min后的左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压(left ventricular end diastolic pressure,LVEDP)、左心室内压最大升降速率(maximum rate of rise/decrease of left ventricular pressure,±d p/d tmax)和心率(heart rate,HR)。
1.3 豚鼠离体和在体心电图实验
1.3.1 豚鼠在体实验
10只豚鼠,体质量250 ~300 g,雌雄不拘,由南京中医药大学实验动物中心提供,实验动物使用许可证:SYXK(苏)2002-0053。豚鼠ip给予20%乌拉坦(5 ml·kg-1)麻醉,仰卧位固定,针形电极引导记录Ⅱ导联心电图,经四道生理记录仪采样并存入计算机。10只豚鼠分为2组,每组5只,分别经颈外静脉缓慢推注生理盐水或 LZDO 1.7 g·kg-1(LZDO被溶解在1 ml的生理盐水中),持续5 min。给药前留有5 min平衡时间,于处理后5 min记录心电图,分析P-R间期及QTc间期。QTc=QT/RR间期的平方根[5]。
1.3.2 豚鼠离体实验
豚鼠离体心脏灌流同1.2。将3个电极分别置于心尖、右心室游离壁和主动脉根部。按照灌流液(空白对照)→LZDO 300 μmol·L-1顺序灌流,每一灌流持续5 min,给药5 min后记录离体心脏心电图并分析其P-R及QTc间期。
1.4 膜片钳全细胞方法记录细胞膜离子电流[6]
1.4.1 记录大鼠左心室肌细胞L型钙电流
采用常规大鼠心肌细胞分离方法[6]分离心肌细胞。在室温(20~22℃)下进行。细胞外灌流液为(mmol·L-1):NaCl 138,KCl 9,CaCl21,MgCl21,TEA-Cl 10,HEPES 10,用 NaOH 调至 7.4。电极(阻抗约为 5 MΩ)内液为(mmol·L-1):CsCl 130,MgCl22,EGTA 11,葡萄糖10,HEPES20,Na2ATP 2,GTP 0.1,用CsOH调至7.4。电压由-80 mV阶跃到-40 mV维持30 ms,然后由 -40 mV阶跃到0 mV维持300 ms,最后恢复到-80 mV。电流信号由与计算机相连的膜片钳放大器(Axon Instruments 200B,USA)放大并经数字-信号转换器与计算机对话,信号的发放和采集均由pClamp9.0软件完成,并将数据存储于硬盘内。按照灌流液(空白对照)→Nim 2 μmol·L-1顺序灌流左心室肌细胞,观察所记录的电流。另一组实验按照灌流液→LZDO 100μmol·L-1顺序灌流,于灌流 5 min末记录其 5个细胞L型钙电流。
1.4.2 记录 hNav1.5 电流
合成的 hNav1.5 cDNA(NM_000335.4)被克隆到带有G418耐药性的表达载体pcDNA3.1上。构成的质粒在脂质体2000转染试剂作用下,转染到无内源性 hNav1.5通道表达的 HEK细胞系中。hNav1.5细胞株通过规范的次代培养以维持最适宜的状态,并且DMEM培养基上培养(10%小牛血清和G418 250 mg·L-1)。稳定表达 hNav1.5 通道的HEK293细胞,培养于35 mm培养皿中,在37℃/5%CO2培养箱中放置至少24 h后用于实验。hNav1.5 HEK细胞系被广泛应用于hNav1.5通道的研究中[7-8]。记录外液(mmol·L-1:NaCl 25,TEA-Cl 122,MgCl21,葡萄糖10,HEPES10,CaCl21.8),pH用NaOH调至 7.4,用蔗糖将渗透压值调至290 mOsm。记录内液(mmol·L-1:CsF 129,MgCl22,EGTA 11,HEPES 10,Na2ATP 3),pH 用CsOH 调至7.2,用蔗糖将渗透压值调至277 mOsm。钳制电压为-80 mV,阶跃到-20 mV维持20 ms。按照灌流液(空白对照)→LZDO 1→10→100→300 μmol·L-1的顺序灌流,于灌流5 min末记录其5个细胞的电流。
1.4.3 记录 hERG 电流
合成的hERGcDNA(NM_000238.2)被克隆到带有G418耐药性的表达载体pcDNA3.1上,其他步骤同1.4.2 细胞株的制备。记录外液(mmol·L-1):NaCl 137,MgCl21.2,KCl 5.4,葡萄糖10,HEPES10,CaCl22,pH用NaOH调至7.4,用蔗糖将渗透压值调至 290 mOsm。记录内液(mmol·L-1):KCl 130,MgCl21,HEPES10,Mg-ATP 5,EGTA 5,GTP 0.1,pH用 KOH调至 7.3,用蔗糖将渗透压值调至290 mOsm。钳制电压为-80 mV,阶跃到-50 mV维持50 ms,然后施加到50 mV 4800 ms试验电压,最后施加到-50 mV 5000 ms试验电压。按照灌流液(空白对照)→LZDO 1→10→100→300 μmol·L-1的顺序灌流,于灌流5 min末记录其5个细胞的电流。
1.5 激光共聚焦测定左心室心肌细胞钙释放[9]
急性分离大鼠左心室心肌细胞[6]。细胞在37℃条件下,与 Fluo-3(5 μmol·L-1)共孵育30 min,用灌流液(同1.2灌流液)清洗5次,除去残留的Fluo-3。加载好荧光染料的细胞(选用横纹清楚、呈杆状、无收缩的细胞)置于Zeiss LSM 710倒置共聚焦显微镜系统的载物台上。0.5 Hz的局部场刺激由电子刺激器通过一对刺激电极以1.5倍阈强度的脉冲实施,从而触发细胞产生钙瞬变。共聚焦显微镜的成像方式为线扫描,采样速率为2 ms/线,共聚焦线扫描在局部场刺激开始前200 ms即开始,起始部分作为刺激前的本底对照。按照灌流液(空白对照)→LZDO 100 μmol·L-1的顺序灌流,分别于灌流LZDO 前及后 30 s,1,1.5,2,3,5,10,15,20,25,30,35,40 min末记录其5个细胞的钙瞬变。选择2 min(大约为钙瞬变最大值的开始时间点)和30 min(大约为钙瞬变最大值的末期)为分析点。实验获得图像用IDL程序处理,钙瞬变的大小以标准荧光强度(F)/F0表示,其中F0为静息状态荧光强度。
1.6 统计学分析
2 结果
2.1 LZDO对大鼠离体心脏和心肌电生理的影响
大鼠离体心脏收缩力(表 1)表明,LZDO 100 μmol·L-1能显著性增加LVSP,LVEDP 和±d p/d tmax,但对HR无影响,洗脱后出现部分回复。Nim 1 μmol· L-1+LZDO 或 rethenium red 5 μmol·L-1+LZDO同时灌入,LVSP,LVEDP,±d p/d tmax显著降低,与单用Nim或rethenium red作用相当,说明 Nim或 rethenium red可阻断 LZDO 100 μmol·L-1的正性肌力作用。
2.2 LZDO对豚鼠在体和离体心脏P-R间期及QTc间期的影响
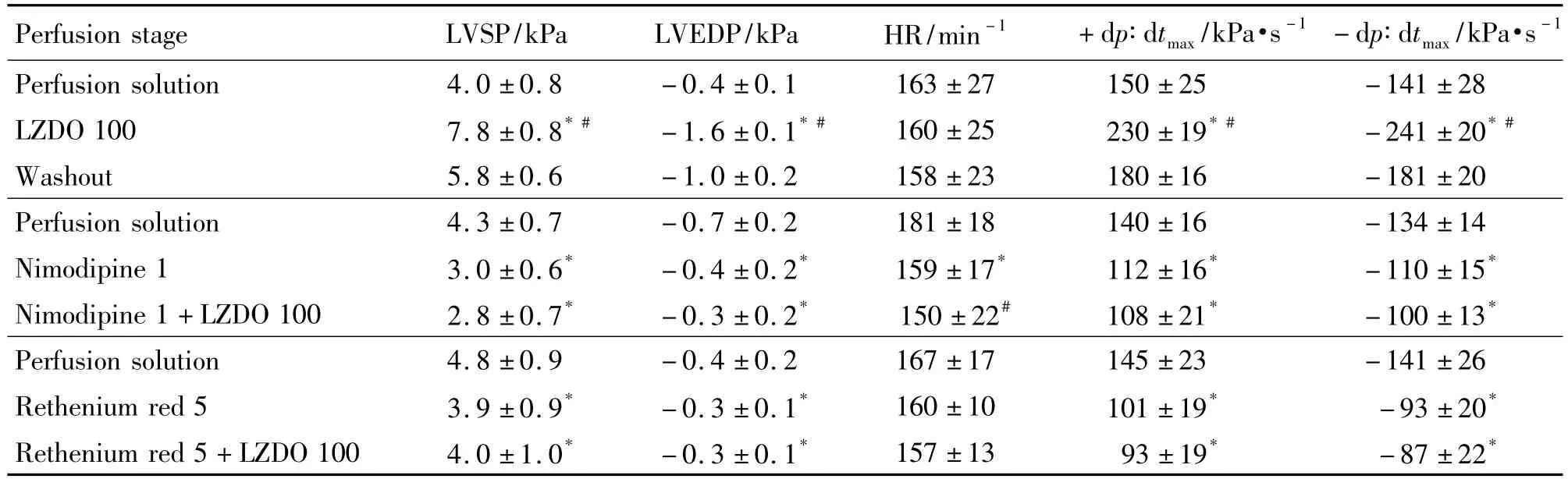
豚鼠在体心电图(图1A)显示,生理盐水组和LZDO 1.7 g·kg-1组的 P-R 间期分别为(60 ±5)ms和(59±40)ms,QTc间期分别为(248±20)ms和(250±18)ms,两者间均无显著差异。
Tab.1 Effect of liguzinediol(LZDO)on positive inotropy in isolated rat hearts
豚鼠离体心电图(图1B)显示,空白对照和LZDO 300 μmol·L-1灌流的P-R 间期分别为(79±15)ms和(80±20)ms;QTc间期分别为(310±19)ms和(312±17)ms,两种灌流无显著性差异。
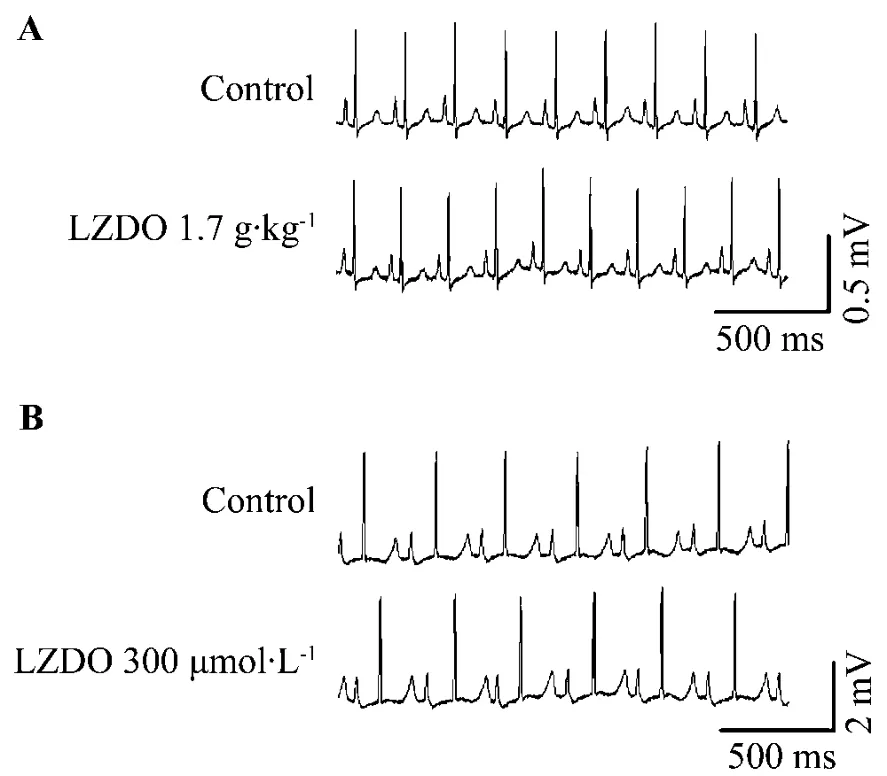
Fig.1 Effects of LZDO on P-R and QTc of guinea pig ECG in vivo(A)and in vitro(B).
2.3 LZDO对正常大鼠左心室肌细胞L型钙电流的作用
Nim 2 μmol·L-1能完全阻断所记录的电流,表明该电流为L型钙电流(图2A)。LZDO 100μmol·L-1对L型钙电流无显著性作用(图2B数据未显示)。
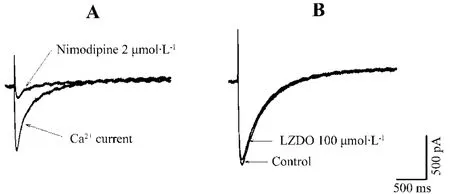
Fig.2 Effcet of LZDO on L-type Ca2+current from adult rat left ventricular myocyte.
2.4 LZDO对hNav1.5和hERG电流的影响
图3 和图 4可见,LZDO 1,10,100和300 μmol·L-1对 hNav1.5 和 hERG 电流无显著性的抑制作用。对照组 hNav1.5电流为(3920±442)pA,LZDO 1,10,100 和300 μmol·L-1组分别为3724±259,3656±346,3564±253和(3513±231)pA,与对照组无显著差异。对照组hERG电流为 (1205 ± 25)pA,LZDO 1, 10, 100 和300 μmol·L-1分别为1151±24,1106 ±24,1086±75和(1022±10)pA,与对照组无显著差异。
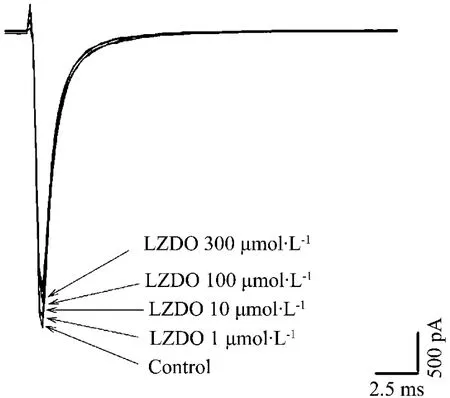
Fig.3 Effect of LZDO on hNav1.5 current.
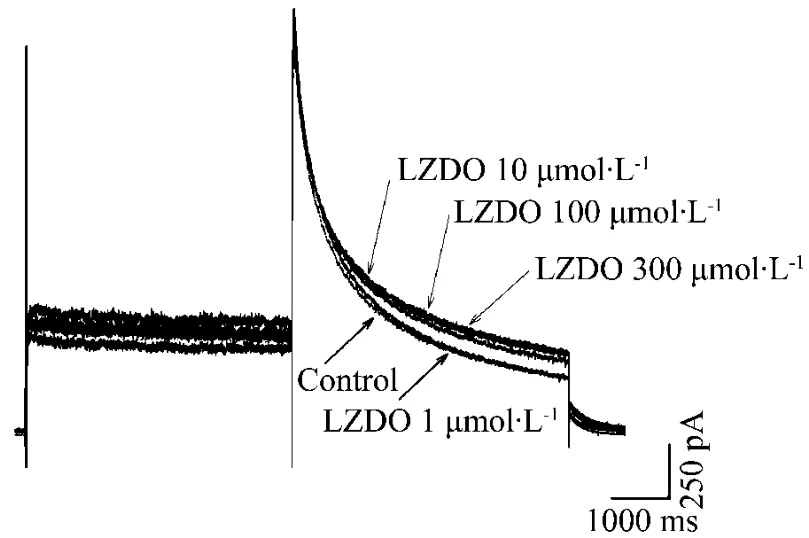
Fig.4 Effect of LZDO on hERG current.
2.5 LZDO对大鼠左心室心肌细胞钙释放的影响
图5 表明,LZDO 100 μmol·L-1能明显增加大鼠左心室心肌细胞的钙释放量,2 min和30 min从标准化的对照组(100±4)%增加到(138±7)%及(139±12)%(n=5,P <0.05)。LZDO 增加心肌细胞钙释放的作用持续到30 min。而且 LZDO 100μmol·L-1未影响钙释放的基础水平。
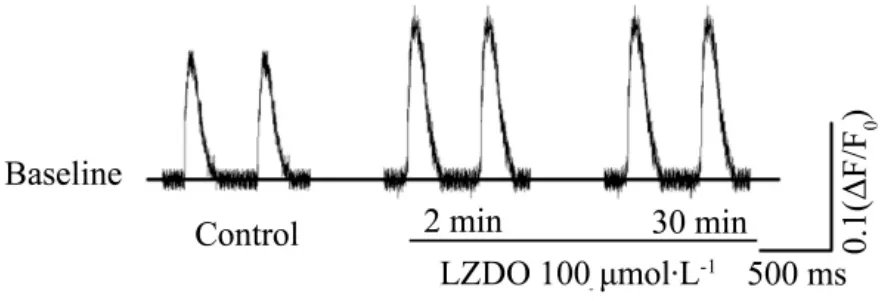
Fig.5 Effect of LZDO on intracellular Ca2+transients in adult rat left ventricular myocyte.
3 讨论
本实验结果表明,LZDO增加大鼠左心室收缩力的作用与肌浆网的钙释放有关。LZDO并没有显著性改变豚鼠在体与离体心电图的P-R间期及QTc间期,LZDO 300 μmol·L-1并没有显著性抑制 hNa1.5和hERG电流,在心脏安全性评价实验中LZDO无致心律失常的作用。
本研究在前期研究工作[1]的基础上,证明LZDO对L型钙电流并无直接的作用,而L型钙通道又能介导LZDO的正性肌力作用,表明从L型钙通道活动到心肌收缩的链条中,LZDO作用于L型钙通道的下游。该链条可表述为动作电位到达心肌细胞膜→引起心肌细胞去极化→L型钙通道开发并导致Ca2+内流→内流的少量Ca2+引起肌浆网(SR)膜上的兰尼碱受体(ryanodine receptor,RyR)开放→钙诱导性钙释放(calcium-induced calcium release,CICR)→释放大量的Ca2+→肌浆网的Ca2+浓度下降→肌浆网膜上的钙泵(SR-Ca2+ATPase)活动→Ca2+重新泵入肌浆网中[10-11]。增加L型钙电流或者激活RyR可增加肌浆网钙释放[12-13]。L型钙通道阻滞剂Nim阻断了LZDO的正性肌力作用,是由于Nim阻断了CICR的过程,结合LZDO对L型钙电流无作用的实验结果,判断L型钙通道不是LZDO发挥正性肌力作用的靶点。本实验rethenium red通过阻断肌浆网钙释放的最后过程,使LZDO无法发挥正性肌力作用,说明LZDO发挥正性肌力的作用与肌浆网钙释放有关。大鼠左心室心肌细胞钙释放实验表明,LZDO 100 μmol·L-1能明显增加心肌细胞钙释放,并能持续到30 min。本研究表明,LZDO作用靶点不在L型钙通道,对L型钙通道并无直接作用,但L型钙通道被阻断后,CICR过程也无法实现,LZDO无法通过作用于RyR或肌浆网膜上的钙泵而发挥正性肌力作用。至于LZDO是否直接作用于RyR而发挥正性肌力作用,还有待于进一步研究。
人用药品注册技术要求国际协调会(ICH)关于心脏安全评估的S7B文件中做出了明确的规定[14],药物心脏安全性评价分为必备实验(在体清醒动物心电图QTc和hERG实验)及追加实验(包括L型钙电流、钠电流、动作电位等)。对于药物实验的浓度及剂量也作出了明确的规定[15],一般要求30倍临床使用剂量。考虑到LDZO无临床剂量可参考,本实验在体心电图实验采用LDZO的LD50的剂量,即1.7 g·kg-1,离体实验采用 LZDO 发挥正性肌力作用的中间浓度的30倍,即300μmmol·L-1。本心脏安全性实验表明,LZDO并未引起心律失常,也没有抑制hNav1.5与hERG电流,表现出良好的心脏安全性。
[1]Liu Z,Zhou SY,Li W,Wen HM,Bian HM,Chen L.Liguzinediol induced positive inotropic effect in normal isolated rat hearts[J].Chin J New Drugs Clin Rem(中国新药与临床杂志),2009,28(4):293-296.
[2]Liu Z,Bian HM,Chen L,Li W,Wen HM.Effect of Liguzinediol on cardiac hemodynamics in healthy rats[J].Chin Pharm J(中国药学杂志),2009,44(15):1155-1158.
[3]Wan K,Liu Z,Bian HM,Li W.Acute toxicity of liguzinediol[J].Chin J New Drugs Clin Rem(中国新药与临床杂志),2011,30(3):234-235.
[4]Shan CX,LI W,Wen HM,Wang XZ,Bai YT,Bian HM.Determination of liguzinediol and its pharmacokinetics in rat by ultra performance of liquid chromatograph[J].Chin Pharmacol Bull(中国药理学通报),2011,27(5):709-712.
[5]Dekker JM,Crow RS,Hannan PJ,Schouten EG,Folsom AR;ARICStudy.Heart rate-corrected QT interval prolongation predicts risk of coronary heart disease in black and white middle-aged men and women:the ARICstudy[J].J Am Coll Cardiol,2004,43(4):565-571.
[6]Chen L,Wang L,Xu B,Ni G,Yu L,Han B,et al.Mechanisms of alpha1-adrenoceptor mediated QT prolongation in the diabetic rat heart[J].Life Sci,2009,84(7-8):250-256.
[7]Song LS,Sham JS,Stern MD,Lakatta EG,Cheng H.Direct measurement of SR release flux by tracking Ca2+spikes'in rat cardiac myocytes[J].J Physiol,1998,512(Pt 3):677-691.
[8]Chancey JH,Shockett PE,O'Reilly JP.Relative resistance to slow inactivation of human cardiac Na+channel hNav1.5 is reversed by lysine or glutamine substitution at V930 in D2-S6[J].Am J Physiol Cell Physiol,2007,293(6):C1895-C1905.
[9]Shuraih M, Ai T, Vatta M, Sohma Y,Merkle EM,Taylor E,et al.A common SCN5A variant alters the responsiveness of human sodium channels to classⅠantiarrhythmic agents[J].J Cardiovasc Electrophysiol,2007,18(4):434-440.
[10]Cheng H, Lederer WJ. Calcium sparks[J].Physiol Rev,2008,88(4):1491-1545.
[11]Luo D,Yang D,Lan X,Li K,Li X,Chen J,et al.Nuclear Ca2+sparks and waves mediated by inositol 1,4,5-trisphosphate receptors in neonatal rat cardiomyocytes[J].Cell Calcium,2008,43(2):165-174.
[12]Chen-Izu Y. Multiple levels of the single L-type Ca2+channel conductance in adult mammalian ventricular myocytes[J].Biochem Biophys Res Commun,2010,391(1):604-608.
[13]Satoh H,Katoh H,Velez P,Fill M,Bers DM.Bay K 8644 increases resting Ca2+spark frequency in ferretventricular myocytes independent of Ca influx:contrast with caffeine and ryanodine effects[J].Circ Res,1998,83(12):1192-1204.
[14]Chen L,Yang L,Lü Q,Zhang ZH,Zhai J,Zhang JZ.Technical requirements from ICH for preclinical cardiac safety evaluation of pharmaceuticals[J].Chin New Drugs J(中国新药杂志),2010,19(18):1642-1647.
[15]Shi Z,Xu Y,Zhou SY,Peng GP,Chen L.Electrophysiological effects of Shuang-huang-lian intravenous injection on guinea pig hearts[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2010,24(6):455-459.
