壮观链霉菌中抑菌组分的初步分离与纯化
2012-11-08易小利俞玲娟张正波裘娟萍
易小利,郑 雪,俞玲娟,张正波,裘娟萍
(浙江工业大学 生物与环境工程学院,浙江 杭州 310014)
壮观链霉菌 (Streptomyces spectabilis)属于粉红孢类群,气生菌丝体为橙红色。孢子丝直,有时呈假轮生,含10~50个孢子,孢子为椭圆形,表面光滑呈鲜红色[1]。壮观链霉菌是大观霉素 (又称奇放线菌素或壮观菌素)的主要产生菌。大观霉素具有广谱的抗菌活性,对革兰氏阳性菌及阴性菌均有较强的抑制能力[2]。
壮观链霉菌菌株LXR1H-8 是经基因组重排和传统诱变获得的菌株,其抑菌活性大大提高,尤其是抑菌组分对革兰氏阳性菌的高效抑制,而对革兰氏阴性菌如大肠杆菌的抑菌活性降低,与大观霉素的抑菌谱不尽相同,因而推测改良后的壮观链霉菌菌株LXR1H-8 的代谢产物发生了改变[3]。本试验目的在于利用生物自显影方法和TLC 方法跟踪抑菌组分,多次使用硅胶柱层析分离样品,获得较好的分离效果。
在活性组分分离纯化过程中常用的快速检测方法为化学显色法、紫外可见分光光度法和高效液相色谱法。由于试验初期没有标准品作为对照又不清楚其化学结构,难以进行定性和定量;若采用其他生物活性测定方法如滤纸片法,则需要大量的样品,在达到有效活性跟踪的目的时,也造成了活性组分的浪费,对于一些分离过程复杂的工艺来说,更是浪费原料,也不利于一些微量成分的分离与纯化[4]。本试验采用了生物活性检测法和TLC 分析相结合的方法,达到高效抑菌组分的分离纯化效果。
生物自显影法的原理是将具有生物活性的组分,如抗生素等,在薄层层析或是纸层析上分离后,将分离开的条带 (硅胶粉末刮取或剪切或直接覆盖)与有相当指示菌的培养基表面接触,在合适的温度下经过一定时间培养后,琼脂表面出现抑菌点而得到定位。通过这种方法进行活性检测,一方面可以节约原料,达到活性跟踪的目的,另一方面证实继续分离纯化可得到单一抑菌活性组分的可能性。
1 材料与方法
1.1 材料
壮观链霉菌LXR1H-8,试验指示菌藤黄八叠球菌 (Sarcina lutea),由浙江工业大学微生物试验室保存。
斜面培养基:牛肉膏2.5%,可溶性淀粉2.0%,K2HPO40.05%,MgSO40.05%,NaCl 0.05%,FeSO4·7H2O 0.001%,pH 值7.2,121℃灭菌20 min。
菌丝体培养基:酵母膏0.4%,葡萄糖1.0%,蛋白胨 0.4%,MgSO4·7H2O 0.05%,KH2PO40.2%,K2HPO40.4%,pH 值7.0,115℃灭菌30 min。
鉴定培养基:蛋白胨6 g,酵母浸膏6 g,牛肉浸膏1.5 g,葡萄糖10 g,琼脂15 g,蒸馏水1 000 mL,pH 值7.8,115℃灭菌30 min。
1.2 壮观链霉菌菌株培养
取活化后的斜面,以10% (V/V)的接种量接入摇瓶 (250 mL)种子培养基中,置于28℃,160 r·min-1旋转式摇床中培养24 h。以10% (V/V)的接种量将上述种子液接入30 mL 菌体培养基中,置于28℃,160 r·min-1旋转式摇床中培养120 h。
1.3 指示菌的培养及菌悬液的配制
取1 支新鲜藤黄链霉菌的斜面,用接种环挑取1 环在新的斜面培养基上划线,置于37℃恒温培养箱中培养12 h,备用。
使用时用已灭过菌的生理盐水将菌苔洗下,并测定其在600 nm 下的吸光度,调整菌液浓度至D值为1.5,备用。
1.4 生物自显影
在无菌条件下将制备好的藤黄八叠球菌菌悬液(D600=1.500,1 mL)加入到培养基中 (100 mL),摇匀后倾注平皿,每个培养皿倒入培养基25 mL。待培养基凝固后,将已层析结束后展开剂完全挥发的硅胶板取出,刮取相应的条带粉末置于培养基表面,并在硅胶粉末处放置牛津杯,向其中加入50 μL 的甲醇溶液,目的在于抑菌组分充分溶解并随牛津杯均匀扩散,形成规则的抑菌圈。盖好平皿,将培养皿置于培养箱中培养12 h,观察试验结果。
1.5 TLC 跟踪抑菌组分
用铅笔在已活化的硅胶板 (GF 254)下端1 cm 处划一平行底边的细线并等距离标志点样点。点样采用0.3 mm 玻璃毛细管点样,点样直径小于2 mm,展开采用立式玻璃展开槽。先向展开槽中加入展开剂,静置30 min,使展开槽内部充满饱和气体,之后将硅胶板迅速放入,尽量不破坏展开槽内溶剂的饱和状态,进行线性上行展开。层析结束时取出硅胶板,及时用铅笔标记溶剂前沿,吹干后254 nm 紫外透射仪下观察展开结果。
1.6 壮观链霉菌发酵液中抑菌组分的粗提
取壮观链霉菌的发酵液10 L,经离心处理后,去除菌渣,加入适量的草酸除去Ca2+,离心,取上清液,用乙酸乙酯少量多次提取上清液,收集乙酸乙酯相,减压蒸干浓缩,获得棕色膏状物即为壮观链霉菌抑菌组分的粗提物。
1.7 粗提物的前处理
依次用MCI 柱层析和硅胶柱层析分离抑菌组分,收集洗脱液,采用TLC 方法,合并条带相同的部分,收集洗脱液浓缩蒸干,获得有效的抑菌组分C1(粗品)。
1.8 硅胶柱层析分离C1组分
1.8.1 展开剂的选择
用玻璃毛细点样管吸取少量C1在硅胶板上点样,选用氯仿-甲醇体系为20∶1,30∶1。依次展开,选择Rf=0.3~0.4 的展开体系。254 nm 紫外显色,观察试验结果。
1.8.2 色谱条带的抑菌活性跟踪
选择氯仿-甲醇体系 (30∶1)的展开色谱条带,将相应的色谱条带刮取下,分别用少许等量的甲醇溶解,检测方法同1.4 节。
1.8.3 上样洗脱
准确称取120 g 的硅胶干法装柱,柱规格为5 cm×60 cm。将少量甲醇溶解的样品C1(172 mg)加入硅胶拌样,干法上样,洗脱液氯仿-甲醇30∶1 (V/V),洗脱流速约为4 mL·min-1,依次收集洗脱液,每管约12 mL,共收集40 管。TLC 分析收集的样液,展开剂为氯仿-甲醇30∶1 (V/V)。
1.8.4 硅胶柱层析分离C1x部分
准确称取120 g 的硅胶 (100~200 目)干法装柱,柱规格为5 cm×60 cm,将少量甲醇溶解的样品C1b(170 mg)加入硅胶拌样,干法上样,洗脱液石油醚-丙酮1∶1 (V/V),洗脱流速约为4 mL·min-1,依次收集洗脱液,约每管12 mL,共收集80 管。TLC 分析收集的样液,展开剂选用石油醚-丙酮1∶1 (V/V)。
1.8.5 凝胶柱层析纯化Cv部分
量取已预先处理好的凝胶树脂HW-40C 300 mL,湿法装柱,柱规格2.4 cm×70 cm。样品Cv(20 mg)用少量的甲醇充分溶解,上柱吸附后再洗脱。洗脱液为分析纯甲醇,洗脱流速 1 mL·min-1,收集洗脱液,每管10 mL,共收集80管。TLC 分析收集的样液,展开剂为石油醚-丙酮1∶1 (V/V)。254 nm 紫外显色,观察试验结果。
1.8.6 液质联用 (LC-MS)方法
液质联用适于成分复杂的代谢产物分析,其原理为以液相色谱做为分离系统,质谱为检测系统。样品在质谱部分和流动相分离,被离子化后,经质谱的质量分析器将离子碎片按质量数分开,经检测器得到质谱图。取目的组分Cv2少许,用甲醇稀释置于液相瓶中,根据已建立的液相条件,分析保留时间为25.127 h 的液相峰,ESI 正源。
2 结果与分析
2.1 硅胶柱层析分离C1组分
2.1.1 洗脱剂的选择
样品C1分别在a,b 2 块硅胶板上点样,展开体系为氯仿-甲醇,配比分别为20∶1 和30∶1。展开结果如图1 所示,目标条带已标记 (蓝色线圈),其在a,b 2 块板的Rf值分别为0.48 和0.35。选择Rf=0.35 的展开体系作为硅胶柱层析的洗脱条件。
2.1.2 活性跟踪抑菌组分
样品C1在硅胶板上点样,展开后显色观察,将3 条较为明显的色谱带刮取下,采用管碟法检测3 条带的抑菌活性。12 h 后观察结果。如图2 所示,1 和2 无抑菌活性,3 有抑菌活性,抑菌圈22.0 mm。试验结果显示,1 和2 色谱条带为杂质,3 为目标组分。

图1 λmax254 nm 下C1活性组分在氯仿-甲醇体系中的层析

图2 色谱条带抑菌活性跟踪结果
2.1.3 上样洗脱
收集40 管洗脱液,每隔1 管洗脱液硅胶板上点样,展开后,紫外显色。如图3 所示,目标组分主要集中在17~23 管,但是目的条带 (蓝色线框标记)与杂带 (绿色线框标记)并未分开,展开剂为氯仿-甲醇 (30∶1)体系不适于上样洗脱。故合并洗脱液17~23 管 (C1x),减压浓缩蒸干,获得C1x50 mg,用于下步的分离纯化。

图3 洗脱液1~35 管紫外 (λ254nm)显色结果
2.2 硅胶柱层析分离C1x部分
收集80 管洗脱液,自第11 管洗脱液开始,每隔1 管点样,薄层层析后进行紫外观察。如图4 所示,11~19 管主要是杂带,23~69 管是目的条带。故根据TLC 分析,可合并Rf值相同的部分。即真空减压浓缩23~69 管 (Cv),蒸干获得20 mg。
2.3 凝胶柱层析纯化Cv部分
如图5 所示,收集40 管洗脱液,每隔1 管点样,展开显色后,23~33 管目的条带清晰,条带比较纯。故合并23~33 管,减压浓缩蒸干后获得Cv23.00 mg。且这部分的组分比较纯,基本是单一组分。
2.4 液质联用
2.4.1 样品Cv2的液相分析方法建立
利用分光光度计对样品Cv2(yxl-2)全波段扫描,波长为200~800 nm,结果显示最大光吸收值λmax=254 nm。样品在甲醇中溶解度较好,流动相选择甲醇-水体系,故液相条件设定为ZORBAX Eclipse XDB-C18 (5 μm,4.6 mm×250 mm),检测波长254 nm,流动相为甲醇∶水=40∶60~90∶10(V/V),0~ 60 min梯度洗脱,流速0.8 mL·min-1,柱温30℃,进样量为20 μL (图6)。
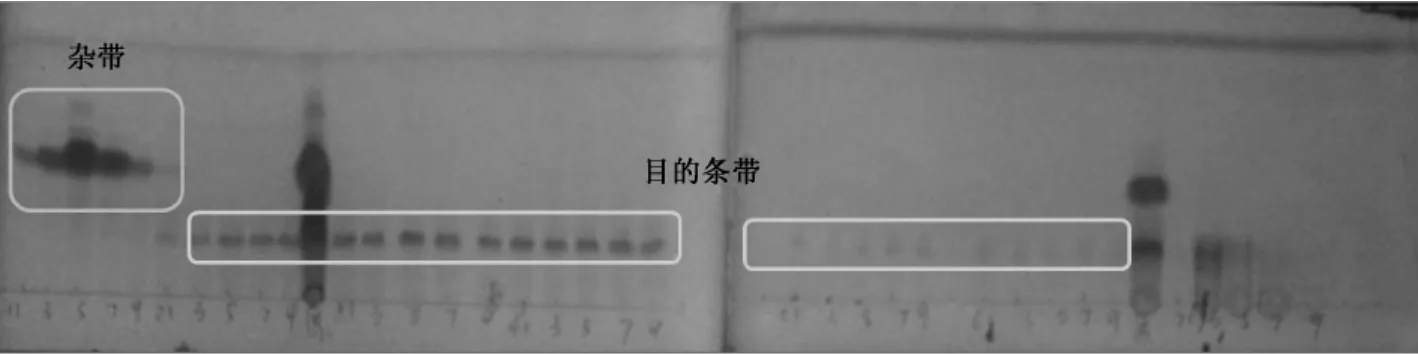
图4 洗脱液11~79 管的紫外 (λ254nm)显色结果
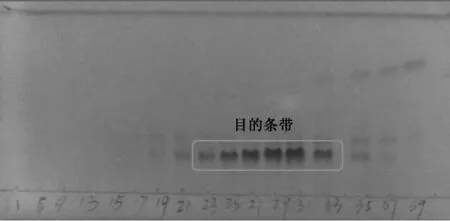
图5 洗脱液1~40 管紫外 (λ254nm)显色结果

图6 样品Cv2的液相分析图谱
2.4.2 样品CV2的质谱
如图7 所示,保留时间为25.127 h,样品CV2的分子量为1 448,与壮观链霉菌的代谢产物大观霉素、巴佛罗霉素A1(bafilomycin A1)、硝苯吡喃酮(nitrophenyl pyrone)、曲张链丝菌素(streptovaricin)、间环丙菌素(metacycloprodigiosin)、spectomycin 和壮观链菌素 (spectinabilin)等分子量均不相同,因此可推测是一种新的抑菌组分,样品CV2的化学结构鉴定还需借助其他图谱的分析。

图7 t=25.127 h,CV2的质谱
3 小结和讨论
采用生物自显影和TLC 相结合的方法跟踪壮观链霉菌发酵液中的抑菌组分非常明确且简便,测定结果不受杂质的影响。TLC 是被分离物质即样品、吸附剂和展开剂共同作用的结果,因此选择与样品及吸附剂相匹配的展开剂是分离效果好坏的关键。
本试验过程中多次采用了硅胶柱层析分离技术,该技术分离提取效果较好。采用硅胶柱层析分离技术需要注意一下几点:首先是装柱。试验选择干法装柱,将吸附剂通过漏斗倒入柱内,同时用橡皮槌轻轻敲打色谱柱,使装填均匀。柱装填好后,打开下端活塞,连接真空泵的一端,抽去柱内填料间的空气,使填料压实。其次是加样。在进行柱色谱操作时,被分离的样品用少许甲醇充分溶解,加入适量的粗硅胶充分吸附,在旋转蒸发器里于45℃的条件下蒸干,将样品均匀置于柱顶,尽量使样品带均匀平整,在样品面上塞入脱脂棉,以防加入洗脱剂时破坏样品带。第三是洗脱剂的选择。另外,薄层层析选择的展开剂作为硅胶柱层析动态洗脱时的洗脱剂,有可能不合适,试验过程中需要根据具体情况重新选择洗脱体系。作为展开剂的选择应尽可能从以3 方面考虑:毒性小,沸点适中,粘度小。最后,熟悉常用的洗脱体系方面的基础知识,如氯仿-甲醇体系,石油醚-丙酮体系等。
[1]金燕华,裘娟萍,何景昌,等.壮观链霉菌产生抗生素的多样性[J].中国医学工业杂志,2006,37 (12):849-854.
[2]奥格雷迪著,李继光主译.抗生素及化学药物治疗[M].沈阳:辽宁出版社,2002.
[3]夏云重.基因组重排与传统育种相结合选育大观霉素高产菌株[D].杭州.浙江工业大学,2009.
[4]张绪敏.抗菌素微生物效价测定法[M].北京:人民卫生出版社,1963.
