脂肪酶不对称水解兽药中间体对甲砜基苯丝氨酸乙酯的初步研究
2012-11-08范永仙陈小龙
郭 锐,范永仙,陈小龙
(浙江工业大学 发酵工程研究所,浙江 杭州 310014)
氟苯尼考是动物专用广谱抗生素,在畜牧业中常以饲料添加剂等方式广泛用于猪、牛、鱼类及禽类等动物细菌性疾病的预防和治疗,1999年我国批准氟苯尼考为国家二类新兽药,在水产养殖业中用于治疗鳗鲡爱德华氏病和赤磷病[1-4]。D-苏式-对甲砜基苯丝氨酸乙酯 (D-threo-p-MPSE)是合成氟苯尼考的重要中间体之一,而其对映异构体L-苏式-对甲砜基苯丝氨酸乙酯(L-threo-p-MPSE)的治疗活性非常差。目前获得D-threo-p-MPSE 的方法大多通过“对甲砜基苯丝氨酸途径”和“对甲砜基苯丝氨酸铜途径”[5-6]。相比化学法,通过酶法手性拆分获得该中间体具有高效、无污染,反应条件温和等优势。利用酶法途径获得D-threo-p-MPSE 在国内外尚无报道。但国外有为数不多的对于p-MPSE 结构类似物对甲硫基苯丝氨酸乙酯酶法拆分的报道[7-9]。
本研究确立了脂肪酶水解拆分DL-苏式-对甲砜基苯丝氨酸乙酯 (DL-threo-p-MPSE)的适合脂肪酶及反应体系,通过对反应条件的探索及优化,初步获得相对较优的拆分条件。现将有关结果报道如下。
1 材料与方法
1.1 仪器、供试脂肪酶及试剂
高效液相色谱仪,LC-20AT,岛津;恒温水浴摇床,THZ-82,常州溴化仪器有限公司。扩展青霉脂肪酶、酵母脂肪酶、黑曲脂肪酶、猪胰脂肪酶购于北京凯泰新世纪生物技术有限公司;lipozyme TL IM、Novzyme 435 脂肪酶 (Candida Antarctica lipase)购于Sigma Aldrich 公司;M1,5-1,5-2,5-3,7-5,11-1 脂肪酶冻干产物由本实验室筛选所得的脂肪酶菌株中制得。DL-threo-p-MPSE 由浙江康牧药业有限公司提供。其余试剂均为市售AR试剂。
1.2 脂肪酶水解反应体系
酶反应在50 mL 三角摇瓶中进行,初始反应体系为:9.5 mL 脱水有机溶剂+0.5 mL Tris-HCl 缓冲液 (20 mmol,pH 值7.5);25 mg DL-threo-p-MPES;25 mg 商品酶或75 mg 菌种筛选所得脂肪酶冻干产物。反应条件为:在恒温水浴摇床中30℃,140 r·min-1下反应120 h。
1.3 检测分析方法
手性柱:DAICEL CHIRALCEL OJ-3 (4.6 mm×250 mm,particle size 3 μm);流动相:正己烷-乙醇 (60 ∶ 40,V/V,0.5%二乙胺);流速:1.0 mL·min-1;检测波长:226 nm。进样样品处理:从反应体系中取100 μL 反应混合液,将反应混合液蒸干,加入甲醇-正丙醇 (1∶1,V/V)混合溶液1 mL,即将原样品稀释10 倍。
脂肪酶不对称水解拆分DL-threo-p-MPSE 将不需要的L-构型底物水解成对L-苏式-甲砜基苯丝氨酸从而得到未被水解的对映体纯的 D-threo-p-MPSE。
底物转化率C 为反应后底物的剩余量与反应前底物总量之比;底物对映体过量百分数 (e.e.s)用于考察外消旋底物拆分情况,由公式e.e.s/%=[([D]-[L])/ ([D]+[L])]×100 来计算,其中[D],[L]分别表示D-threo-p-MPES 与L-threo-p-MPES 由色谱峰面积计算而得的在反应体系中的浓度;E 值表示一种酶针对一种底物的对映体选择性情况,由公式E=ln [(1-C) (1-e.e.s)]/ ln [(1-C)(1+e.e.s)]来计算,其中C 表示底物的转化率。
2 结果与分析
2.1 反应体系的选择
threo-p-MPES 能在水中地自发水解且发生系列副反应 (包括retro-aldol 反应)、形成系列副产物(其中主副产物为对甲砜基苯甲醛),因此采用有机溶剂微水相体系。根据threo-p-MPES 的溶解情况,选择对其有相应溶解性的有机溶剂,在反应120 h 后,除了在叔丁醇体系中不同脂肪酶能够不同程度地催化threo-p-MPES 水解外,在其他有机溶剂中,各脂肪酶均未能表现出催化threo-p-MPES 酶活性。因此,叔丁醇被作为最佳的微水反应介质进行脂肪酶不对称水解threo-p-MPES 的研究。
2.2 脂肪酶的确定
对于现有脂肪酶的考察发现,Novzyme 435 表现出了最好的催化及拆分效果,反应72 h 后,转化率为35.95%,e.e.s 及E 值分别为35.13% 及6.08。在青霉脂肪酶催化体系中,几乎大部分DLthreo-p-MPES 被用于生成副产物赤式对甲砜基苯丝氨酸乙酯以及对甲砜基苯甲醛,这很可能因为青霉更倾向于扮演催化threo-p-MPES 发生retro-aldol 反应的角色。其余脂肪酶未能表现出酶活或者拆分效果不佳。选用Novzyme 435 作为threo-p-MPES 不对称水解的最佳酶源。
2.3 e.e.s 随时间的变化
如图1 所示,e.e.s 随着反应的进行不断上升,当反应进行144 h 时,转化率达到58.58% 时,e.e.s 为70.08%,说明Novzyme 435 可同时水解D与L 2种构型对映异构体,且优先水解L-threo-p-MPSE。当转化率过半时,Novzyme 435 对于DLthreo-p-MPSE 的手性拆分效果未达到理想e.e.s 达90%以上。综合考虑转化率及e.e.s,将144 h 作为最合适的酶反应时间进行后续研究。
2.4 底物浓度的影响
通过在单位体积酶反应体系中添加不同浓度的DL-threo-p-MPSE 来考察底物浓度对于反应的影响。如于2.5 mg·mL-1时,转化率及e.e.s 开始随着浓度的增加而显著减少 (图2)。其原因:存在一定程度的底物抑制情况;当底物浓度达到3.5 mg·mL-1时,底物的溶解性开始下降,有一定的底物从体系析出,从而对转化率产生了一定的影响。E值在整个过程中不断地下降,说明底物浓度越低,酶的对映体选择性越高。在底物浓度为2.5 mg·mL-1时,底物的转化率、e.e.s 均达到了最高,且此浓度对酶的对映体选择性影响甚微,2.5 mg·mL-1为反应的最适底物浓度。
2.5 扩散效应的影响
2.5.1 内扩散
内扩散可通过固定化酶的加量来考察,若酶的浓度远远小于体系中底物浓度所对应的理论饱和酶浓度时,底物转化率便随着酶浓度的增加而增加;加大的酶量可以分担部分内扩散阻力,从而加快酶反应速率。如图3所示,在加酶量小于2.0 mg ·mL-1时,转化率随着酶量的增加而显著增加,此时从图3 中可以看出存在轻微的内扩散限制。当酶加量>2.0 mg ·mL-1时,随着酶加量的增加,转化率增幅明显放缓。因此,2.0 mg ·mL-1为相对于2.5 mg ·mL-1最佳底物浓度的饱和酶浓度。若继续添加酶量仍可适量地促进转换率与e.e.s,其部分原因是消除了固定化酶内扩散限制。由于Novzyme 435 固定化酶价格昂贵,出于能效比及节省考虑,将2.0 mg·mL-1作为最适酶浓度。

图2 脂肪酶不对称水解拆分DL-threo-p-MPSE底物浓度对转化率、e.e.s 及E 值的影响

图3 脂肪酶不对称水解拆分DL-threo-p-MPSE酶添加量对转化率的影响
2.5.2 外扩散
外扩散因素可通过改变摇床转速来研究。如图4 所示,当转速达到160 r·min-1时,转化率和e.e.s 达到了最大值,若再提高转速,对于转化率无太大的改善,说明当转速在160 r·min-1时,外扩散不再是限速因素。
2.6 微水有机溶剂水含量的影响
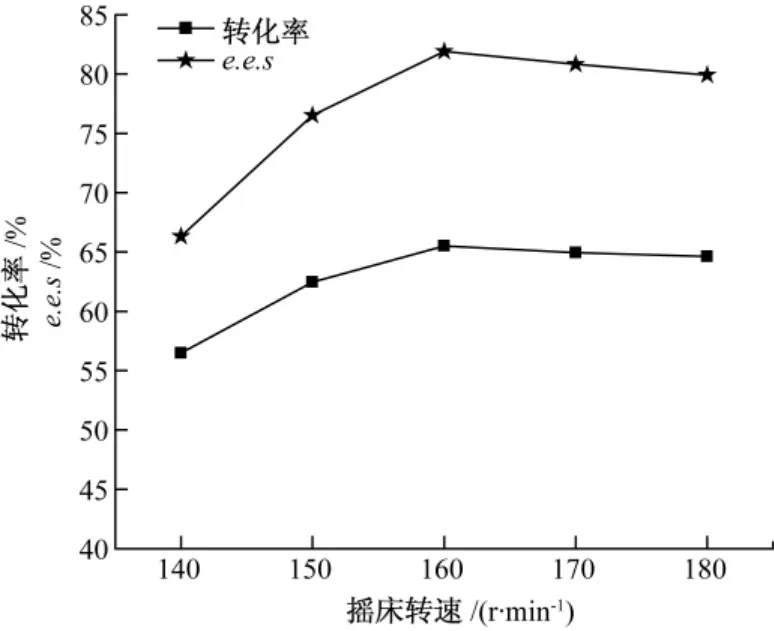
图4 脂肪酶不对称水解拆分DL-threo-p-MPSE摇床转速对转化率的影响
水含量是通过水活度来影响酶反应的。在有机溶剂中,结合于酶分子表面的水层能够维持酶发挥活性所必须的催化活性构象,适合的水含量能够维持酶分子的刚性及热力学稳定性,从而使酶处于较高的活性与对映体选择性。如表1 所示,当含水量从5.0%降低至0.2%,E 值呈明显的上升趋势。当含水量继续下降时,E 值增加不再明显,说明0.2%的含水量已能够满足维持酶刚性结构所必须的表面层水含量。0.2% 为Novzyme 435 在叔丁醇体系中催化DL-threo-p-MPSE 不对称水解的最佳含水量。在此含水量下,底物转化率比5.0%的含水量时要低17% 左右,需在反应时间上作弥补,将最佳反应时间变为192 h。在经历192 h 反应后,在0.2%含水量叔丁醇体系中,底物转化率达到了64.52%,e.e.s 达到了86.28%.
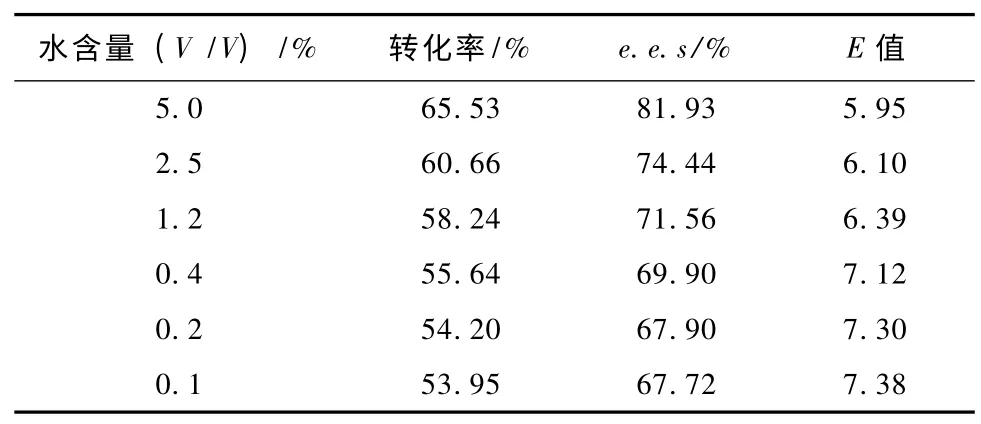
表1 微水体系中水含量对转化率、e.e.s 及E 值的影响
2.7 水相pH 值的影响
pH 值因素通过酶分子表面水层微环境改变酶的构象从而影响酶的各类活性。如图5 所示,当pH 值达到8.0 时,E 值相对达到最大,此时底物e.e.s 达92.54%。
2.8 温度的影响
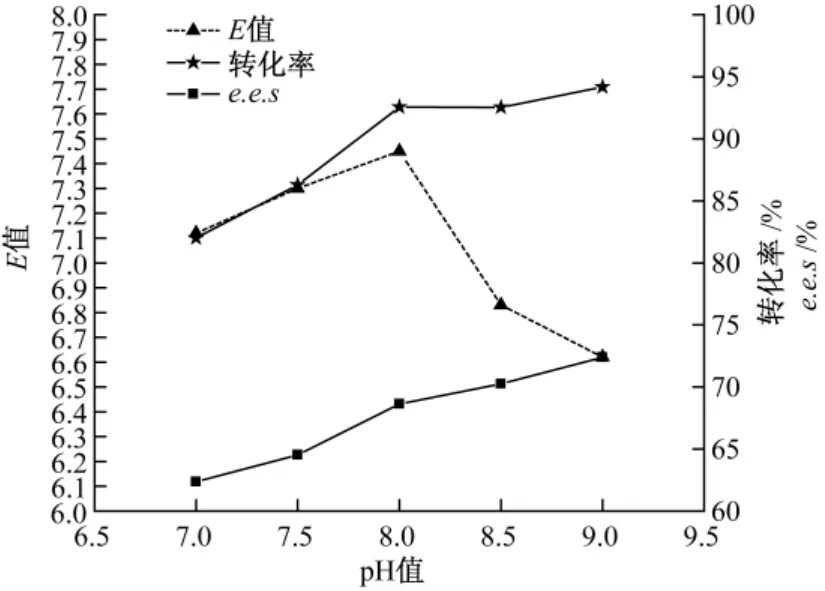
图5 脂肪酶不对称水解拆分DL-threo-p-MPSE pH 值对转化率、e.e.s 及E 值的影响
如图6 所示,温度对于Novzyme 435 不对称水解DL-threo-p-MPSE 的影响非常大。当温度升高至37℃时,E 值从7.45 陡然下降到了3.37;底物e.e.s 也随着温度的升高下降明显。e.e.s 下降的主要原因有:高温促使酶刚性结构下降,对映体选择性也随之下降;当处于37℃以上的温度时,在脂肪酶水解环境下,底物会处于不稳定状态,α-C 与β-C 之间的碳碳键容易断裂,大量底物被用于生成副产物对甲砜基苯甲醛而非p-MPS。后者是造成Novzyme 435 E 值下降的主要原因。因此,从酶的对映体选择性及防止副反应的角度出发,最佳酶反应温度宜为30℃。

图6 脂肪酶不对称水解拆分DL-threo-p-MPSE温度对转化率、e.e.s 及E 值的影响
2.9 Zn2+对转化率及对映体选择性的影响
我们发现Zn2+在Novzyme 435-叔丁醇催化反应体系中能够有效抑制底物系列副反应的发生。如图7 所示,Zn2+的加入可以大幅度地提高底物的转化率,但Novzyme 435 对于DL-threo-p-MPES 的对映体选择性大幅下降。对于对映体选择性下降的原因,有如下2种推测:Zn2+能够降低酶的刚性结构,从而促进酶的非选择性水解;在Zn2+体系反应至48 h 后,体系中产生了大量的白色p-MPS 络合沉淀,说明体系中溶解在溶剂中的产物p-MPS的浓度维持在了一个非常低的水平,一方面酶的不对称水解增加,另一方面,底物自身在微水叔丁醇有机溶剂中同样发生了非酶、纯化学水解,从而造成了Novzyme 435 E 值大幅度下降的表观现象。

图7 脂肪酶不对称水解拆分DL-threo-p-MPSE Zn2+对转化率及对映体选择性的影响
3 小结与讨论
因DL-threo-p-MPES 的一些化学性质如溶解性及底物本身的不稳定性,其可选用的酶催化体系范围比较窄,叔丁醇为其最佳催化体系。现有的许多商品脂肪酶对对甲砜基苯丝氨酸乙酯的催化效果也不甚理想,其中效果相对较好的脂肪酶为Novzyme 435。以Novzyme 435 脂肪酶为基础,通过对不同因素的考察,确定了最优反应条件:9.98 mL 脱水叔丁醇+20 μL Tris-HCl 缓冲液 (20 mmol,pH 值8.0);25 mg DL-threo-p-MPSE;20 mg Novzyme 435;160 r·min-1。在反应192 h 后,DL-threo-p-MPSE 的底物对映体过量百分数由最初试验的35.13%上升到92.54%,所对应的底物转化率为68.62%。然而,不足之处为反应的时间过长及一定量的D-threo-p-MPSE 的损失,势必会影响反应效率。在后续的研究过程中,研究重点可以放在,在不影响酶的对映体选择性及不增加副反应程度的前提下,探索添加不同类别的化学物质以发掘出酶对于该兽药中间体的潜在催化效能上。
[1]Patel R N.Enzymatic synthesis of chiral intermediates for drug development [J].Adv Synth Catal,2001,343 (6):527-546.
[2]Switala M,Debowy J.Pharmacodynamic properties and pharmacokinetics of thiamphenicol and florfenicol as antimicrobial antibiotics for animals [J].Med Weter 2005,61 (11):1238-1241.
[3]Zhao H Y,Zhang G H,Bai L,et al.Pharmacokinetics of florfenicol in crucian carp (Carassius auratus cuvieri)after a single intramuscular or oral administration [J].J Vet Pharmacol Ther,2011,34 (5):460-463.
[4]潘红艳,宫智勇.氟苯尼考的研究进展及临床应用[J].湖北农业科学,2011,50 (2):229-232.
[5]Gregory W.Separation of phenyl-serines:USA,2816915[P].1957-12-17.
[6]Tobiki H,Okamoto,Akiyama T H.Process for producing βphenylserine copper complex:U S A,3927054 [P].1975-12-16.
[7]Liu J Q,Odani M.A new route to L-threo-3-[4-(methylthio)phenylserine],a key intermediate for the synthesis of antibiotics:recombinant low-specificity D-threonine aldolasecatalyzed stereospecific resolution[J].Appl Microbiol Biotechnol,1999,51 (5):586-591.
[8]Kaptein B,van Dooren T J,Boesten W H J.Synthesis of 4-sulfur-substituted (2S,3R)-3-phenylserines by enzymatic resolution.Enantiopure precursors for thiamphenicol and florfenicol [J].Org Process Res Dev,1998,2 (1):10-17.
[9]Clark J E,Fischer P A.An Enzymatic Route to Florfenicol[J].Synihesis,1991,10:891-894.
