藏羚羊和藏绵羊小肠黏膜结构和黏膜免疫相关细胞的比较*
2012-11-06张鹏飞陈付菊格日力
常 兰, 张鹏飞, 陈付菊, 格日力
(1青海大学农牧学院,青海 西宁 810016; 2青海大学医学院高原医学研究中心,青海 西宁 810001)
1000-4718(2012)09-1658-07
2011-11-29
2012-06-29
国家973计划项目(No.2012CB518200);国家自然科学基金资助项目(No. 31161861);青海省重点科技攻关项目(No.2003-N-120);教育部春晖计划项目(No.Z2010062)
△通讯作者 Tel 0971-6142063; Email:gerili@hotmail.com
藏羚羊和藏绵羊小肠黏膜结构和黏膜免疫相关细胞的比较*
常 兰1, 张鹏飞1, 陈付菊1, 格日力2△
(1青海大学农牧学院,青海 西宁 810016;2青海大学医学院高原医学研究中心,青海 西宁 810001)
目的比较藏羚羊和藏绵羊小肠黏膜结构和黏膜免疫相关细胞的特征。方法采用组织学、组织化学方法和图像分析法在光镜和电镜水平对5只藏羚羊和5只藏绵羊小肠不同肠段的黏膜结构进行观测,并对上皮内淋巴细胞、杯状细胞和肥大细胞的数量进行统计分析。结果藏羚羊小肠各段绒毛长度和绒毛长度与隐窝深度比值(villus length/crypt depth,V/C)均显著高于藏绵羊(P<0.05),其中藏羚羊十二指肠、空肠和回肠的绒毛长度分别比藏绵羊高77.25%(P<0.05)、63.61%(P<0.05)和35.38%(P<0.05),而V/C值分别比藏绵羊高65.63%(P<0.05)、20.08%(P<0.05)和35.68%(P<0.05),藏羚羊小肠黏膜的厚度显著大于藏绵羊(P<0.05),而藏羚羊和藏绵羊小肠肌层厚度差异不显著(P>0.05);藏羚羊小肠各段上皮内杯状细胞和肥大细胞数量显著多于藏绵羊(P<0.05),其中藏羚羊十二指肠、空肠和回肠中的上皮内杯状细胞数量分别比藏绵羊的多12.84%(P<0.05)、49.88%(P<0.05)和5.58%(P>0.05),藏羚羊十二指肠、空肠和回肠中的肥大细胞的数量比藏绵羊的分别多0.22%(P>0.05)、6.04%(P>0.05)和160.80%(P<0.05),而藏羚羊小肠各段上皮内淋巴细胞数量显著低于藏绵羊(P<0.05),其中藏羚羊十二指肠、空肠和回肠的上皮内淋巴细胞数量分别比藏绵羊的少35.04%(P<0.05)、52.85%(P<0.05)和52.82%(P<0.05)。结论藏羚羊小肠消化吸收功能强于藏绵羊,藏羚羊的小肠黏膜免疫屏障功能也强于藏绵羊,且在藏羚羊小肠杯状细胞和肥大细胞起重要的黏膜防御功能,而在藏绵羊小肠中上皮内淋巴细胞起重要的黏膜免疫屏障功能。
藏羚羊; 藏绵羊; 小肠; 黏膜结构; 黏膜免疫相关细胞
藏羚羊(Pantholopshodgsonii) 为青藏高原特有物种, 也是世界上最为珍稀的物种之一,主要栖息于海拔3 500~5 500 m的高寒低氧地区, 现已被列入《濒危野生动植物种国际贸易公约》和国家一级保护动物。藏羚羊种群是构成青藏高原特有自然生态系统中极为重要的组成部分。在长期的适应与进化过程中,藏羚羊在呼吸、心血管、内分泌及基因等多方面形成了独特的适应高寒低氧环境的机制[1-3]。而在消化功能方面,曹俊虎等[4]对藏羚羊冷季干物质的消化效率研究发现,在严酷的生活环境下对牧草干物质的消化率较高。那么,藏羚羊在高寒低氧、食物匮乏的环境中能够生存并且对细菌、病毒、寄生虫等疾病表现出强的抵抗能力,其消化系统尤其是小肠有何特征?为此,本研究运用组织学、组织化学方法和图像分析法在光镜和电镜水平对生活在同一海拔地区的藏羚羊和藏绵羊小肠黏膜结构和黏膜免疫相关细胞进行了比较研究。
材 料 和 方 法
1动物和样品的处理
经国家林业局批准(林护许准[2009]46号),于2009年4月在青海省可可西里国家级自然保护区(海拔4 300 m)捕捉雄性藏羚羊和藏绵羊各5只(据齿龄所捕获藏羚羊和藏绵羊的年龄均在2~3岁左右),颈总动脉放血处死,迅速取十二指肠、空肠和回肠中段各2 cm左右快速分别置入4%多聚甲醛磷酸缓冲液(0.1 mol/L,pH 7.4)、Carnoy固定液,摇匀,固定48 h,运回西宁。按常规石蜡切片包埋,制作横断面切片,厚3 μm,每隔10张取1张,进行HE染色、高碘酸-Schiff(periodic acid-Schiff,PAS)染色和改良甲苯胺蓝(modified toluidine blue,MTB)染色。
藏羚羊和藏绵羊十二指肠、空肠和回肠中段经2.5%戊二醛固定后送往兰州大学医学部进行扫描电镜制样。
2检测指标和方法
经HE染色后,光镜下观察藏羚羊和藏绵羊小肠壁的结构。每只羊各段小肠取5张切片,每张切片选5个视野,数码拍照,应用Scion Image图像处理软件在每张照片中测量5根最长的绒毛长度(以肠腺绒毛连接处到绒毛顶端为准)、最深的隐窝深度(以肠腺绒毛连接处到肠腺基部为准)和最厚的黏膜厚度以及肌层厚度。
光镜下观察上皮内淋巴细胞、杯状细胞及肥大细胞的形态分布。每只羊各段小肠取5张切片,每张切片中选取5根柱状细胞排列整齐且最长的肠绒毛,统计每100个柱状细胞中分布的上皮内淋巴细胞和杯状细胞数量。肥大细胞的计数是每只动物各段小肠分别统计5张切片横断面全层的肥大细胞数,并用Moditec照相处理软件,计算单位面积内的肥大细胞数。
扫描电镜下观察藏羚羊和藏绵羊小肠绒毛的形态结构。
3统计学处理
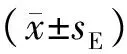
结 果
1藏羚羊和藏绵羊小肠黏膜形态结构的观测
1.1藏羚羊和藏绵羊小肠黏膜形态结构的观察 光镜下观察,小肠从内到外分为黏膜、黏膜下层、肌层和浆膜,藏羚羊小肠黏膜厚,绒毛细而高,见图1A;藏绵羊小肠黏膜明显薄,绒毛短而宽,呈指状,见图1B。扫描电镜结果显示,藏羚羊十二指肠绒毛呈薄片状,排列密集,肠绒毛表面隆突较多,见图2A、C,空肠绒毛呈板状、指状,回肠绒毛呈指状;藏绵羊十二指肠绒毛呈板状,排列也密集,肠绒毛表面隆突相对较少,见图2B、D,空肠和回肠绒毛均呈指状。

Figure 1. The mucosal structure of duodenum in Tibetan antelopes (A) and Tibetan sheep (B)(HE staining, ×100).☆:villus;★: intestinal gland.
图1藏羚羊和藏绵羊十二指肠黏膜结构
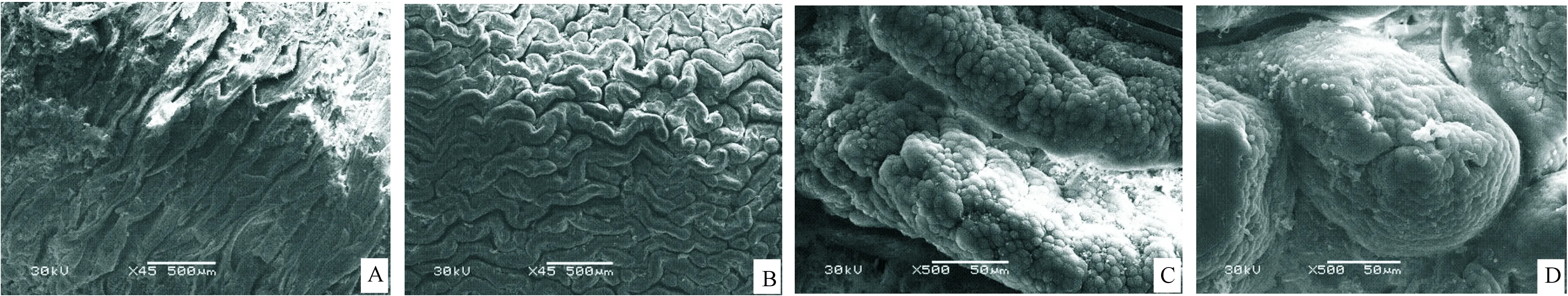
Figure 2. The villus ultrastructure scanning electron images of duodenum in Tibetan antelopes(A,C) and Tibetan sheep (B,D).
图2藏羚羊和藏绵羊十二指肠绒毛扫描电镜图
1.2藏羚羊和藏绵羊小肠绒毛长度 由表1可以看出,藏羚羊小肠各段肠管绒毛长度显著长于藏绵羊(P<0.05),其中十二指肠、空肠和回肠的绒毛比藏绵羊的长77.25%(P<0.05)、63.61%(P<0.05)和35.38%(P<0.05);比较同种动物小肠不同肠段,藏羚羊以十二指肠最高,回肠次之,空肠最低。其中藏羚羊十二指肠绒毛比空肠和回肠的分别高69.31%(P<0.05)和61.12% (P<0.05),而空肠与回肠间差异不显著(P>0.05);藏绵羊十二指肠绒毛比空肠和回肠的分别高56.30%(P<0.05)和23.06% (P<0.05),回肠比空肠的高27.01%(P<0.05)。

表1 藏羚羊和藏绵羊小肠绒毛的长度
*P<0.05vsTibetan sheep;△P<0.05vsileum;▲P<0.05vsjejunum.
1.3藏羚羊和藏绵羊小肠绒毛长度与隐窝深度比值(V/C值) 从表2可知,藏羚羊小肠各肠段V/C值均显著高于藏绵羊(P<0.05)。其中藏羚羊十二指肠、空肠和回肠的V/C值分别比藏绵羊的高65.63%(P<0.05)、20.08%(P<0.05)和35.68%(P<0.05);比较同种动物小肠不同肠段, 藏羚羊和藏绵羊的V/C值差异均显著(P<0.05),其中藏羚羊的V/C值以十二指肠最大,空肠次之,回肠最小;而藏绵羊的V/C值以空肠的最大,十二指肠次之,回肠也是最小。

表2 藏羚羊和藏绵羊小肠绒毛长度与隐窝深度比值
*P<0.05vsTibetan sheep;△P<0.05vsileum;▲P<0.05vsjejunum.
1.4藏羚羊和藏绵羊小肠黏膜厚度 从表3看出,藏羚羊小肠黏膜的厚度显著大于藏绵羊(P<0.05)。其中藏羚羊十二指肠、空肠和回肠黏膜分别比藏绵羊的厚44.45% (P<0.05)、 9.74%(P<0.05)和15.96%(P<0.05);比较同种动物小肠不同肠段的黏膜厚度,藏羚羊和藏绵羊均以十二指肠最厚,空肠次之,回肠最薄。其中藏羚羊十二指肠黏膜显著厚于空肠和回肠(P<0.05),但空肠和回肠之间差异不显著(P>0.05);藏绵羊十二指肠和空肠黏膜厚度均显著厚于回肠(P<0.05),但十二指肠和空肠之间差异不显著(P>0.05)。

表3 藏羚羊和藏绵羊小肠黏膜厚度
*P<0.05vsTibetan sheep;△P<0.05vsileum;▲P<0.05vsjejunum.
1.5藏羚羊和藏绵羊小肠肌层厚度 从表4看出,藏羚羊和藏绵羊小肠肌层厚度差异不显著(P>0.05),其中藏羚羊十二指肠和回肠的肌层分别比藏绵羊的薄16.30%(P<0.05)和12.80%(P<0.05),而空肠比藏绵羊的厚4.35%(P>0.05);比较同种动物小肠不同肠段的肌层厚度,藏羚羊以空肠最厚,十二指肠次之;藏绵羊以十二指肠最厚,空肠次之。

表4 藏羚羊和藏绵羊小肠肌层厚度
*P<0.05vsTibetan sheep;△P<0.05vsileum;▲P<0.05vsjejunum
2藏羚羊和藏绵羊小肠黏膜免疫相关细胞的研究
2.1小肠黏膜免疫相关细胞的形态观察 经HE染色后,在光镜下观察, 上皮内淋巴细胞散在分布于肠绒毛柱状上皮细胞之间,细胞核大而圆,深染,胞浆较少,在小肠各段均有分布,见图3A、B;杯状细胞经PAS染色后呈红色,呈高脚杯状,散布于柱状细胞之间。藏羚羊的杯状细胞较多,顶部胞质由大量糖原颗粒充满,藏绵羊杯状细胞纤细,并且数量较少,见图3C、D;肥大细胞经甲苯胺蓝染色后,呈紫红色, 形态有圆形、椭圆形、梭形和不规则形,藏羚羊和藏绵羊的十二指肠和空肠肥大细胞分布在肠绒毛、肠腺之间的固有膜和肌层,并且在肠腺之间的固有层中相对较多,平滑肌层也有零星分布,而在浆膜极少见,藏羚羊的回肠肥大细胞则密集分布于固有层, 平滑肌层中也较多,藏绵羊的回肠肥大细胞散布于肠绒毛、肠腺之间的固有膜、肌层,数量较少,见图3E、F。
2.2小肠上皮内淋巴细胞的数量 由表5可知,藏羚羊小肠上皮内淋巴细胞数量显著低于藏绵羊(P<0.05),其中藏羚羊十二指肠、空肠和回肠上皮内淋巴细胞数量分别比藏绵羊的少35.04%(P<0.05)、52.85%(P<0.05)和52.82%(P<0.05);比较同种动物小肠不同肠段,藏羚羊和藏绵羊上皮内淋巴细胞的数量均以回肠数量最多,空肠次之,十二指肠最少,其中藏羚羊回肠上皮内淋巴细胞数量比十二指肠和空肠分别多87.21%(P<0.05)和28.51%(P<0.05)。藏绵羊回肠上皮内淋巴细胞数量比十二指肠和空肠分别多157.75%(P<0.05)和 28.41%(P<0.05)。
2.3小肠杯状细胞的数量 从表6可以看出,藏羚羊小肠内杯状细胞数量显著多于藏绵羊(P<0.05)。其中十二指肠、空肠和回肠中的杯状细胞数量分别比藏绵羊的多12.84%(P<0.05)、49.88%(P<0.05)和5.58%(P>0.05);比较小肠不同肠段的杯状细胞数量,藏羚羊在空肠最多,分别比十二指肠、回肠多16.20%(P<0.05)和35.39 %(P<0.05),十二指肠与回肠之间差异显著;而藏绵羊则以十二指肠为最多,分别比空肠和回肠段多14.30%(P<0.05)和9.02 %(P<0.05),但空肠与回肠之间差异不显著。
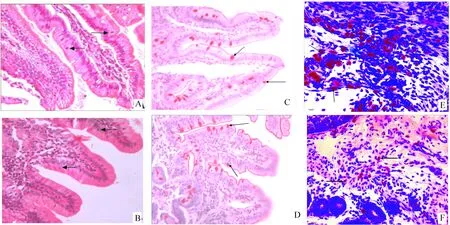
Figure 3. The intraepithelial lymphocytes, goblet cells and mast cells in duodenum of Tibetan antelopes and Tibetan sheep (×400). A,B:intraepithelial lymphocytes (HE staining, arrows); C,D: goblet cells (PAS staining,arrows); E, F: mast cells(MTB staining, arrows); A,C,E: Tibetan antelopes; B,D,F: Tibetan sheep.
图3藏羚羊和藏绵羊十二指肠上皮内淋巴细胞、杯状细胞和回肠肥大细胞
表5藏羚羊和藏绵羊小肠上皮内淋巴细胞的数量


GroupSmallintestineDuodenumJejunumIleumTibetanantelope19.52±0.61∗13.53±0.50∗△▲19.71±0.92∗△25.33±1.15∗Tibetansheep38.78±1.1220.83±0.85△▲41.81±1.11△53.69±1.39
*P<0.05vsTibetan sheep;△P<0.05vsileum;▲P<0.05vsjejunum.

表6 藏羚羊和藏绵羊小肠内杯状细胞的数量
*P<0.05vsTibetan sheep;△P<0.05vsileum;▲P<0.05vsjejunum.
2.4小肠肥大细胞的数量 由表7可知,藏羚羊小肠肥大细胞数量显著多于藏绵羊(P<0.05)。其中藏羚羊的十二指肠和空肠肥大细胞数量比藏绵羊的分别多0.22%(P>0.05)和6.04%(P>0.05),藏羚羊的回肠肥大细胞数量比藏绵羊的多160.79% (P<0.05);比较同种动物小肠各肠段的肥大细胞数量,藏羚羊和藏绵羊的差异均显著(P<0.05)。其中藏羚羊以回肠为最多,十二指肠次之;藏绵羊小肠从前向后肥大细胞数量逐渐减少。

表7 藏羚羊和藏绵羊小肠肥大细胞的数量
*P<0.05vsTibetan sheep;△P<0.05vsIleum;▲P<0.05vsjejunum.
讨 论
小肠的正常组织结构是营养物质被充分消化和吸收的基本结构保证,尤其是小肠的绒毛长度、绒毛表面积、隐窝深度、V/C值、黏膜厚度及肌层厚度是衡量小肠消化吸收功能的重要指标。小肠绒毛长度、粗细以及黏膜厚度的增加可直接使小肠表面积扩大,有利于营养物质的吸收,同时小肠黏膜表面积扩大也有利于消化酶等物质的分泌进入肠道,益于对摄入物质的消化[5-6]。肠隐窝(肠腺)是绒毛基部上皮下陷至固有膜内形成的管状结构,其开口在相邻的肠绒毛之间,可分泌含有多种消化酶的小肠液,对各种营养成分最终分解为可吸收的产物发挥重要作用,而且大量的小肠液可以稀释消化产物使其渗透压下降,更有利于吸收[7]。V/C值综合反映小肠的功能状况,比值较低,消化吸收功能就较低,比值较高,消化吸收功能较强。
藏羚羊主要栖息于海拔4 000 m以上的高原低氧环境中,具有耐高寒、抗缺氧、对食物的要求单一。例如在长达7个月左右的牧草枯草期,尤其冬季草原经常被大雪覆盖,导致藏羚羊所能获取的食物极为有限,但其生存能力极强,其原因可能与它的消化能力有关。据曹俊虎等[4]对藏羚羊冷季干物质的消化效率研究表明,藏羚羊在枯草期对禾本科牧草上部(含种子)、禾本科茎杆及禾本科牧草、混合牧草干物质的消化率分别为72.56%、65.60%和70.86%,发现藏羚羊冬季对牧草的消化率比野生藏绵羊、高山草原放牧绵羊、公山羊、哺乳期的母山羊以及高山山羊等反刍动物的干物质的消化率(40%~64%)高, 虽然部分动物干物质消化率的数据取自夏季生长牧场, 但所测得消化率值依然显著低于所测藏羚羊对干物质的消化率。这表明在严酷的生活环境下,藏羚羊通过对牧草干物质较高的消化率为其生存提供了一定的条件。本研究结果表明藏羚羊肠绒毛细而高,尤其十二指肠绒毛呈薄片状,排列密集,绒毛表面隆突较多,而藏绵羊肠绒毛宽而低,其十二指肠绒毛呈板状,肠绒毛表面隆突相对较藏羚羊的少,藏羚羊黏膜厚度也显著大于藏绵羊,说明藏羚羊肠黏膜与肠内容物的接触面积比藏绵羊的大,有利于更好地吸收;藏羚羊小肠的V/C值显著高于藏绵羊,说明藏羚羊小肠的消化吸收功能比藏绵羊的强,这为揭示藏羚羊小肠在食物极为有限的生境中对高海拔低氧环境的适应提供部分形态学依据。
肠道不仅是动物体内最大的消化吸收器官同时也是最大的免疫器官,肠黏膜是机体抵抗外源物质及微生物的重要免疫屏障[8]。肠道免疫学屏障主要由肠相关淋巴组织和肠道相关黏膜免疫细胞共同构成,后者包括淋巴细胞、肥大细胞和杯状细胞等。肠道中有2种不同表型的淋巴细胞存在,即分散在上皮细胞层中的肠上皮内淋巴细胞(intestinal intraepithelial lymphocyte,IEL)和位于疏松结缔组织中的固有膜淋巴细胞,IEL作为肠道相关淋巴组织中的一个特殊组分,是机体免疫系统中与外来抗原以及微生物最先接触的免疫细胞,同时也是最先发生免疫反应的细胞, IEL识别上皮细胞是否受细菌、病毒的感染, 并分泌细胞因子以发挥抗细菌、抗病毒、抗感染的作用,分散在上皮内的淋巴细胞越多,防御病原微生物入侵的能力就越强[9]。通过消化道接种微生物,可使分散在上皮内的淋巴细胞增多,黏膜免疫能力增强,从而反证了分散在上皮内的淋巴细胞数量的变化与微生物之间的关系。本研究结果显示藏羚羊小肠上皮内淋巴细胞数量显著低于藏绵羊,推测可能是藏羚羊所采食物纯天然,常年受太阳强辐射、干燥、寒冷的直接影响,尤其是藏羚羊活动范围很广,完全自由式采食,在同一草场重复采食的几率较低,相应的其所采食区域污染较少,这样所采食物中病原微生物种类数量可能较少或病原微生物的致病能力可能不强,而生活在同一海拔的藏绵羊一般白天放牧,且在固定草场轮牧,而夜间归圈,草场被粪便、尿液等污染的机会大,小肠黏膜受抗原刺激的可能性较大,这样藏羚羊小肠少量的上皮内淋巴细胞能够完全满足执行相应的免疫功能的需要。
杯状细胞是一种典型的糖蛋白分泌细胞,其分泌的黏蛋白释入管腔内成为润滑性黏液涂布于上皮表面,在一定程度上通过黏附阻挡病原生物和有害物质的正面破坏,阻止毒素与上皮细胞接触,对上皮具有保护作用[10]。小肠上皮内杯状细胞在抗感染、调节上皮细胞的完整性和外来抗原的免疫应答等方面起重要作用,其数量的变化可以在一定程度上反映消化道的局部免疫状况[11]。本研究结果显示藏羚羊小肠杯状细胞数量显著高于藏绵羊,藏羚羊小肠上皮内较多的杯状细胞能够使藏羚羊小肠黏膜得到更好的保护,这也为藏羚羊小肠适应高原食物极度匮乏的生境提供了一定的形态学依据。
肥大细胞是天然免疫的效应细胞之一,又是能分泌多种介质的重要免疫细胞,肠道中的肥大细胞对肠道疾病有一定的防御作用,肠道黏膜上皮首先对入侵的细菌发生反应,从而激活邻近的肥大细胞产生放大效应[12],本研究结果显示,藏羚羊小肠肥大细胞数量显著多于藏绵羊,提示肥大细胞在藏羚羊小肠黏膜免疫中发挥着重要作用,而且藏羚羊小肠肥大细胞以回肠为最多,并且明显多于藏绵羊回肠肥大细胞,可能藏羚羊回肠在小肠黏膜免疫中占据主导位置。小肠黏膜除含有大量的肥大细胞外还含有较多的神经末梢和神经内分泌细胞,所以小肠黏膜被认为是一个研究神经内分泌免疫调节的理想器官,研究还发现肠道黏膜及黏膜下层的部分肥大细胞与神经有着密切关系,这为免疫系统和内分泌系统之间的相互作用提供了部分形态学依据[13],至于藏羚羊小肠肥大细胞是否也与神经有关系将有待于进一步研究。
我们认为,藏羚羊的小肠消化、吸收功能和黏膜免疫屏障功能比藏绵羊强,说明藏羚羊对高原环境的适应能力强于藏绵羊。
[1] Xu SQ, Yang YZ, Zhou J, et al. A mitochondrial genome sequence of the Tibetan antelope (Pantholopshodgsonii) [J]. Genomics Proteomics Bioinformatics, 2005, 3(1):5-17.
[2] 张雪峰, 杨应忠, 裴志伟, 等. 藏羚羊和藏系绵羊血液内分泌激素水平的比较研究[J]. 生理学报,2011,63(4):342-346.
[3] 常 荣,杨应忠,马祁生,等. 藏羚羊和藏系绵羊左心室收缩功能的比较研究[J].中国病理生理杂志, 2010,26(8):1498-1502.
[4] 曹俊虎, 徐世晓, 赵新全, 等. 藏羚羊冷季对干物质的消化效率[J].兽类学报,2007,27(2):206-208.
[5] 韩正康. 家畜营养生理学[M]. 北京: 农业出版社, 1991:6-17.
[6] Murakami AE, Sakamoto MI, Natali MR, et al. Supplementation of glutamine and vitamin E on the morphometry of the intestinal mucosa in broiler chickens[J]. Poult Sci,2007,86(3):488-495.
[7] Reynolds JV. Gut barrier function in the surgical patients[J]. Br J Surg, 1996, 83(12):1668-1669.
[8] Kasper LH, Buzoni-Gatel D. Ups and downs of mucosal cellular immunity against protozoan parasites [J]. Infect Immun,2001,69(1):1-8.
[9] Johnson CD, Kudsk KA. Nutrition and intestinal mucosal immunity[J]. Clin Nutr,1999,18(6):337-344.
[10] Forder EA, Howarth GS, Tivey DR, et al. Bacterial modulation of small intestinal goblet cells and mucin composition during early posthatch development of poultry [J]. Poult Sci, 2007, 86(11): 2396-2403.
[11] GaskinsHR. The intestinal immune system: gut reaction and growth of the pig [J]. J Animal Sci, 1996, 74(Suppl 1): 169.
[12] Stenton GR, Vliagoftis H, Befus AD. Role of intestinal mast cells in modulating gastrointestinal pathophysiology[J]. Ann Allergy Asthma Immunol,1998, 81(1): 1-12,15.
[13] Ottaway CA. Neuroimmunomodulation in the intestinal mucosa[J]. Gastroenterol Clin North Am,1991, 20(3):511-529.
Comparisonofsmallintestinalmucosalstructureandmucosalimmunity-associatedcellsbetweenTibetanantelopesandTibetansheep
CHANG Lan1, ZHANG Peng-fei1, CHEN Fu-ju1, GE Ri-li2
(1CollegeofAgricultureandAnimalHusbandry,QinghaiUniversity,Xining810016,China;2ResearchCenterforHighAltitudeMedicalScience,MedicalSchool,QinghaiUniversity,Xining810001,China.E-mail:gerili@hotmail.com)
AIM: To compare the characteristics of small intestinal mucosal structure and mucosal immunity-associated cells between Tibetan antelopes and Tibetan sheep.METHODSThe morphological characteristics of small intestinal mucosal structure were observed under light microscope and electron microscope. The numbers of intraepithelial lymphocytes (IELs), goblet cells (GCs) and mast cells (MCs) in different parts of small intestine were also analyzed by the techniques of histological/histochemical methods and the Scion Image software between Tibetan antelopes (n=5) and Tibetan sheep (n=5).RESULTSThe length of small intestine villi and the ratio of villus length to crypt depth (V/C value) of the Tibetan antelopes were significantly higher than those of the Tibetan sheep (P<0.05). The length of the villi in duodenum, jejunum and ileum of the Tibetan antelopes was higher than that of the Tibetan sheep by 77.25% (P<0.05), 63.61% (P<0.05) and 35.38% (P<0.05), respectively, while V/C the ratio of villus length to crypt depth(V/Cvalue) of duodenum, jejunum and ileum in Tibetan antelopes was higher than that in the Tibetan sheep by 65.63% (P<0.05), 20.08% (P<0.05) and 35.68% (P<0.05), respectively. The thickness of intestinal mucosa in the Tibetan antelopes was significantly greater than that in the Tibetan sheep (P<0.05). No significant difference of intestinal muscle thickness between the Tibetan antelopes and the Tibetan sheep was observed (P>0.05). The numbers of GCs and MCs in different parts of small intestine in the Tibetan antelopes were obviously higher than those in the Tibetan sheep (P<0.05). The number of GCs in duodenum, jejunum and ileum in the Tibetan antelopes were higher than that in the Tibe-tan sheep by 12.84% (P<0.05), 49.88% (P<0.05) and 5.58% (P>0.05), respectively, while the number of MCs in duodenum, jejunum and ileum in the Tibetan antelopes was higher than that in the Tibetan sheep by 0.22% (P>0.05), 6.04% (P>0.05) and 160.80% (P<0.05), respectively. However, the number of IELs in different parts of small intestine in the Tibetan antelopes was significantly lower (P<0.05) than that in the Tibetan sheep. The number of IELs in duodenum, jejunum and ileum in the Tibetan antelopes was lower than that in the Tibetan sheep by 35.04% (P<0.05), 52.85% (P<0.05) and 52.82% (P<0.05), respectively.CONCLUSIONThe functions of small intestinal digestion and absorption in Tibetan antelopes are stronger than those in Tibetan sheep. The small intestinal mucosal barrier function of Tibetan antelopes is greater than that of Tibetan sheep. The GCs and MCs in Tibetan antelopes play an important role in intestine mucosal immune defenses, while the IELs play the main role in intestine mucosal defensive barrier in Tibetan sheep.
Tibetan antelopes; Tibetan sheep; Small intestine; Mucosal structure; Mucosal immunity-associated cells
R363
A
10.3969/j.issn.1000-4718.2012.09.021
