海洛因诱导的条件性位置偏爱大鼠额叶联络皮层脑电的无线遥测及其分析*
2012-11-06潘群皖朱再满周鸿铭
潘群皖, 黄 磊, 朱再满, 李 敏, 李 晶, 周鸿铭
(皖南医学院 1生理教研室, 2麻醉与影像设备教研室,安徽 芜湖 241000)
1000-4718(2012)09-1589-08
2012-04-17
2012-07-11
安徽省自然科学基金资助项目(No.090413096; No.10040606Q66)
△通讯作者 Tel: 0553-3932473; E-mail: panqunw@163.com
海洛因诱导的条件性位置偏爱大鼠额叶联络皮层脑电的无线遥测及其分析*
潘群皖1△, 黄 磊2, 朱再满1, 李 敏1, 李 晶1, 周鸿铭1
(皖南医学院1生理教研室,2麻醉与影像设备教研室,安徽 芜湖 241000)
目的利用条件性位置偏爱(CPP)视频系统结合脑电无线遥测技术,记录海洛因诱导的CPP大鼠额叶联络皮层(FrA)区的脑电变化,分析其与觅药行为之间的关系。方法对大鼠FrA区进行脑立体定位电极埋藏,并分成对照组和海洛因诱导CPP组,后者制作海洛因依赖模型。利用无线遥测技术,分别记录2组大鼠黑白箱停留、黑-白穿梭和白-黑穿梭时大鼠FrA区脑电变化,分析其各波相对功率和百分比的差异。结果海洛因诱导的CPP组大鼠黑白箱停留时遥测脑电各波相对功率和百分比,与对照组比较无显著差异(P>0.05),但海洛因诱导的CPP大鼠穿梭时左侧FrA脑电波呈现δ波减少、β波和β2波增加的改变(P<0.05,P<0.01),尤以黑-白箱穿梭明显,而对照组大鼠穿梭时则表现出截然相反的脑电变化。结论大鼠左侧FrA区慢波减少、快波增加的特异性改变,可能与海洛因诱导的CPP大鼠戒断状态下穿梭觅药行为及其动机形成有关。
海洛因; 条件性位置偏爱; 额叶联络皮层
海洛因诱导所产生的条件性位置偏爱(conditioned place preference, CPP)和觅药行为,与大脑前额皮层的神经元功能及其突触间基质蛋白有关[1]。相关实验表明,内侧前额皮层(medial prefromal cortex,mPFC)腹侧部神经突触后膜α-氨基羟甲基噁唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid,AMPA)亚型受体即谷氨酸受体2(glutamate receptor 2,GluR2)的可塑性与大鼠暗示性海洛因自给药行为有关,GluR2下调可减弱海洛因觅药行为[2]。Peters等[3]发现,mPFC背侧边缘前皮质(prelimbic cortex,PrL)能诱发恐惧和觅药行为的产生,而mPFC扣带皮层(cingulate cortex,Cg)则产生相反的效应。Bossert等[4]新近研究表明,PrL和Cg区可增强大鼠自给药环境与海洛因奖赏相结合所诱导的觅药行为,mPFC腹侧部某些Fos蛋白表达阳性、被称为神经元集群(neuronal ensembles)的散在神经元,可编码和调控背侧PrL和Cg区自给药环境与海洛因奖赏结合的联合学习。大鼠额叶联络皮层(front association cortex,FrA)毗邻mPFC,其Fr2区(shoulder cortex)属于背侧mPFC,大鼠海洛因觅药行为状态下FrA脑电实时记录及其分析,迄今未见报道。本实验利用CPP视频系统结合脑电无线遥测技术,观察海洛因诱导的CPP大鼠FrA区脑电的变化。
材 料 和 方 法
1动物
选用清洁级Wistar大鼠(南京市江宁区青龙山动物繁殖场,许可证号为SCXK苏2001-0001)33只,雌雄不限,体重290~320 g,常规饲养,自由进食水。
2方法
2.1大鼠FrA区电极埋藏 在20%氨基甲酸乙酯麻醉状态下,行大鼠慢性电极埋藏手术。术中筛选颅骨前囟至人字缝距离>9 mm的大鼠做电极埋藏,左右侧FrA定位为:前囟+5 mm,矢状缝旁开2 mm,深度2.5 mm[5]。电极使用0.3 mm漆包镍铬丝。左右侧电极埋藏后,切口处撒青霉素粉少许,连同置于头皮下组织的接地电极用自凝牙科水泥固定,封闭切口。术后5 d内大鼠室内温度控制在24℃左右,连续3 d肌注青霉素4×105U预防感染。
2.2海洛因诱导CPP大鼠模型制作及其确定 将做过FrA电极埋藏手术的17只大鼠,饲养10 d以上,作为对照组,同时选8只非手术大鼠(非手术组),在实验前均放入CPP视频黑白箱内(JLBehv条件性位置偏爱视频分析系统,上海吉量软件科技有限公司生产)习服3 d,每天1次,每次45 min。习服结束后,正式开始大鼠黑、白箱 CPP实验测定。将白箱作为伴药箱,2组大鼠在白箱注射生理盐水,然后任其自由穿梭于黑白箱。利用视频观察和轨迹图自动记录数据,统计每只大鼠黑、白箱停留时间和百分比。每次测定时间15 min,连续7 d。
8只FrA已埋藏电极的大鼠CPP箱中习服3 d后,采用伴药箱给药方法,制作海洛因诱导CPP模型,设为海洛因诱导CPP组。大鼠被赶至白箱(伴药箱)内皮下注射海洛因,第1 d总量0.5 mg/kg,以后每天注射2次,每次递增0.25 mg/kg[6]。注射药物后,继续将大鼠置于白箱内45 min。连续注射约5~9 d后,于次日注射药物前,同上测定该组大鼠15 min黑、白箱CPP相关数据。将海洛因诱导组大鼠15 min CPP数据与非手术组大鼠、对照组大鼠做CPP数据团体对照分析,同时,做大鼠海洛因诱导前后CPP数据自身对照分析,以确定大鼠伴药箱位置偏爱的形成。
此外,海洛因诱导大鼠注射药物5 d后,观察其戒断症状,按栁田知司评定方法打分,总分在20分以上为戒断症状明显,结合上述CPP实验,确定大鼠CPP及其药物依赖是否形成。
2.3大鼠左右侧FrA自发脑电的无线遥测 通过脑电无线遥测系统及其软件(BW-200型生理无线遥测系统,成都泰盟科技有限公司生产),记录对照组和海洛因诱导CPP组大鼠左右侧FrA自发脑电。将无线遥测发射子用绑带固定在大鼠背部,打开发射子磁开关,输入端两电极分别接地电极和左、右侧FrA埋藏电极,此时发射子自动采集并发射出左、右侧FrA自发脑电,通过智能接收机解码,经网络中心机输送至电脑,利用系统服务软件记录和处理脑电信号。
3统计学处理

结 果
1海洛因诱导组大鼠白箱CPP的确定
各组大鼠置于CPP视频箱内自由穿梭,见图1,分别测定非手术组大鼠、对照组和海洛因诱导的CPP组大鼠黑白箱停留时间及其百分比,描记轨迹图。结果表明:海洛因诱导的CPP组大鼠与其它组相比,白箱给药7 d后,大鼠即可产生伴药箱CPP(P<0.05,P<0.01),见表1。此外,已编号的海洛因诱导CPP组大鼠通过注射药物前、后自身对照,以白箱停留时间较前大于50%为标准,观察到一些大鼠海洛因诱导5 d后,CPP现象即逐渐出现,但也有个别大鼠海洛因诱导12 d才出现CPP。按栁田知司评定方法,海洛因诱导CPP组大鼠戒断症状明显,主要表现为震颤、洗面、甩头、直窜和怪异动作、磨牙、喷嚏、咬物、眼分泌物增加、体重减轻等。

Figure 1. Rat shuttle in black(left) or white(right) chamber of conditioned place preference(CPP)video boxes(A)and the rat trace maps recorded through automatic recording system (selected from 8#rat of heroin-induced group) (B).
图1大鼠在CPP视频系统黑、白箱中活动和穿梭的图象及系统自动描记的大鼠轨迹图

表1 海洛因诱导的CPP组大鼠黑白箱活动时间(15 min)分析
*P<0.05,**P<0.01vsnon-operated group;#P<0.05,##P<0.01vscontrol group.
2海洛因诱导的CPP大鼠FrA区黑、白箱无线遥测脑电及其分析
2.1大鼠黑、白箱停留状态时遥测脑电分析 对照组大鼠和海洛因诱导的CPP组大鼠分别于视频黑、白箱内做左右侧FrA脑电无线遥测,记录原始脑电,基于快速傅立叶变换,获取脑电各波百分比。通过MatLab软件对2组大鼠不同状态下的脑电信号进行功率谱分析并归一化强度,基于小波包技术分别从2种状态下的脑电信号里提取出各自4个节律的时域波形图,见图2。通过2组大鼠遥测脑电功率谱和快速傅里叶分析,结果表明海洛因诱导CPP大鼠在黑、白箱停留状态时,与对照组大鼠比较,左右侧FrA脑电δ、θ、α、α1、α2、β、β1、β2波相对功率和百分比没有显著差异(P>0.05)。
2.2大鼠穿梭时FrA遥测脑电的特征 分别无线遥测2组大鼠黑-白穿梭和白-黑穿梭时脑电,见图3。选择对照组和海洛因诱导的CPP组大鼠穿梭时脑电经快速傅立叶分析,并与海洛因诱导的CPP组大鼠黑、白箱停留状态下各脑电波百分比进行对比,见图4。结果表明,对照组大鼠除白-黑穿梭时,其右侧FrA脑电无显著变化外(P>0.05),其余脑电均呈现出δ波百分比增加,β、β1、β2、α1、α1和α2波百分比减少的趋势(P<0.05,P<0.01),而海洛因诱导的CPP组大鼠穿梭时,脑电则表现出δ波百分比降低、β波增加的相反变化,且主要发生在左侧FrA(P<0.05)。
2.3海洛因诱导的CCP组大鼠和对照组大鼠穿梭时脑电的比较 2组大鼠穿梭时的脑电波百分比变化见图5。与对照组大鼠穿梭时脑电比较,海洛因诱导的CPP组大鼠除白-黑穿梭时右侧FrA脑电无显著差异外(P>0.05),其余均呈现FrA区δ波百分比减少(P<0.05,P<0.01)、β波和β2波增加(P<0.05,P<0.01)的改变,以左侧FrA为主,尤其是在黑-白箱穿梭时明显,除β波增加外,α、α1和α2波也增加,各波相对功率谱测定表现出相同的改变。相比之下,对照组大鼠穿梭时则表现出截然相反的脑电变化,即δ波增加(P<0.01),β波和β2波减少。
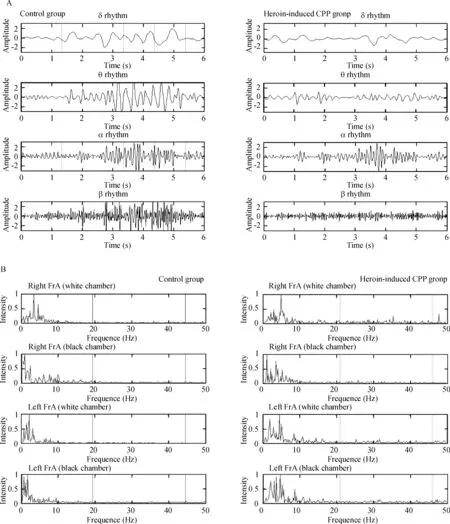
Figure 2. The δ,θ,α and β rhythm of original EEG based on wavelet packets extracted from 8#rat (A) and the spectrum of original EEG from 8#rat (B).
图28号大鼠原始脑电小波包δ、θ、α、β节律提取和原始脑电频谱图
讨 论
神经生理学家Kornhuber提出,随意运动的设想起源于皮层联络区,经小脑和基底神经节编制运动计划及程序后,输送至皮层躯体运动区,通过皮质-脊髓束发动随意运动。海洛因诱导大鼠所形成的白箱CPP觅药行为,实际上是一种随意运动行为,其运动的设想及其觅药意识的形成,应该源于皮层联络区。根据这一原理,我们首先将研究焦点放在了皮层联络区面积较大的FrA脑区,该区毗连mPFC脑区,后者被公认为与海洛因奖赏效应及其觅药行为密切相关。本文将CPP视频检测系统与脑电无线遥测技术相结合,较好地记录了大鼠在CPP状态下的实时遥测脑电,并利用非线性时频信号小波分析法和快速傅里叶分析手法,试图寻找出大鼠在海洛因诱导的CPP行为状态下,FrA区域可能出现的脑电改变。
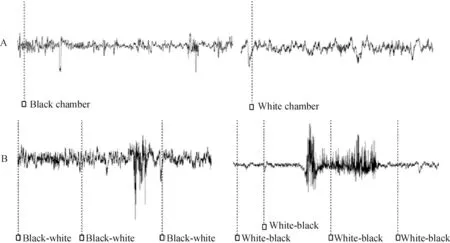
Figure 3. The EEG recorded on FrA by wireless telemetry while 14#rat with heroin-induced CPP stayed in black or white chamber (the timeline was compressed by 5 times) (A) and shuttled between black-white chambers or white-black chambers (the timeline was compressed by 20 times) (B).
图3海洛因诱导的CPP组14号大鼠黑、白箱停留时的遥测脑电以及该大鼠黑-白穿梭和白-黑穿梭时的遥测脑电
具有明显CPP行为的大鼠,在海洛因戒断状态下,任其在黑或白箱内自由行走或停留,实时遥测大鼠左右侧FrA区脑电波,结果表明其脑电δ、θ、α、α1、α2、β、β1、β2节律百分比及其相对功率,与对照组大鼠比较,基本没有显著差异。这与先前所报道的吗啡诱导产生CPP的大鼠,左右侧皮层δ、θ、α1、α2、β1、β2脑电波及绝对功率降低的结果[7]似乎相矛盾。我们认为,这种差别可能与测定脑电的时间以及大鼠当时的行为状态有关。本实验发现在给大鼠注射海洛因后约2 h内,大鼠基本上处于安静嗜睡样状态,全身佝偻,激惹阈高,此时遥测脑电可见脑电波和相对功率降低。2 h后,大鼠逐渐苏醒活动,并出现怪异动作和逐步变得烦躁,我们所遥测的脑电,基本上是取此一戒断时段,一般选用作为分析的脑电,多为记录较为平稳,即大鼠在黑白箱处于相对安静状态下的实时脑电。这种脑电相当于人类在海洛因依赖状态下,毒瘾尚没有发作,且处于安静时的脑电,估计可能与正常人脑电差别不大。由于初次进行脑电无线遥测实验,加上大鼠运动随意性较强,在记录过程中没有将2组大鼠在箱内安静和活动状态加以标记区分,因此,2种状态下脑电波统计学分析未能单独做出。
黑、白箱之间穿梭活动是大鼠活动状态下的一种特殊表现。快速傅里叶分析表明,海洛因诱导CPP大鼠在两箱穿梭时所遥测的脑电波百分比,与其分别停留在黑、白箱内的脑电比较,除白-黑箱穿梭右侧FrA区脑电百分比无显著差异外,其余FrA区脑电均显示δ波减少,β波和β2波增加,尤以左侧显著。新近皮层fMRI成像报道,海洛因吸食者左侧背外侧额叶皮层低频率振荡波幅降低,右侧未发现明显改变[8]。为了明确左侧FrA这种变化趋势是否与穿梭觅药行为有关,我们将海洛因诱导的CPP大鼠穿梭时的遥测脑电,与对照组大鼠穿梭时的遥测脑电进行比较,结果表明,海洛因诱导的CPP大鼠穿梭时,除白-黑穿梭时右侧FrA脑电无改变外,其余FrA区脑电均显示δ波百分比减少、β和β2波增加趋势,尤以左侧FrA显著,如黑-白箱(伴药箱)穿梭时,除β波增加外,α、α1和α2波也明显增加。对照组大鼠穿梭时则表现出截然相反的脑电变化,即δ波节律百分比增加,β和β2波减少。上述脑电变化提示大鼠FrA区δ波减少、β波和β2波增加,即慢波减少、快波增加的特异性改变,尤其是左侧FrA区脑电的改变,可能与海洛因诱导的CPP大鼠戒断状态下穿梭觅药行为及其动机形成有关。
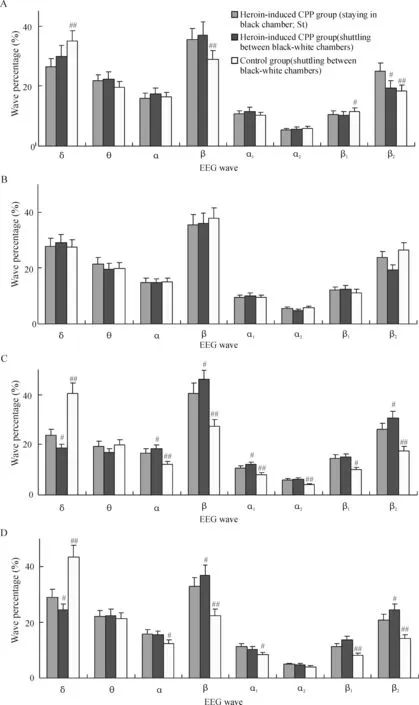
Figure 4. Percentage analysis of telemetry EEG waves recorded on FrA from three groups of rats.A, B: on the right FrA; C, D: on the left FrA.#P<0.05,##P<0.01vsheroin-induced CPP group (St).
图43组大鼠黑白箱停留和穿梭时FrA区遥测脑电波百分比分析
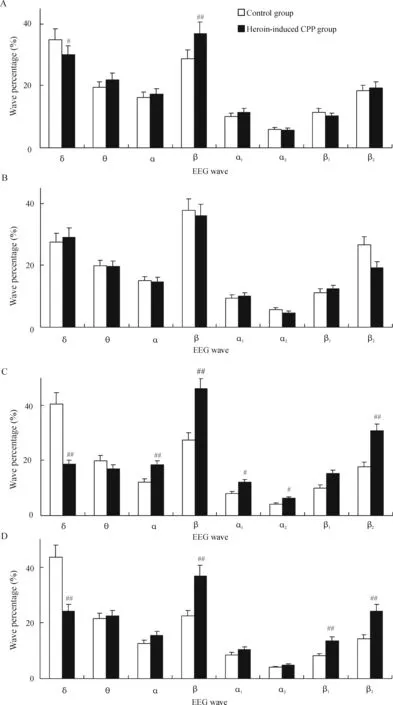
Figure 5. Percentage analysis of telemetry EEG recorded on FrA from the two groups of rats shuttling between two chambers. A: on the right FrA and between black-white chambers; B: on the right FrA and between white-black chambers; C: on the left FrA and between black-white chambers; D: on the left FrA and between white-black chambers.#P<0.05,##P<0.01vscontrol group.
图5对照组和海洛因诱导位置偏爱组大鼠穿梭时FrA区遥测脑电波百分比分析
[1] Van den Oever MC, Lubbers BR, Goriounova NA,et al. Extracellular matrix plasticity and GABAergic inhibition of prefrontal cortex pyramidal cells facilitates relapse to heroin seeking[J]. Neuropsychopharmacology,2010,35(10):2120-2133.
[2] Van den Oever MC,Goriounova NA,Li KW,et al. Prefrontal cortex AMPA receptor plasticity is crucial for cue-induced relapse to heroin-seeking[J]. Nat Neurosci,2008,11(9):1053-1058.
[3] Peters J,Kalivas PW,Quirk GJ,et al. Extinction circuits for fear and addiction overlap in prefrontal cortex[J].Learn Mem,2009,16(5):279-288.
[4] Bossert JM,Stern AL,Theberge FR,et al. Ventral medial prefrontal cortex neuronal ensembles mediate context-induced relapse to heroin[J]. Nat Neurosci,2011,14(4):420-422.
[5] George P ,Charles W(诸葛启钏主译).大鼠脑立体定位图谱[M].第3版. 北京:人民卫生出版社,2005:4-5.
[6] 潘群皖.海洛因慢性给药戒断期大鼠海马CA1区神经元电生理研究[J].中国病理生理杂志,2008,24(3):594-596.
[7] Zuo YF,Wang JY,Chen JH,et al. A comparison between spontaneous electroencephalographic activities induced by morphine and morphine-related environment in rats[J]. Brain Res,2007,1136(1):88-101.
[8] Jiang GH, Qiu YW, Zhang XL,et al. Amplitude low-frequency oscillation abnormalities in the heroin users: a resting state fMRI study[J]. Neuroimage,2011,57(1):149-154.
EEGchangesoffrontassociationcortexinheroin-inducedCPPratsdetectedbywirelesstelemetry
PAN Qun-wan1, HUANG Lei2, ZHU Zai-man1, LI Min1, LI Jing1, ZHOU Hong-ming1
(1DepartmentofPhysiology,2DepartmentofAnesthesiologyandImageEquipment,WannanMedicalCollege,Wuhu241000,China.E-mail:panqunw@163.com)
AIM: To analyze the relationship between the electroencephalogram (EEG) changes of front association cortex (FrA) and the drug-seeking behavior by recording FrA EEG in heroin-induced conditioned place preference (CPP) rats.METHODSA CPP video system combined with the technique of EEG wireless telemetry was used in the study. The rats were randomly divided into control group and heroin-induced CPP group after stereotaxic electrodes were buried on in the FrA, and the latter group was used as heroin dependence model. The FrA EEG was recorded by wireless telemetry,including staying in black or white chamber of video box, black-white chamber shuttle and white-black chamber shuttle. The differences of EEG were analyzed by the relative power and the percentage of each wave.RESULTSWhen the rats stayed in the black or white chamber, no significant difference in the relative power and percentage of the telemetry EEG wave was observed (P>0.05). When the heroin-induced CPP rats shuttled between two chambers, especially shuttled between the black-white chambers, EEG on the left FrA showed that δ wave was reduced, and β wave together with β2wave was increased (P<0.05,P<0.01), while the EEG in control group showed the radically opposite changes.CONCLUSIONThe specific changes of EEG on the left FrA including reduction in slow wave and increase in fast wave may be related to drug-seeking behavior and motivation in the rat withdrawal status.
Heroin; Conditioned place preference; Front association cortex
R363
A
10.3969/j.issn.1000-4718.2012.09.010
