MNNG诱导TERC基因沉默的16HBE细胞恶性转化模型的建立*
2012-11-06朱俊峰黄小荣冯宇鹏周俊宜
朱俊峰, 黄小荣, 冯宇鹏, 周俊宜△
(中山大学中山医学院 1生物化学与分子生物学教研室,2实验教学中心,广东 广州 510080;3广东医学院附属西乡人民医院泌尿外科,广东 深圳 518102)
1000-4718(2012)07-1326-05
2011-12-30
2012-04-13
广东省科技计划项目(No. 2006B35502007;No.2010B031200013);广东省自然科学基金重点项目(No.04105351)
△通讯作者 Tel: 020-87330770; E-mail: zhoujy@mail.sysu.edu.cn
MNNG诱导TERC基因沉默的16HBE细胞恶性转化模型的建立*
朱俊峰1, 黄小荣2, 冯宇鹏3, 周俊宜1△
(中山大学中山医学院1生物化学与分子生物学教研室,2实验教学中心,广东 广州 510080;3广东医学院附属西乡人民医院泌尿外科,广东 深圳 518102)
目的建立N-甲基-N’-硝基-N-亚硝基胍(N-methyl-N’-nitro-N-nitrosoguanidine, MNNG)诱导的人端粒酶RNA组分(telomerase RNA component,TERC)缺陷的人支气管上皮细胞株(16HBE)恶性转化细胞模型。方法将靶向TERC基因的shRNA干扰质粒载体转染16HBE细胞,G418抗性克隆筛选得到稳定转染的16HBE-1细胞,RT-PCR检测16HBE-1细胞TERC mRNA的干扰效率;用1 mg/L MNNG对16HBE-1细胞进行隔代染毒,每次染毒1 h;直到染毒27次转化灶的出现。分离扩增转化灶细胞并命名为16HBE-T,用软琼脂克隆形成实验和裸鼠成瘤实验鉴定细胞的转化程度。结果从转化灶分离培养的细胞能在软琼脂中生长,且转化细胞能在裸鼠体内成瘤,HE染色后光镜下显示为鳞癌。结论成功建立MNNG诱导的TERC基因缺陷的16HBE细胞恶性转化模型。
端粒酶RNA;人支气管上皮细胞;RNA干扰;N-甲基-N’-硝基-N-亚硝基胍
端粒酶是一个核蛋白酶复合体,可以在染色体末端增加端粒的重复序列。人端粒酶由人端粒酶逆转录酶(telomerase reverse transcriptase,TERT)和人端粒酶RNA组分(telomerase RNA component, TERC)组成。在大多数肿瘤细胞中,端粒酶的表达水平显著增高,如肺癌[1]、乳腺癌[2]、宫颈癌[3]等。早期资料表明,TERC的表达与端粒酶活性的调节是分离的[4]。但越来越多资料表明,TERC与端粒酶活性的维持有着密切的关系[5-9]。本研究皆在建立N-甲基-N’-硝基-N-亚硝基胍 (N-methyl-N’-nitro-N-nitrosoguanidine, MNNG) 诱导的TERC基因缺陷的16HBE细胞株恶性转化细胞模型,从而为研究TERC在肿瘤发生阶段的分子机制研究提供了理想的研究系统。
材 料 和 方 法
1材料
1.1细胞、质粒、菌株和裸鼠 人支气管上皮细胞(16HBE)购自中国医学科学院肿瘤医院肿瘤研究所;pEGFP-C1和大肠杆菌JM109均由本实验室保存;重组质粒pEGFP-U6和pEGFP-U6-shRNA1为本实验室构建并保存;BALB/c裸鼠购自中山大学医学实验动物中心。
1.2主要试剂 RPMI-1640固体培养基购自Gibco;MNNG购自日本东京化成工业株式会社,用RPMI-1640基础培养基将MNNG溶剂配成100 mg/L储存液,避光保存于4 ℃。用于染毒细胞时,储存液与无血清RPMI-1640基础培养基再以1∶100比例充分混合后,制成MNNG应用液直接染毒细胞。胎牛血清购自TBD;胰酶购自Amresco;DMSO购自Sigma;低熔点琼脂粉购自Promega。
2方法
2.1细胞培养 16HBE细胞用含10%胎牛血清的RPMI-1640培养基中培养,当细胞生长至90%融合时可进行传代,吸去旧培养液,PBS洗2遍,加适量0.25%胰酶消化,37 ℃温箱1~3 min,至显微镜下细胞分散成单粒状,吸去胰酶,加完全培养基2~3 mL终止消化,吹打混匀至镜下成单细胞悬液,均分到3个培养瓶里,补足培养液,37 ℃、5%CO2培养箱中继续培养。
2.2细胞转染 应用LipofectamineTM2000(按Introgen公司试剂盒说明书)将空载体pEGFP-U6和重组质粒pEGFP-U6-shRNA1分别转染16HBE细胞株。转染后24 h,将细胞以1∶10的比例传代,48 h后加G418选择培养基,其筛选浓度为200 mg/L,约3周后,可见抗性克隆长出,荧光显微镜下标记绿色荧光克隆,经有限稀释挑取单克隆细胞分别命名为16HBE-C1和16HBE-1,并扩大培养。
2.3RT-PCR方法分析干扰效率 收集对数生长期16HBE、16HBE-C1和16HBE-1细胞,总RNA提取严格按照RNAiso Reagent(TaKaRa)试剂说明书进行,每组细胞总RNA模板量为1 μg,用Oligo(dT)18引物逆转录成cDNA。以cDNA为模板,相应引物进行PCR反应,25 μL反应体系如下:2.5 μL 10×PCR buffer、0.5 μL dNTP(各10 mmol/L)、1 μg cDNA、0.25 μL Taq 酶(5 U)及引物各 0.5 μL(10 μmol/L),其余用灭菌水补足25 μL。PCR反应条件为94 ℃ 20 s,50 ℃ 20 s,72 ℃ 30 s,25个循环。TERC的引物为:上游引物5'-CTGGGAGGGGTGGTGGCCATTT-3',下游引物5'-CGAACGGGCCAGCAGCTGACAT-3'。内参照GAPDH扩增所用引物:上游引物5'-CGGGAAACTGTGGCGTGAT-3',下游引物5'-CAAAGGTGGAGGAGTGGGT-3'。PCR反应条件均为:94 ℃ 预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,25个循环;72 ℃ 5 min。PCR反应结束后,各取5 μL反应液进行2%琼脂糖凝胶电泳分析,并用NIH ImageJ 1.38软件进行灰度分析。
2.4细胞毒性实验 接种16HBE-1细胞约200个于直径为60 mm的细胞培养皿中,37 ℃、5%CO2培养箱中培养24 h后,分别加入0 mg/L、0.1 mg/L、0.5 mg/L和1 mg/L MNNG应用液。加入后1 h弃去MNNG染毒液,细胞用PBS洗涤3次,加入新鲜完全培养基继续培养10 d。显微镜下计数大于50个细胞的细胞集落数,然后按下列公式计算绝对集落形成率(absolute colony forming efficiency,A-CFE)和相对集落形成率(relative colony forming efficiency,R-CFE):
其次是语言的浅易对后世影响极大,语言的通俗易懂为李渔当时打开戏剧正常开辟了捷径,也对同时代小说创作影响极大。语言用词浅显为文化下移提供了可能性,促进了戏剧的兴盛,清代各类戏种的兴旺发展与此不无关系。
A-CFE(%)=每孔集落形成数/每孔细胞接种数×100%。R-CFE(%)=实验组每孔集落数/阴性对照组每孔集落数×100%。
2.5细胞恶性转化实验 16HBE-1细胞转化实验在24孔板中进行,每孔接种细胞数约105个。至细胞生长至70%~80%融合时,每孔加入0.5 mL 1 mg/L MNNG应用液。1 h后,弃去处理液,细胞用PBS洗涤2次,0.25%胰酶消化后以1∶3传代。隔代按上述方法处理细胞1次,共27次。每天观察、记录细胞形态变化。
2.6软琼脂克隆形成实验 取对数期转化细胞,即16HBE-T细胞,胰酶消化后吹散成单个细胞悬液,计数,并调整细胞密度为1×106/L。在24孔板中制备0.5%底层琼脂,温室凝固。制备0.3%上层琼脂,上层琼脂含约500 cells/well,混匀,置于37 ℃、5%CO2细胞培养箱中培养2~3 周,定期观察细胞集落形成情况。
2.7裸鼠成瘤实验 收集对数生长期对照16HBE和16HBE-T细胞,调整细胞密度均为1×1010/L,裸鼠左、右侧颈部皮下分别注入10 μL,共5只。每天观察裸鼠注射部位成瘤情况。4周后处死裸鼠,分离肿块并进行常规病理切片检查。
3统计学处理
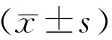
结 果
1稳定转染细胞株的获得
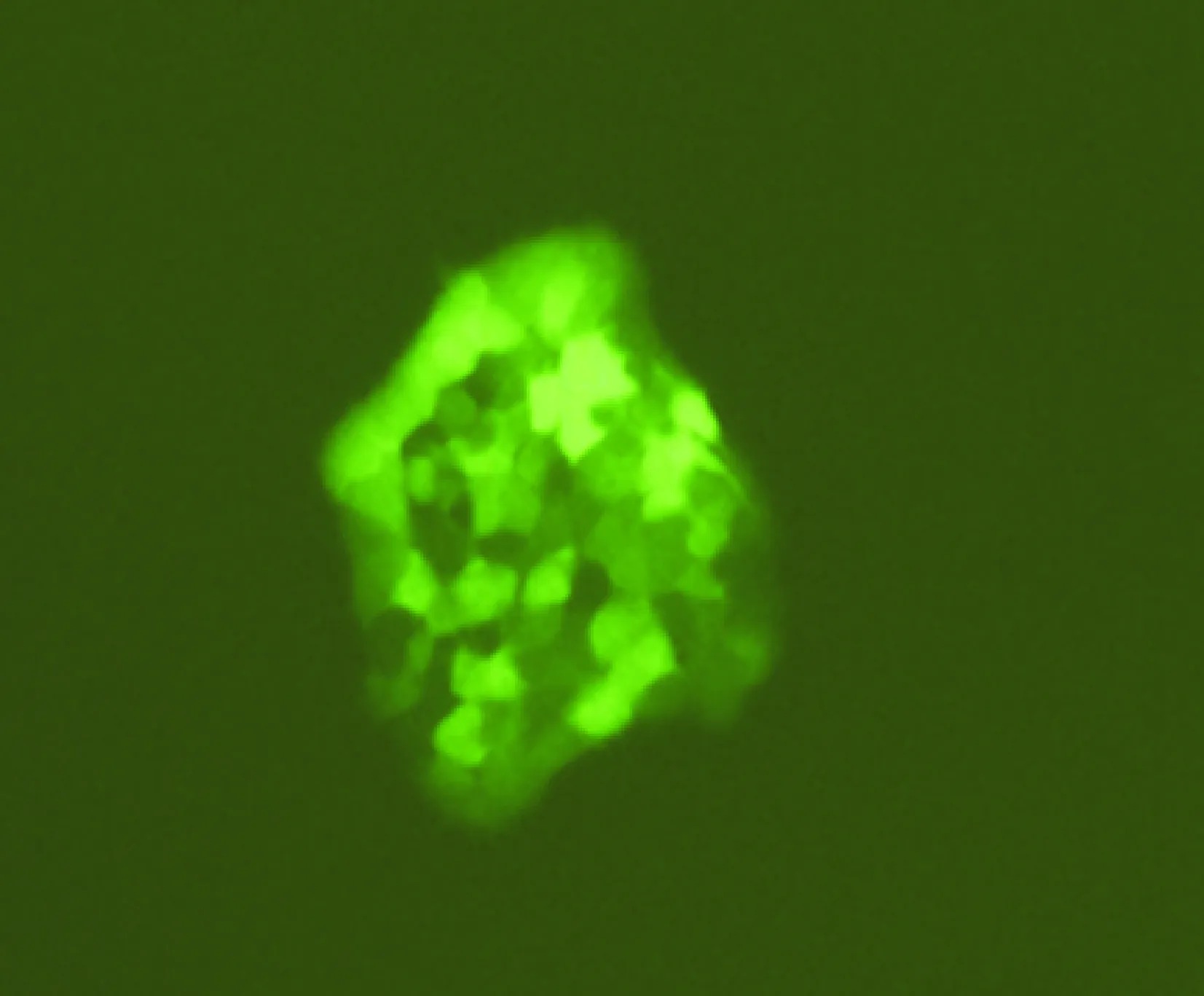
Figure 1. A screened cell clone(×100).
图1筛选出的一个细胞克隆
2RT-PCR检测稳定转染细胞株TERC基因的沉默效率
TERC和内参照GAPDH的扩增产物分别为179 bp和311 bp,见图2。16HBE和16HBE-C1细胞的TERC mRNA表达差异无统计学意义(P>0.05);16HBE-1与16HBE细胞的TERC mRNA表达差异有统计学意义(P<0.01), 16HBE-1细胞的TERC mRNA表达较16HBE细胞下降了64.750%;16HBE-1细胞与16HBE-C1细胞的TERC mRNA表达差异有统计学意义(P<0.05),16HBE-1细胞的TERC mRNA表达较16HBE-C1细胞下降了66.468%。

图2TERCmRNA表达分析
3MNNG对16HBE细胞的毒性作用
16HBE细胞的A-CFE和R-CFE随着MNNG剂量的增加而降低,见表1。选择 R-CFE在70%~80%范围之内的1 mg/L作为转化实验的剂量。
表1MNNG对16HBE细胞集落形成率的影响

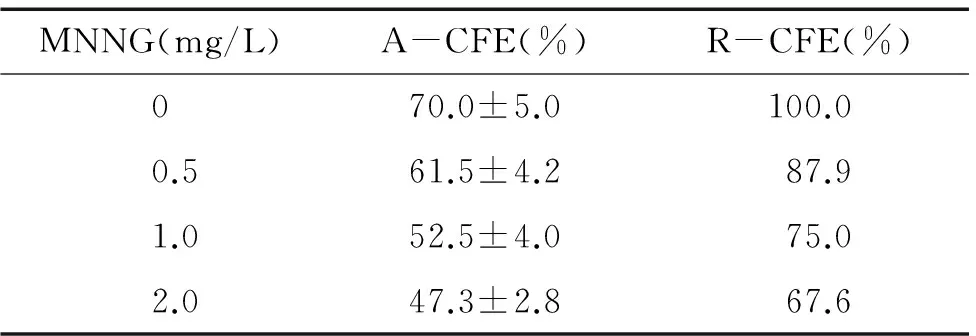
MNNG(mg/L)A-CFE(%)R-CFE(%)070.0±5.0100.00.561.5±4.287.91.052.5±4.075.02.047.3±2.867.6
4“转化灶”的产生
持续染毒第27次的16HBE-1细胞失去接触抑制,堆积
生长,细胞排列紊乱并堆积成岛屿状,出现了明显可见的转化灶,见图3。
5MNNG处理的细胞在软琼脂中生长
细胞在软琼脂上锚着非依赖生长能力是体外立体细胞培养条件下衡量细胞恶性程度的重要指标。染毒至第10代和20代各组细胞均不能在软琼脂上形成克隆。从“转化灶”分离培养的16HBE-T细胞获得了在软琼脂上生长的能力,此时形成的细胞克隆呈明显的立体三维空间生长状态,见图4。
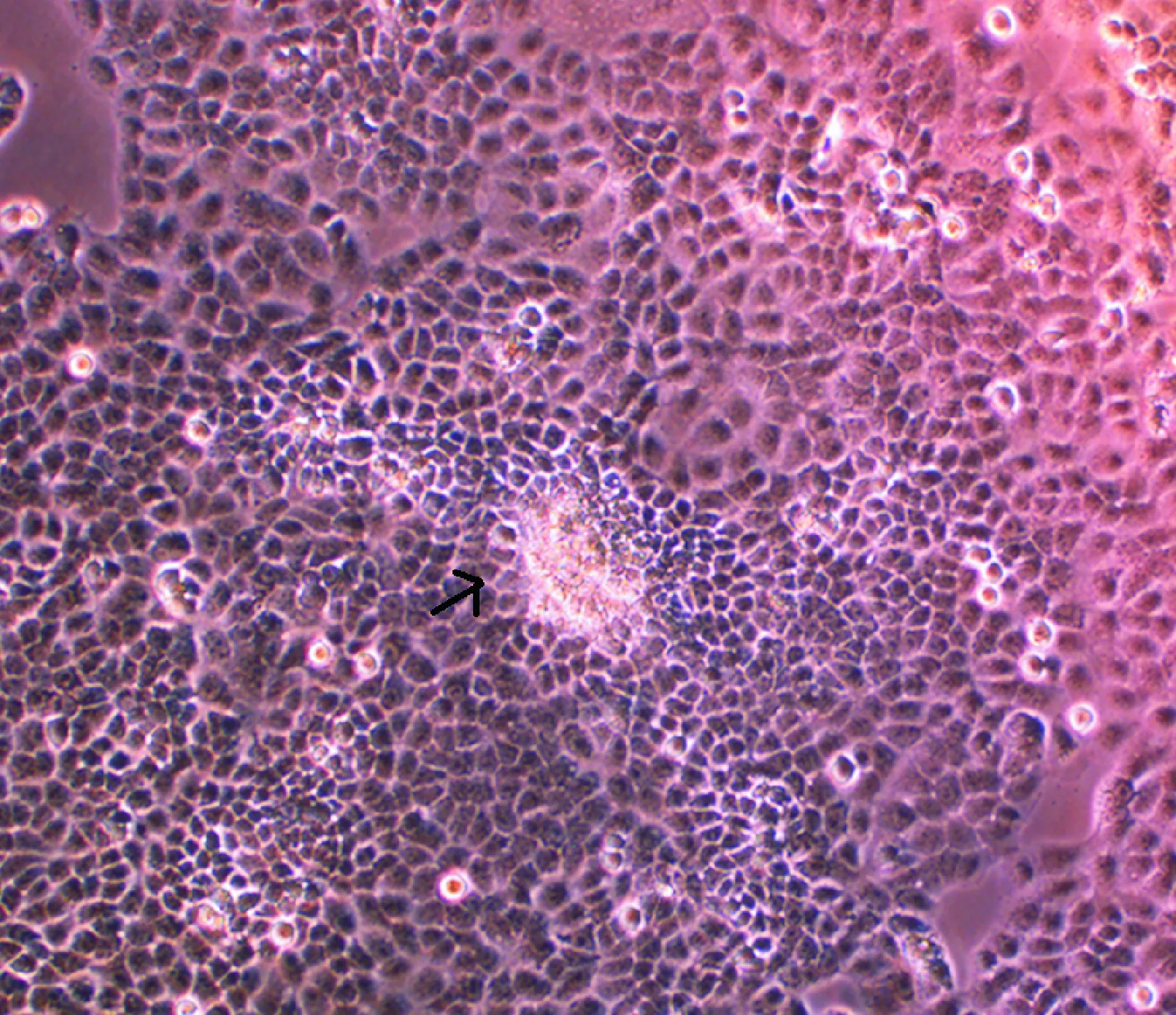
Figure 3. 16HBE-1 cells formed transforming foci after MNNG treatment(×100). Arrow: a transforming focus.
图316HBE-1细胞经MNNG染毒形成的“转化灶”
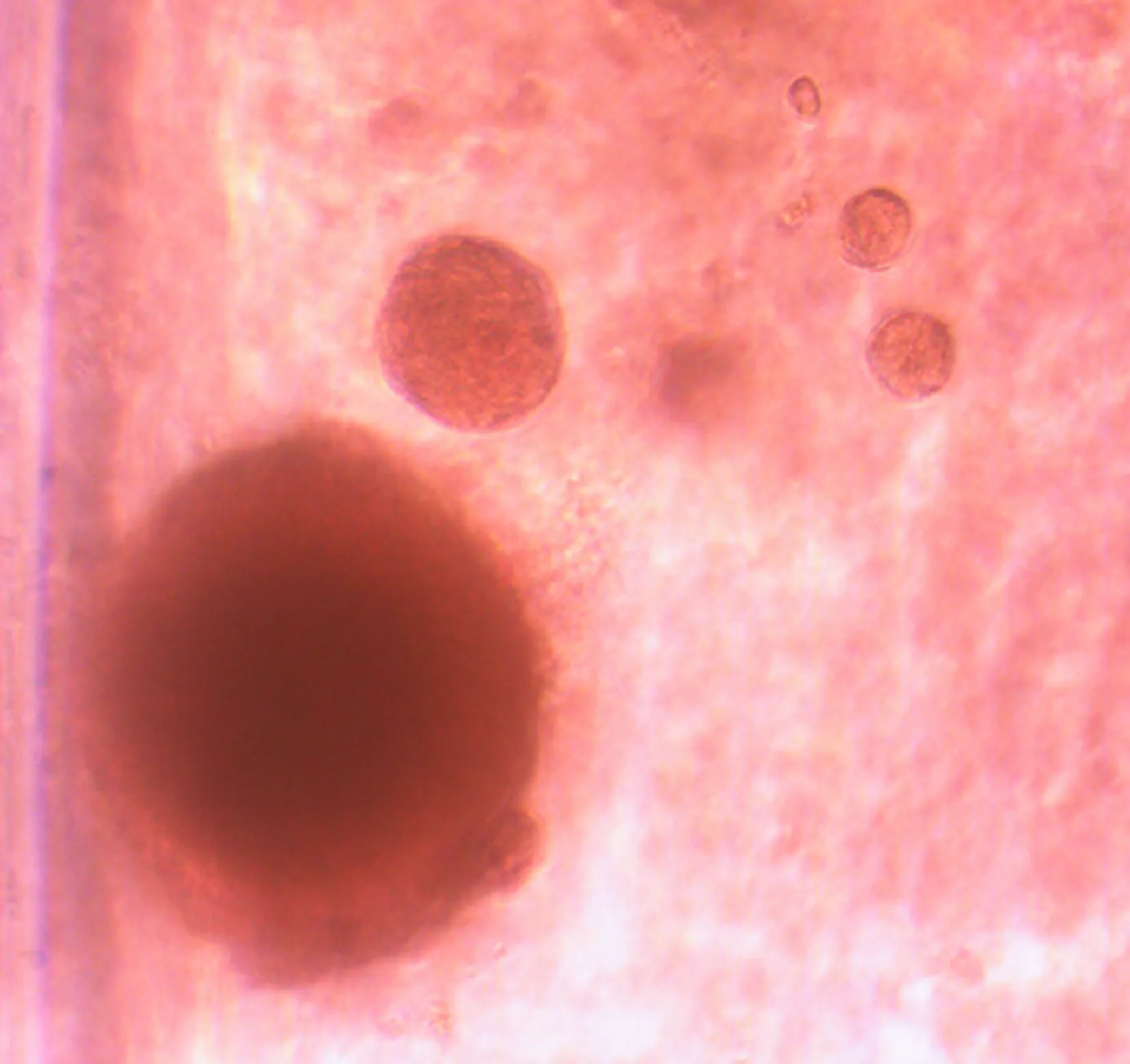
Figure 4. 16HBE-T cells could grow in the soft agar(×100).
图416HBE-T细胞获得在软琼脂中生长的能力
6裸鼠成瘤实验
接种裸鼠1周后,其中4只裸鼠在注射16HBE-T细胞的局部开始出现可触及肿物。接种4周,瘤体逐渐增大生长渐不规则,凸凹不平,见图5A。而接种16HBE细胞局部未见皮下结节的形成。接种4周后处死裸鼠取肿块,病理切片镜下所见为低分化鳞状细胞癌,见图5B,可见细胞呈巢状或团状。细胞大小不一,核大,并可见病理性核分裂像。
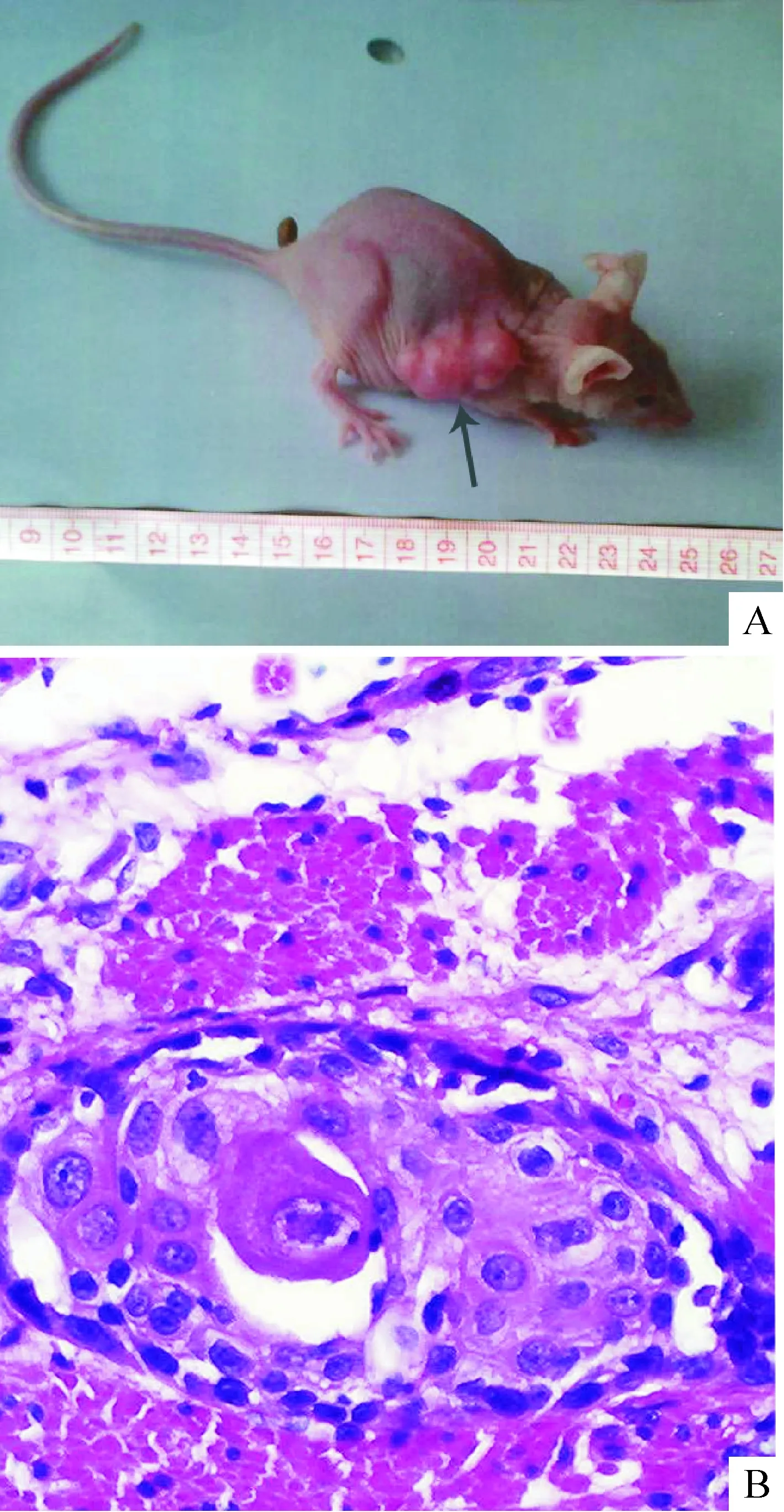
Figure 5. Visual inspection (A) and histopathological examination (B,×100) of the tumor in nude mice formed by 16HBE-T cells. Arrow: tumor.
图516HBE-T细胞在裸鼠体内成瘤的肉眼观察和组织病理学检查
讨 论
体外培养细胞的人工诱变实验已经成为研究致癌机制的一种比较理想有效的方法,除用于检测外来致癌因素外,还能被用来研究感兴趣的基因是否参与某一类肿瘤的发生发展过程。始于1963年的体外细胞转化研究经历了由动物细胞向人类细胞、成纤维细胞向上皮细胞的两大过渡。人类85%的肿瘤中来源于上皮,因此,直接研究人上皮细胞转化系统对于研究细胞癌变机制有更重要的意义。本实验中采用的是经SV40病毒永生化的16HBE细胞株,该细胞株具有较好的遗传稳定性,保留着正常人气道上皮细胞的特定形态和功能[10],体外易于培养,裸鼠体内无致瘤性;同时由于永生化的细胞具备了肿瘤发生多阶段(即启动-促进-发展)的启动阶段的某些特点,而且体外培养细胞可人为控制诱变剂的作用时间、方式等,还可以在体外直接观察细胞的形态改变。因此用其做靶细胞来研究致癌物的致癌作用更具有实际意义。
正常细胞具有接触抑制特性,一般情况下,不具增殖能力而处于分化状态。当细胞癌变时,则失去接触抑制性而呈无限性增殖。细胞转化是一个多因素、多阶段、多途径的过程。无论用化学、物理、病毒或癌基因处理正常人体细胞,一次处理均难以实现恶性转化[11-12],均需要多阶段多次染毒。本实验用1 mg/L MNNG隔代染毒第27次后,从转化灶分离的细胞呈现增殖旺盛,失去接触抑制,细胞堆积生长,至最后堆积成岛屿状。我们进一步选用细胞恶性转化较为可靠的指标——软琼脂克隆形成实验和裸鼠成瘤实验来鉴定细胞恶性转化的程度。结果发现,转化细胞能够在软琼脂中生长,且能在裸鼠体内成瘤,组织病理学证实为低分化鳞状细胞癌。以上结果说明,转化灶分离的细胞已经改变了正常16HBE细胞的生长特性,失去接触抑制呈无限增殖生长的特性而发生转化。
本课题运用RNAi技术沉默16HBE细胞中TERC基因的表达后,随着MNNG处理次数的增加,16HBE-1细胞逐渐获得恶性转化特性,而此时,阴性对照组16HBE细胞并未获得相似的恶性转化特性,提示TERC参与调控细胞的恶性转化。研究表明,在多种肿瘤细胞中均可检测出TERC基因拷贝数的增高,提示TERC基因拷贝数的增高与细胞获得生长优势有关[13]。因此,我们推测,TERC表达较低的16HBE-1细胞在MNNG的多次刺激下,TERC通过某些途径重新表达至一定较高水平,然后激活端粒酶的表达,进而使细胞获得恶性转化的特性。因此,这一假设需要我们在后续实验中进一步研究验证。TERC对端粒酶活性维持的必要性以及在肿瘤发生中的作用使得其成为肿瘤研究领域的一个有效靶点。本研究建立的MNNG诱导的TERC基因缺陷16HBE细胞株恶性转化细胞模型,为研究TERC的功能和表达调控在人类肿瘤发生阶段的分子机制提供了有用的研究模型。
[1] Fukushima M, Shimomura N, Nakamura K, et al. Demonstration of human telomerase reverse transcriptase byinsituhybridization in lung carcinoma[J]. Oncol Rep, 2004, 12(6):1227-1232.
[2] Lu L, Zhang C, Zhu G, et al. Telomerase expression and telomere length in breast cancer and their associations with adjuvant treatment and disease outcome[J]. Breast Cancer Res, 2011,13(3):R56.
[3] Li Y, Ye F, Lu WG, et al. Detection of human telomerase RNA gene in cervical cancer and precancerous lesions: comparison with cytological and human papillomavirus DNA test findings[J]. Int J Gynecol Cancer, 2010,20(4):631-637.
[4] Avilion AA, Piatyszek MA, Gupta J, et al. Human telomerase RNA and telomerase activity in immortal cell lines and tumor tissues[J]. Cancer Res, 1996, 56(3):645-650.
[5] Li Y, Li H, Yao G, et al. Inhibition of telomerase RNA(hTR) in cervical cancer by adenovirus-delivered siRNA[J]. Cancer Gene Ther, 2007, 14(8):748-755.
[6] Chiang YJ, Hemann MT, Hathcock KS, et al. Expression of telomerase RNA template, but not telomerase reverse transcriptase, is limiting for telomere length maintenanceinvivo[J]. Mol Cell Biol, 2004, 24(16):7024-7031.
[7] Hathcock KS, Hemann MT, Opperman KK, et al. Haploinsufficiency of mTR results in defects in telomere elongation[J]. Proc Natl Acad Sci U S A, 2002, 99(6):3591-3596.
[8] Vulliamy T, Marrone A, Goldman F, et al. The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita[J]. Nature, 2001, 413(6854):432-435.
[9] Marrone A, Stevens D, Vulliamy T, et al. Heterozygous telomerase RNA mutations found in dyskeratosis congenita and aplastic anemia reduce telomerase activity via haploinsufficiency[J]. Blood, 2004, 104(13):3936-3942.
[10]Gruenert DC, Finkbeiner WE, Widdicombe JH. Culture and transformation of human airway epithelial cells[J]. Am J Physiol, 1995, 268(3):L347-L360.
[11]张 敬,刘艺敏,张 军,等. 胡萝卜素和维生素C对Ni2O3诱导人肺成纤维细胞转化的保护作用[J].卫生研究,2000,29(4):237-239.
[12]薛晓伟,丰 平,董 坤,等. 氧化应激对卵圆细胞恶性转化的影响及中药的干预作用[J].中国病理生理杂志,2010,26(10):2016.
[13]Cao Y, Bryan TM, Reddel RR. Increased copy number of the TERT and TERC telomerase subunit genes in cancer cells [J]. Cancer Sci, 2008, 99(6):1092-1099.
AmalignanttransformationmodelofTERC-deficient16HBEcellsinducedbyMNNG
ZHU Jun-feng1, HUANG Xiao-rong2, FENG Yu-peng3, ZHOU Jun-yi1
(1DepartmentofBiochemistry&MolecularBiology,2ExperimentalCenterforBasisMedicalTeaching,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China;3DepartmentofUrinarySurgery,AffiliatedXixiangPeople’sHospitalofGuangdongMedicalCollege,Shenzhen518102,China.E-mail:zhoujy@mail.sysu.edu.cn)
AIM: To establish a malignant transformed human bronchial epithelial (16HBE) cell model induced byN-methyl-N’-nitro-N-nitrosoguanidine (MNNG).METHODSA combination plasmid expressing shRNA specific for the human telomerase RNA component (TERC) was transfected into 16HBE cells and G418-resistant stable clone was obtained, named 16HBE-1 cells. The mRNA expression of TERC in 16HBE-1 cells was detected by RT-PCR. 16HBE-1 cells were treated with MNNG at concentration of 1 mg/L for 1 h in every other generation for 27 times until the transforming foci were formed. The cells from the transforming foci were separated and called 16HBE-T cells. Malignancy of 16HBE-T cells was identified by colony formation in soft agar and tumorigenesis in nude mice.RESULTS16HBE-T cells grew in soft agar and turned into tumor in nude mice. The tumor was squamous carcinoma confirmed by histopathological examination.CONCLUSIONThe malignant transformation ofTERC-deficient 16HBE cells is successfully induced by MNNG.
Telomerase RNA; Human bronchial epithelial cells; RNA interference;N-methyl-N’-nitro-N-nitrosoguanidine
R363
A
10.3969/j.issn.1000-4718.2012.07.033
