CD137-CD137L相互作用对ApoE-/-小鼠NFATc1表达的影响*
2012-11-06严金川杨海兵苏红玲徐良洁
严金川, 杨海兵, 苏红玲, 袁 伟, 徐良洁
(江苏大学附属医院心内科, 江苏 镇江 212001)
1000-4718(2012)07-1181-06
2012-01-27
2012-04-01
江苏省科教兴卫工程(No.LJ201116);镇江市社会发展项目(No.SH2010012)
△通讯作者 Tel: 0511-85026169; E-mail: yanjinchuan@hotmail.com
CD137-CD137L相互作用对ApoE-/-小鼠NFATc1表达的影响*
严金川△, 杨海兵, 苏红玲, 袁 伟, 徐良洁
(江苏大学附属医院心内科, 江苏 镇江 212001)
目的观察CD137-CD137配体(CD137L)轴对载脂蛋白E基因敲除(ApoE-/-)小鼠活化T细胞核因子胞浆1型(NFATc1)表达的影响。方法ApoE-/-小鼠动脉粥样斑块模型采用颈动脉硅胶圈植入法;分别采用免疫组化及流式细胞术检测小鼠颈动脉斑块及淋巴细胞NFATc1表达;分别应用RT-PCR和流式细胞技术检测体外培养的小鼠淋巴细胞NFATc1 mRNA和蛋白表达。结果在体情况下应用anti-CD137特异性刺激CD137-CD137L轴后,ApoE-/-小鼠斑块及脾脏中淋巴细胞NFATc1表达增加;体外培养的淋巴细胞刺激CD137-CD137L轴后,淋巴细胞NFATc1 mRNA和蛋白表达明显上调,anti-CD137刺激浓度以20 mg/L时作用最强,作用24 h最明显(P<0.05)。应用Anti-CD137L特异性阻断CD137-CD137L轴能明显抑制NFATc1 mRNA及蛋白表达,浓度在20 mg/L时抑制最强,时间为24 h后抑制最佳(P<0.05)。结论ApoE-/-小鼠体内NFATc1的表达受CD137-CD137L轴调控。
CD137; CD137配体; 活化T细胞核因子,胞浆1型; 动脉粥样硬化
动脉粥样硬化(atherosclerosis, AS)是动脉血管的慢性非特异性炎症反应, AS斑块的发展进程涉及多种炎症细胞、细胞因子之间的相互作用[1-2]。其中T淋巴细胞的激活是AS发生、发展的中心环节。研究表明,体内存在激活T细胞受体-配体信号通路多种途径;CD137分子为肿瘤坏死因子(tumor necrosis factor,TNF)受体-配体超家族的新成员,该分子与其配体(CD137L)结合具有双向信号转导作用,能调节多种免疫细胞的功能,并参与T细胞的活化、增殖及细胞外黏附;众多资料显示CD137-CD137L相互作用参与AS斑块的形成和发展,已经证实人颈动脉斑块中存在CD137高表达,CD137能加速小鼠AS中炎症斑块的进展,敲除CD137基因能抑制载脂蛋白E基因敲除(apolipoprotein E-knockout,ApoE-/-)小鼠AS斑块形成[3-4]。动物实验中也证实刺激CD137-CD137L轴能明显增强ApoE-/-小鼠斑块形成,阻断该轴能抑制AS斑块形成[5]。活化T细胞核因子胞浆1型(nuclear factor of activated T-cells, cytoplasmic 1, NFATc1)最初是其在免疫激活中起重要作用而得名,近来发现NFATc1参与了AS的发生。抑制NFATc1活性能抑制平滑肌的增殖从而阻遏粥样斑块的形成[6-7]。因此,我们推测NFATc1可能是CD137-CD137L轴调控的下游分子。为证实这一设想,我们采用ApoE-/-小鼠AS斑块模型,分别在体内、外刺激和阻断CD137-CD137L轴后,观察NFATc1表达是否受该轴的调控。
材 料 和 方 法
1试剂及动物
实验用ApoE-/-小鼠,体重约20 g,6周龄,购自北京大学动物实验中心。Foxp3 Staining Buffer Set和anti-CD3e、anti-mouse CD137和anti-mouse CD137L抗体购自eBioscience。Anti-NFATc1 monoclonal antibody购自Santa Cruz,mouse CD4-PE、FITC标记Ⅱ抗和同型对照IgG2b购自Multisciences。Trizol mRNA提取液和PCR上、下游引物为上海Sangon生物工程公司产品。逆转录试剂盒及SYBR® Premix Ex TaqTMⅡ 试剂盒均购自TaKaRa,RPMI-1640为Gibco产品。
2ApoE-/-斑块模型的制作及检测
取6周大小ApoE-/-小鼠(该小鼠具有自发形成AS倾向)[8]麻醉后,分离颈总动脉,应用颈动脉硅胶圈植入法快速制作斑块模型[9]。硅胶圈(Dow Corning Corporation)内径为0.3 mm,小鼠颈动脉在80 mmHg灌注压下,颈总动脉的外径平均为0.36 mm,因此使用硅胶圈,可使颈总动脉狭窄30%,高脂饮食喂养2周后可形成明显斑块。术后经高脂饲料喂养2、4、6周及予以抗体干预后,分别手术取下颈动脉,行HE常规染色,观察颈动脉内粥样斑块的变化。
3体内干预CD137-CD137L轴
3.1实验分组 小鼠分为3组:(1)对照组(模型组);(2)刺激组(每只小鼠腹腔注射anti-CD137 200 μg, 每周1次, 连续6周);(3)抑制组(每只小鼠腹腔注射anti-CD137L 200 μg, 每周1次, 连续6周)。
3.2ApoE-/-小鼠颈动脉斑块中NFATc1表达 免疫组化检测小鼠颈动脉斑块NFATc1表达;结果判断依据阳性细胞密度及显色强度计算。每张切片随机选取5个高倍镜视野,各计数细胞100个,计算NFATc1阳性细胞百分率。阳性细胞少于5%记0分;占5%~25%记1分;占26%~49%记2分;占50%~75%记3分;大于75%记4分。显色强度记0~3分:细胞内无着色记0分;细胞内淡黄色记1分;棕黄色记2分;棕褐色记3分;将2项指标评分相加,分4级,即阴性(-)为0~1分;弱阳性(+)为2~3分;中等阳性(++)4~5分;强阳性(+++)大于5分。阴性无表达,弱阳性为低表达,强阳性为高表达。
3.3ApoE-/-小鼠脾脏淋巴细胞表达NFATc1 取脾脏制备单个淋巴细胞悬液,将细胞悬于PBS中,加CD4-PE抗体0.25 μL,4 ℃下孵育30 min,PBS洗2次后,加入0.5 mL破膜剂,4 ℃下孵育30 min,破膜缓冲液洗2次,加NFATc1抗体5 μL(其中一管加1 μL IgG2b作同型对照即阴性对照),4 ℃下孵育1.5 h,破膜缓冲液洗2次,加FITC标记Ⅱ抗1 μL,4 ℃下孵育1.5 h,洗涤后将细胞重悬于0.3 mL PBS中,流式细胞检测并分析。
4体外培养的细胞中干预CD137-CD137L轴
无菌取出小鼠脾脏,剪碎后置于有PBS筛网中轻柔研磨,将研磨液于离心管中离心(4 ℃、500×g离心5 min),弃上清加Ficoll液密度梯度离心法分离淋巴细胞,用PBS将所得细胞沉淀洗涤2遍,计数后RPMI-1640培养液配置成2×109/L的单个淋巴细胞悬液。取细胞悬液置6孔板(6孔板已用10 mg/L anti-CD3e抗体4 ℃包被过夜),设3组:(1)对照组(不加抗体组);(2) anti-CD137 刺激组(10、20、30 mg/L);(3) anti-CD137L抑制组(10、20、30 mg/L)。在37 ℃、5%CO2培养箱中孵育,分别作用8 h、12 h、24 h、36 h收获细胞用于NFATc1 mRNA和蛋白的检测。
5RT-PCR检测淋巴细胞NFATc1mRNA及蛋白表达
按RT-PCR试剂盒提供的方法进行,NFATc1 上游引物5’-GTGGCAGCCATCAACGCCCT-3’,下游引物5’-TACGAGGCCTGTGGCACCGA-3’,产物大小为241 bp。β-actin上游引物5’-TGGAATCCTGTGGCATCCATGAAAC-3’,下游引物5’-TAAAACGCAGCTCAGTAACAGTCCG-3’,产物大小为349 bp。RT- PCR扩增条件:95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 20 s,72 ℃ 30 s,NFATc1进行40个循环,β-actin进行35个循环。结果采用2-ΔΔCt分析。NFATc1蛋白表达采用流式细胞术检测,实验步骤同上。
6统计学处理
结 果
1ApoE-/-小鼠颈动脉斑块形态观察
正常对照组颈动脉内膜光滑平整,管壁呈半透明状;无脂纹和斑块形成,弹力板完整。术后动脉粥样斑块模型小鼠有明显斑块形成,含大量泡沫细胞,富含脂质,可见胆固醇结晶,弹力板变性、断裂,而术后给予anti-CD137刺激剂后斑块更显著,术后给予anti-CD137L抑制剂后斑块较少,见图1。
2体内干预CD137-CD137L轴后颈动脉斑块及淋巴细胞表达NFATc1变化
体内给予anti-CD137刺激CD137-CD137L轴后,免疫组化及流式细胞术检测均显示ApoE-/-小鼠颈动脉斑块及脾脏淋巴细胞中NFATc1表达明显较对照组强; 而应用anti-CD137L抑制该轴后,ApoE-/-小鼠斑块及脾脏淋巴细胞中NFATc1表达显著减弱,见图2、表1和图3。

Figure 1. Mouse carotid sections (HE staining, ×100). A: normal control;B: 2 weeks after carotid collar placement; C: 4 weeks after carotid collar placement;D: 6 weeks after carotid collar placement; E: after carotid collar placement, 6-week treatment with intraperitoneal injection of anti-CD137L;F: after carotid collar placement, 6-week treatment with intraperitoneal injection of anti-CD137.
图1小鼠颈动脉切片HE染色
Figure 2. The expression of NFATc1 in the carotid atherosclerotic plaques ofApoE-/-mice in each group (immunohistochemical staining, ×100). A: normal control; B: control, 6 weeks after carotid collar placement; C: stimulation, carotid collar placement and 6-week treatment with intraperitoneal injection of anti-CD137; D: inhibition, carotid collar placement and 6-week treatment with intraperitoneal injection of anti-CD137L.
图2各组ApoE-/-小鼠颈动脉斑块内NFATc1表达强度

表1 各组ApoE-/-小鼠斑块中NFATc1免疫组化分析结果
*P<0.05vscontrol.


图3流式细胞术检测小鼠脾脏淋巴细胞NFATc1表达
3体外刺激CD137-CD137L轴对淋巴细胞NFATc1mRNA及蛋白表达影响
如图4所示,与对照组相比,使用anti-CD137刺激CD137-CD137L轴后,淋巴细胞NFATc1 mRNA表达上调,以20 mg/L刺激最显著,呈时间依赖性,24 h作用最明显。不同浓度anti-CD137作用24 h后,NFATc1 mRNA表达均明显上调,以20 mg/L浓度最佳(P<0.05),见图4A。以20 mg/L anti-CD137刺激细胞不同时间后,NFATc1蛋白表达在24 h明显升高,36 h下降,见图4B、C。
4体外抑制CD137-CD137L轴对淋巴细胞NFATc1mRNA及蛋白表达影响
如图5所示,与对照组相比,使用抑制型anti-CD137L抑制CD137-CD137L轴后,NFATc1 mRNA表达下调,以20 mg/L最显著,呈时间依赖性,在24 h作用最明显,36 h后作用减弱。不同浓度anti-CD137L作用24 h后,NFATc1 mRNA表达均明显下调,20 mg/L浓度最显著(P<0.05),见图5A。以20 mg/L anti-CD137L抑制细胞不同时间后,NFATc1蛋白表达明显下降,在24 h最显著,见图5B、C。
讨 论
AS是由多种复杂因素及免疫系统参与的慢性非特异性炎症,包括炎症细胞浸润和脂质沉积,其中炎症细胞的相互作用起关键作用,特别是T淋巴细胞介导的免疫应答是一系列炎症反应的中心环节[10],在AS的形成及斑块进展中起关键作用。T细胞识别抗原依赖T细胞表面的膜蛋白分子及其配体介导的共刺激信号。近年来,通过调控T细胞共刺激物,抑制T细胞介导的炎症反应,达到延缓AS发生、发展已经成为当前的研究热点。CD137-CD137L作为激活T细胞信号通路的一对关键共刺激分子,在促进T细胞的增殖和分化、介导T细胞和内皮细胞间的黏附、调节巨噬细胞抗原递呈功能中发挥重要作用。CD137在人类AS斑块中高表达,CD137-CD137L相互作用能加速AS炎症斑块的进展,在CD137基因表达缺陷及单抗封闭CD137L的小鼠均可发现AS斑块面积明显减少,众多研究表明CD137-CD137L轴可能是致AS形成的一个信号级联反应,能促进AS斑块的进展,影响斑块的稳定性。


图4刺激CD137-CD137L轴对体外培养的小鼠脾脏淋巴细胞NFATc1mRNA和蛋白相对表达量的影响
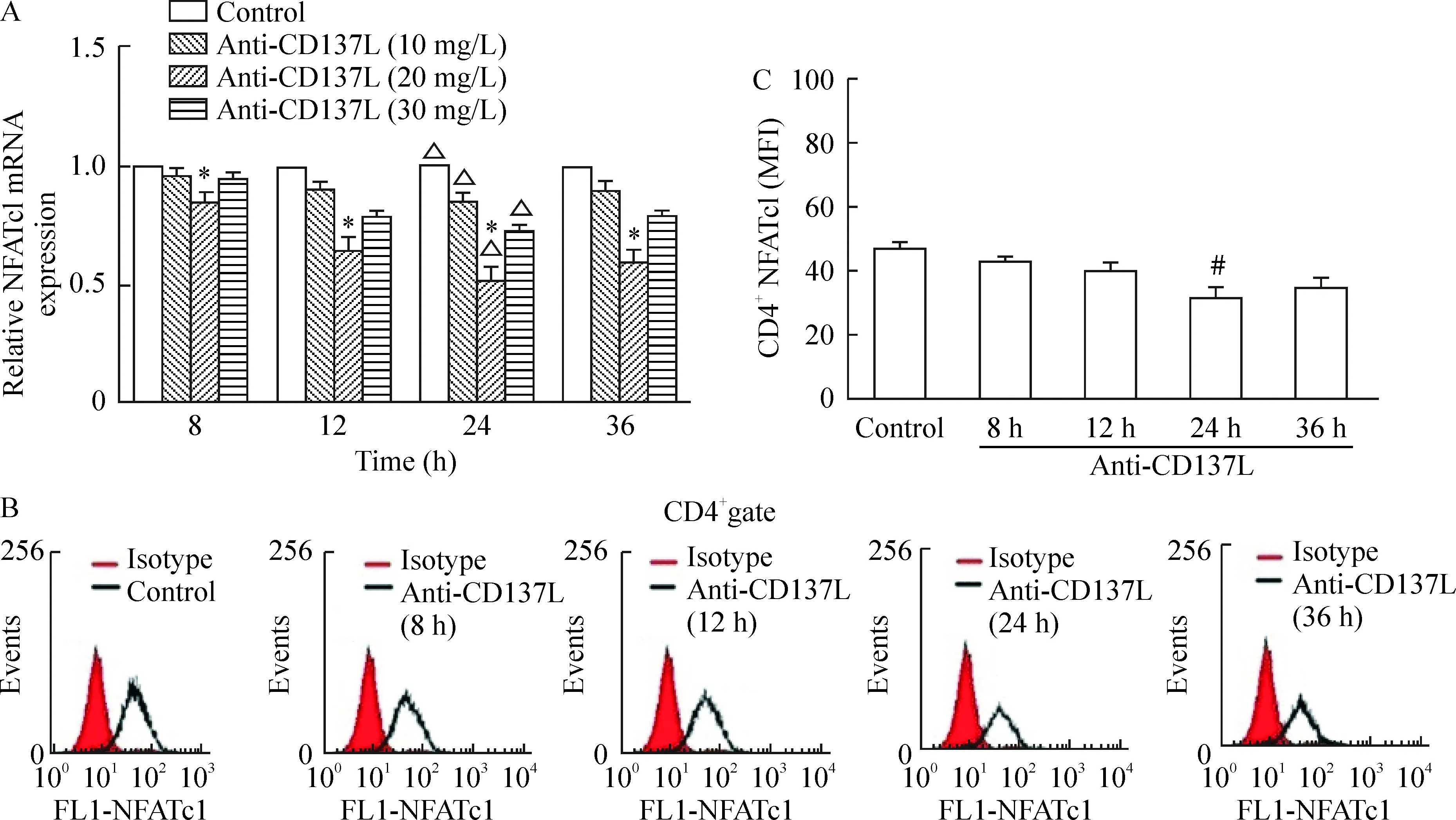

图5阻断CD137-CD137L轴对体外培养的小鼠脾脏淋巴细胞NFATc1mRNA和蛋白相对表达量的影响
NFAT是一类至关重要的核转录因子,调节多种细胞因子的转录水平,参与免疫应答调节、T细胞生长分化等。NFATc1是NFAT家族重要成员之一,最初是其在免疫激活中起重要作用而得名,在外周淋巴细胞中编码相应的蛋白合成,在活化的T细胞和NK细胞中NFATc1表达上调。近年来发现NFATc1参与心血管疾病的发生,抑制NFATc1活性能抑制平滑肌的增殖从而抑制粥样斑块形成。我们体内也证实CD137高表达与冠脉斑块不稳定相关[11-12],因此,我们推测NFATc1是受CD137-CD137L调控动脉粥样斑块进展的下游分子。
本实验中,我们从体内、体外两方面分别刺激和抑制CD137-CD137L轴,观察小鼠NFATc1表达的变化。体外采用ApoE-/-鼠颈动脉硅胶圈植入法快速制作AS斑块模型,明确AS斑块形成的前提下,取未经治疗的ApoE-/-小鼠脾脏淋巴细胞体外培养,应用刺激型anti-CD137和抑制型anti-CD137L分别干预CD137-CD137L轴;体内实验显示ApoE-/-小鼠腹腔注射刺激型anti-CD137后,斑块及脾脏淋巴细胞中NFATc1表达明显增强,而抑制型anti-CD137L干预后;斑块及淋巴细胞中NFATc1表达受到抑制。体外培养ApoE-/-小鼠淋巴细胞后,应用激发型CD137单抗刺激CD137-CD137L轴,进而在体外可进一步扩增活化的T细胞,使胞浆Ca2+浓度升高,启动促分裂素原活化蛋白激酶(MAP激酶)级联反应,使NFATc1在核内表达增加。CD137L单抗与抗原提呈细胞(antigen presenting cell, APC)或B细胞上的CD137L有较强的结合能力,能有效封闭CD137与CD137L的相互作用,阻断共刺激信号传递,NFATc1表达下降。上述结果提示,体内、外刺激和阻断CD137-CD137L轴可在转录及蛋白翻译水平调控ApoE-/-小鼠NFATc1表达。而体外实验所用的淋巴细胞采自未经治疗的ApoE-/-动脉粥样斑块模型小鼠,使得实验得以在动脉粥样硬化疾病的背景下进行,也就进一步证实NFATc1是受CD137-CD137L调控动脉粥样斑块进展的下游分子。尽管体内注射CD137抗体可能会引起小鼠免疫系统功能紊乱,但这一动物模型及实验方法对了解CD137-CD137L在AS的作用和相关机制提供了很多帮助。
AS的发生受局部炎症刺激及全身炎症反应的影响,目前大多数实验是从局部炎症刺激角度探讨AS的源头机制,本研究在明确CD137-CD137L参与AS斑块进展的前提下,从全身炎症反应的角度出发,证实NFATc1是CD137-CD137L信号活化的下游分子。该结果为我们设想能够将AS炎症反应抑制在信号活化阶段,高效预防AS的发生与发展,并为阻断CD137-CD137L通路防治冠心病提供新的源头防治靶点。
[1] Binder CJ, Chang MK, Shaw PX, et al. Innate and acquired immunity in atherogenesis [J]. Nat Med, 2002, 8(11):1218-1226.
[2] Steinberg D. Atherogenesis in perspective: hypercholesterolemia and inflammation as partners in crime [J]. Nat Med, 2002, 8(11):1211-1217.
[3] Olofsson PS, Söderström LA, Wågsäter D,et al. CD137 is expressed in human atherosclerosis and promotes development of plaque inflammation in hypercholesterolemic mice [J]. Circulation, 2008,117(10):1292-1301.
[4] Jeon HJ, Choi JH, Jung IH, et al. CD137 (4-1BB) deficiency reduces atherosclerosis in hyperlipidemic mice [J]. Circulation, 2010, 121(9):1124-1133.
[5] Gotsman I, Sharpe AH, Lichtman AH. T-cell costimulation and coinhibition in atherosclerosis [J]. Circ Res, 2008, 103(11):1220-1231.
[6] Sieber M, Baumgrass R. Novel inhibitors of the calcineurin/NFATc hub - alternatives to CsA and FK506?[J].Cell Commun Signal, 2009, 7:25.
[7] Karpurapu M, Wang D, Singh NK, et al. NFATc1 targets cyclin A in the regulation of vascular smooth muscle cell multiplication during restenosis [J]. J Biol Chem, 2008, 283(39):26577-26590.
[8] 徐 芳, 刘 颖,石 磊,等.载脂蛋白E基因敲除小鼠动脉粥样硬化早期血管外膜成纤维细胞增殖活性增强[J].中国病理生理杂志,2010,26(8):1503-1508.
[9] von der Thüsen JH, van Berkel TJ,Biessen EA. Induction of rapid atherogenesis by perivascular carotid collar placement in apolipoprotein E-deficient and low-density lipoprotein receptor-deficient mice [J]. Circulation, 2001, 103(8):1164-1170.
[10]Hansson GK. Inflammation, atherosclerosis, and coronary artery disease [J]. N Engl J Med, 2005,352(16):1685-1695.
[11]Yan J, Wang C, Du R, et al. OX40-OX40L ligand interaction may activate phospholipase C signal transduction pathway in human umbilical vein endothelial cells [J]. Chem Biol Interact, 2009, 180(3): 460-464.
[12]Yan J, Gong J, Liu P, et al. Positive correlation between CD137 expression and complex stenosis morphology in patients with acute coronary syndromes [J]. Clin Chim Acta, 2011, 412(11-12):993-998.
EffectofCD137-CD137ligandinteractiononexpressionofNFATc1inapolipoproteinE-deficientmice
YAN Jin-chuan, YANG Hai-bing, SU Hong-ling, YUAN Wei, XU Liang-jie
(DepartmentofCardiology,AffiliatedHospitalofJiangsuUniversity,Zhenjiang212001,China.E-mail:yanjinchuan@hotmail.com)
AIM: To observe the effects of CD137-CD137 ligand(CD137L) interaction on the nuclear factor of activated T-cells, cytoplasmic 1 (NFATc1) in apolipoprotein E-knockout (ApoE-/-) mice.METHODSAtherosclerotic plaque model was produced by perivascular carotid collar placement inApoE-/-mice.Invivo, the expression levels of NFATc1 in mouse plaques and lymphocytes were detected by immunohistochemical method and flow cytometry, respectively.Invitro, the expression of NFATc1 at mRNA and protein levels in cultured lymphocytes ofApoE-/-mice was measured by RT-PCR and flow cytometry, respectively.RESULTSInvivo, after CD137-CD137L signaling pathway was stimulated, the expression of NFATc1 was significantly increased in the atherosclerotic plaques and lymphocytes.Invitro, the expression of NFATc1 at mRNA and protein levels in cultured leukocytes ofApoE-/-mice was also significantly increased, with the maximal effect exerted by anti-CD137 monoclonal antibody (mAb) at the concentration of 20 mg/L, and 24 h after stimulation at any concentration (P<0.05). Anti-CD137L mAb significantly inhibited the expression of NFATc1 at mRNA and protein levels in the lymphocytes ofApoE-/-mice, with the maximal effect exerted by anti-CD137L mAb at the concentration of 20 mg/L, and 24 h after stimulation (P<0.05).CONCLUSIONCD137-CD137L interaction can regulate the expression of NFATc1 inApoE-/-mice.
CD137; CD137 ligand; Nuclear factor of activated T-cells, cytoplasmic 1; Atherosclerosis
R392.12
A
10.3969/j.issn.1000-4718.2012.07.006
