不同成瘤性MDCK细胞中FOXN2差异表达验证
2020-12-21敖慧娟石嘉琛阿依木古丽阿不都热依木乔自林
敖慧娟,石嘉琛,阿依木古丽·阿不都热依木,乔自林,杨 琨
(1.西北民族大学 生物医学研究中心甘肃省动物细胞技术创新中心,甘肃 兰州 730030;2.西北民族大学 生物医学研究中心生物工程与技术国家民委重点实验室,甘肃 兰州 730030;3.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
0 引言
MDCK细胞系由Madin和Darby于1958年从美国Cocker Spaniel 母曲架犬的肾脏中分离并培育,通常是以贴壁方式生长的上皮样细胞.由于其病毒感染效率高、增殖快,不易变异,且适应于无血清的生长条件,MDCK细胞系被公认是最适于甲、乙型流感病毒疫苗生产的3种细胞系之一[1-3].由于MDCK细胞本身具有较高的成瘤性,用其生产疫苗的安全性一直存在着争议[4-5].近年来,乔自林等通过单细胞克隆培养和筛选,得到了数株低成瘤性的MDCK细胞株[6],将其与实验室已有的高成瘤性细胞株一并做高通量分析发现,某些经典的肿瘤通路被靶基因激活,其中lncRNA MSTRG.1056.2直接调控ERBB3激活PI3K-Akt通路,促进肿瘤发生[7].为了保证疫苗的安全性,开发低成瘤性 MDCK 细胞系不仅可以减轻下游纯化工艺的难度,还可以从根本上降低以其生产流感疫苗后的接种风险.
FOXN2[8]蛋白被证实与肿瘤的发生、发展密切相关,在某些类型的肿瘤中已经观察到FOXN2的异常表达.当FOXN2被下调时,在T细胞白血病中起抑癌作用,抑制肺癌的肿瘤发生和放射抗性,与放疗或化学疗法治疗的成年成胶质母细胞瘤的不良预后密切相关.FOXN2的沉默可以抑制癌干细胞的间质表型.异位表达FOXN2的表达显着抑制了乳腺癌细胞的迁移和侵袭,并改变了EMT标记物(如E-钙粘蛋白和N-钙粘蛋白)的表达.此外,FOXN2可以转录调节SLUG表达,并且FOXN2的表达与乳腺癌组织中SLUG的表达呈负相关.这些结果表明,FOXN2可能是EMT进展的重要因素,能够促进乳腺癌细胞的迁移和侵袭[9].检测人非小细胞肺癌细胞 A549 和人胚肺成纤维细胞 MRC-5中FOXN2的mRNA 水平,发现其在A549细胞中的表达水平极显著地低于 MRC-5细胞.在A549细胞中过表达FOXN2抑制了细胞的增殖,降低了细胞迁移侵袭能力[10].马佳等人指出,FOXN2沉默可促进肺癌中细胞周期的重新分布和肿瘤发生[11],并发现泛素连接酶β-Trcp可通过作用FOXN2第365位和第369位丝氨酸使FOXN2泛素化降解,进而抑制FOXN2的生物学效应[12].
FOXN2作为一个抑癌基因,可以抑制肺癌A549细胞的生长增殖,可增强肺癌细胞的放疗敏感性.但FOXN2对MDCK细胞成瘤性的影响尚不清楚,因此对不同成瘤性MDCK细胞中FOXN2差异表达及功能的研究具有重要意义.
1 材料与方法
1.1 主要材料与器材
DMEM、MEM 、悬浮培养基、磷酸缓冲盐溶液(PBS)、0.25% 胰蛋白酶溶液(兰州百灵生物技术有限公司 ),新生牛血清、胎牛血清(兰州民海生物工程有限公司),台盼蓝,T25 细胞培养瓶( Corning ),TRIzolTMReagent(Thermo);EVOM-MLV反转录试剂盒(艾科瑞生物公司),All-in-OneTMqPCR Mix-实时荧光定量PCR检测试剂盒(GeneCopoeia,Inc.).
倒置相差显微镜 CK-41 (日本 Olympus),细胞计数仪 IC1000 (Countstar),移液枪 20~200 μL、1 mL Easypet (eppendorf),液氮罐 YDS-100-200F (乐山市东亚机电工贸有限公司),CO2细胞培养箱 311 (Thermo),普通冰箱(2~8 ℃) SC387 、超低温冰箱(-80 ℃) DW-86L386(青岛海尔股份有限公司),台式低速离心机 TDL-80-2B (上海安亭科学仪器厂),普通PCR扩增仪CLASSC K960-Thmal Cycler(Heal force),实时定量基因扩增仪 CFX96TMReal-Time System(BIO-RAD).
1.2 方法
1.2.1 细胞的培养
本实验所选取的不同成瘤性细胞株是由课题组在前期实验中驯化所得.前期裸鼠成瘤性实验中发现:从ATCC引进的贴壁型MDCK-A和由其驯化所得悬浮型MDCK-B在裸鼠成瘤性实验中的成瘤率均高达100%(10/10).而将MDCK-A通过有限稀释法制备得到的贴壁型单克隆细胞株MDCK-C的裸鼠成瘤率为10%(1/10).贴壁型MRC-5细胞由兰州民海生物工程有限公司赠送,其裸鼠成瘤率为0(0/10).因此,选用MRC-5作为阴性对照.将本实验室已有的不同成瘤性MDCK细胞从液氮罐中取出,置于37 ℃温水中直至完全融化,将悬浮型MDCK-B用无血清培养基置于37 ℃,5%CO2,转速为120 r/min的摇床上培养,并将贴壁型细胞MDCK-A,MDCK-C,用含10%新生牛血清的DMEM完全培养基,对照组MRC-5细胞含10%新生牛血清的MEM培养基,置于37 ℃,5%CO2恒温培养箱中培养.
1.2.2 细胞总RNA的提取
弃掉细胞培养瓶中的培养液,用PBS洗3遍,并吸去残余的PBS.加入TRIzol试剂,用枪尖反复用力吸打裂解细胞,室温放置5 min以彻底解离蛋白复合体.将细胞与裂解液分装在2个1.5 mL的已灭菌的无RNA酶PE管中,加入氯仿使其与TRIzol的体积比为1︰5.用力上下摇20 s,室温静置3~5 min,12000×g4℃离心10 min,并小心吸取上层水相到新的已灭菌的无RNA酶PE管中,加入100%异丙醇到水相中,使得异丙醇与TRIzol的体积比为1︰2.室温放置8~10 min以沉淀RNA.12000×g4℃离心5 min后,小心弃上清,防止将RNA沉淀一并弃掉.同1 mL75%的无水乙醇漂洗RNA沉淀,即无水乙醇与TRIzol的体积比为1︰1.将无水乙醇中的RNA以7500×g4℃离心5 min.小心吸去无水乙醇,并打开EP管的盖子,室温干燥RNA沉淀5~8 min,注意不可完全干燥.用DEPC水30~50 μL溶解RNA沉淀,用枪尖反复吹打以彻底增加RNA溶解.吸取1~3 μL RNA测量所提RNA样品A260/A280的OD值.
1.2.3 Real Time PCR
在做Real Time PCR 之前,需要将样品RNA反转录为cDNA.本实验用的是艾科瑞生物公司的EVOM-MLV反转录试剂盒.

表1 去除gDNA试剂及反应体系
将样品混匀后进行短暂离心,再将样品放入PCR 仪中42 ℃ 2 min.取出样品放置在冰上加入发转录试剂.

表2 反转录试剂及反应体系
混匀后短暂离心,再将样品放入PCR 仪中37 ℃15 min,85 ℃5 s.以上过程就是将样品RNA反转录为cDNA的全过程.将得到的cDNA保存于-20 ℃试剂中.利用Primer 5.0软件根据目的基因FOXN2( GeneID: 3344)和内参基因GAPDH(GeneID: 2597)设计所需要的引物,见表3.

表3 基因引物序列信息
将引物系列送到甘肃一棵树生物有限公司合成后,再用GeneCopoeia,Inc.的All-in-OneTMqPCR Mix-实时荧光定量PCR检测试剂盒对目的基因进行检测.其反应体系见表4.

表4 荧光定量PCR反应体系
反应条件为95 ℃预变性10 min;95 ℃变性10 s;60 ℃退火20 s;72 ℃延伸15 s;95 ℃10 s到72 ℃15 s共40个循环.溶解曲线分析为65 ℃10 s,95 ℃20 s.注意:每个样品至少要做3个平行组.随后摇匀,瞬时离心后,用BIO-RAD CFX96TMReal-Time System 分析目的基因在不同成瘤性MDCK 细胞中的表达量.2 h后可以根据反应结果使用相对定量分析F=2-ΔΔCt进行数据分析.其计算方法为ΔCt=目的基因Ct值-内参基因Ct值;-ΔΔCt=对照组ΔCt平均值-各样品ΔCt值;最后2-ΔΔCt反映各样品相对对照组样品目的基因的相对表达水平.利用GraphPad Prism 5作图分析目的基因的表达量并作差异性分析.
2 结果
2.1 不同成瘤性细胞的复苏与培养
将细胞培养48小时后置于显微镜下用4倍目镜观察细胞的生长状况,如图1所示.所培养细胞生长状态良好,细胞轮廓清晰,悬浮细胞的活力高、结团少、均匀性好.其中MRC-5(图A)成纤维状生长;贴壁型MDCK-A(图B)成上皮样生长;悬浮型MDCK-B(图C)呈圆形悬浮生长于无血清培养基中;MDCK-C(图D)成上皮样生长,可用于后续实验.

A:阴性对照细胞MRC-5 B:贴壁型细胞MDCK-A C:悬浮型细胞MDCK-B D:单克隆贴壁型细胞MDCK-C
2.2 TRIzol Reagent 提取不同成瘤性细胞总RNA的纯度分析
将提取的RNA进行纯度分析发现,所有样品OD值均在1.8~2.0之间,可用于后续实验,具体结果如表5所示.

表5 样品纯度检测结果
2.3 不同成瘤性细胞中FOXN2基因表达量的分析
RT-PCR检测结果显示,所设计的引物特异性高,定量结果重复性好(图2).以MRC-5为对照组,利用GraphPad Prism 5作图分析目的基因的表达量并作差异性分析发现: FOXN2在和MDCK-C细胞中的 P value< 0.0001,差异极显著(图3),且在高成瘤性MDCK-A、MDCK-B与低成瘤性MDCK-C细胞之间的表达存在差异(图4).这说明FOXN2在细胞内的表达量可能与细胞成瘤性成正相关,可为进一步研究FOXN2在MDCK细胞成瘤性的作用机制提供理论参考.

图2 引物特异性结果
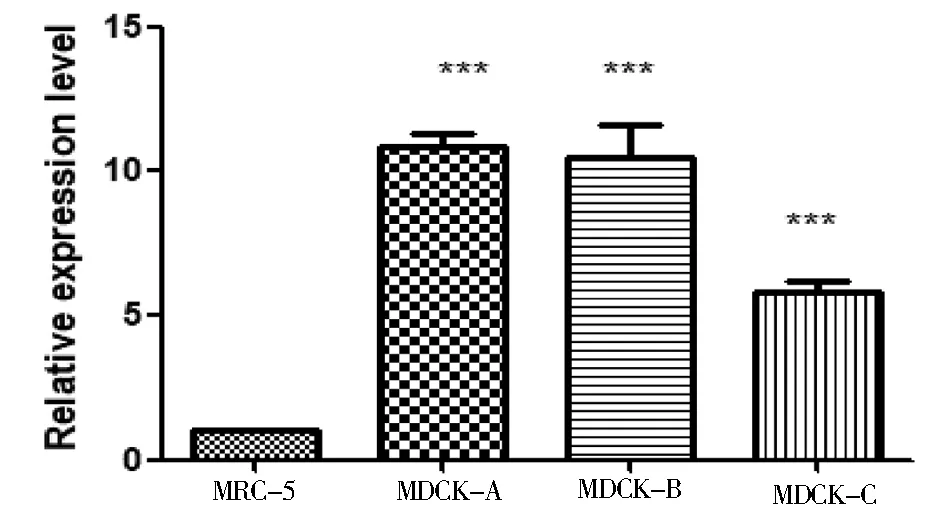
图3 FOXN2在不同成瘤性MDCK细胞中的表达结果
3 分析与讨论
FOXN2被证实与多种肿瘤的发生发展相关.在研究宫颈癌组织和细胞系中发现lncRNA Wilms肿瘤1反义RNA(WT1-AS)显著下调.功能分析表明,WT1-AS的过表达显著抑制宫颈癌细胞的生长、迁移和侵袭.荧光素酶报告基因分析的结果证实,miR-203a-5p是WT1-AS的直接靶标.而FOXN2被鉴定为miR-203a-5p的直接靶基因[13].在接受化学疗法或放射疗法的患者中,TCGA验证队列中的低FOXN2 mRNA和不良结局相关[14].为了鉴定拷贝数突变靶向的新型癌症相关基因,进行T细胞急性淋巴细胞白血病(T-ALL)细胞系的基因组分析,识别了肿瘤抑制基因(TS)FBXO11和FOXN2.FBXO11,FOXN2和FOXN3的定量表达分析证实了已鉴定细胞系中转录水平的降低.生物信息学分析显示,FOXN2和FOXN3与同源盒基因ZHX1同时减少.实验证明,FOXN2和FOXN3都能直接激活ZHX1的转录[15].但FOXN2在MDCK细胞成瘤性的研究中少有报道.在本研究中,我们挑选了前期实验室冻存的不同成瘤性细胞,旨在探究FOXN2在不同成瘤性细胞中的表达量关系,进而为利用基因工程手段构建稳定的低成瘤细胞系奠定基础.结果表明,FOXN2在高成瘤性MDCK-A和MDCK-B与低成瘤性细胞株MDCK-C之间的表达量具有差异性(图4).这由MDCK细胞群的多样性扩展到了其成瘤性蛋白表达的差异,并为进一步开展FOXN2在MDCK细胞中的成瘤性机制研究提供了参考信息.

图4 FOXN2在不同成瘤性 MDCK细胞中的差异表达
4 结论
本研究采用前期裸鼠成瘤性实验中的不同成瘤性MDCK 细胞为研究原材料,结果表明FOXN2在高成瘤性MDCK细胞株MDCK-A和MDCK-B中的表达量远高于低成瘤性细胞株MDCK-C.这由MDCK细胞群的多样性扩展到了其成瘤性蛋白表达的差异,并为进一步开展FOXN2在MDCK细胞中的成瘤性机制的研究提供了参考信息.另外,本研究结果将来可用于表征不同MDCK细胞的克隆及驯化,为研究MDCK细胞肿瘤生物学特征,以及评估MDCK细胞作为疫苗生产的细胞基质等提供基础.
