Msi1 siRNA对人结肠癌SW-480细胞迁移和侵袭能力的影响
2012-11-06魏建国孙爱静
魏建国 赵 芳 孙爱静
全世界范围内,结肠癌仍然是消化道最常见的恶性肿瘤之一,极易发生局部侵袭或远处转移,有些甚至在早期就能发生淋巴结转移[1]。因此,阐明其侵袭和转移机制,是目前根治结肠癌的关键措施之一。Msi1(musashihomolog 1)是一种RNA结合蛋白,在干细胞的维持和中枢神经系统的发展过程中扮演着十分重要的角色[2]。新近的研究结果表明,Msi1在许多肿瘤中都表达,Msi1基因不仅仅是肿瘤干细胞的特异性标志物,而且有可能在肿瘤的发生和发展过程中是一个主要调节者[3~5]。
我们前期的实验发现Msi1 siRNA不但可以使人结肠癌SW-480细胞Msi1基因的表达下调,而且还可以使其生长增殖活性受到抑制[6]。为此,本实验在前期工作的基础上,首先通过siRNA沉默Msi1,然后利用Western blot、细胞免疫化学、细胞划痕实验、细胞侵袭实验等技术来研究沉默Msi1后对人结肠癌SW-480细胞迁移和侵袭能力的影响,并初步探索其作用机制。
材料与方法
1.材料:SW-480细胞由南华大学肿瘤研究所提供;兔抗人Msi1单克隆抗体购自Invitrogen公司,辣根过氧化酶标记羊抗兔二抗、兔抗人β-actin单克隆抗体均购自Santa Cruze公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;Transwell小室购自美国Costar公司;siRNA片段购自上海锐博生物有限技术公司。
2.细胞培养:SW-480细胞培养于含10%小牛血清的RPMI1640培养液中,置于37℃和5%的CO2培养箱中培养,当细胞长到培养瓶约80%左右时用2.5g/L胰蛋白酶消化传代,并在显微镜下观察,如有细胞间隙增大,胞质回缩后立即倾去胰酶,加适量含血清培养液吹打成单细胞悬液,调整细胞浓度用于实验。
3.RNA干扰实验:轻轻摇匀 Lipo2000,用不含血清的DMEM分别稀释Lipo2000和siRNA,轻轻混匀,室温下孵育5min;将稀释的Lipo2000和稀释的siRNA轻轻混和,室温培养20min以形成siRNA-Lipo2000混和物。取对数生长期的SW-480细胞1×105/孔接种于6孔板中,用不含抗生素的培养基培养,当细胞密度达30% ~50%左右时转染。将siRNALipo2000混和液加入培养孔中,并用无抗生素,无血清的培养基培养,放入37℃的CO2培养箱中培养6h后,更换成有血清的培养基继续培养。
4.Western blotting实验:将1×105个SW-480细胞接种于6孔板中,转染48h后提取总蛋白,20微升/孔的蛋白量体积上样,加入上样缓冲液置于100℃煮沸3min后行SDSPAGE凝胶电泳。当溴酚兰指示剂到达分离胶下部时,立即断开电源并取下凝胶,置于缓冲液中浸泡5min后将总蛋白转移到PVDF膜上,依次孵育Ⅰ、Ⅱ抗,暗室中用蛋白荧光检测试剂盒显示结果于X线片,β-actin作为内参,进行Western blot分析。
5.免疫细胞化学检测:先制作细胞爬片,用95%的乙醇固定15min,PBS冲洗10min;加50μl过氧化酶阻断剂室温孵育8 min;PBS冲洗10 min;加50μl非免疫性动物血清孵育3min;弃去液体不冲洗;再加50μl一抗于4℃孵育过夜;PBS冲洗10 min;加50μ的二抗室温孵育10min,PBS冲洗10min;加50μl链霉素抗生物素蛋白-过氧化酶溶液孵育10min;PBS洗10min;加80μl新鲜配制的DAB溶液显色2min;依次经双蒸水冲洗,苏木素复染,乙醇脱水,二甲苯透明等步骤,最后用中性树胶封片后置于显微镜下观察。
6.细胞划痕实验:将SW-480细胞(1×105)接种于6孔板中转染细胞,当细胞长至80%左右且呈单层贴壁生长时,用10μl的Eppendorf Tip头在单层细胞上垂直划过,用PBS冲洗2次后继续培养,24h后置于倒置显微镜下观察伤口愈合情况,并计算划痕距离。实验重复3次,计算迁移率=(原划痕宽度-现划痕宽度)/原划痕宽度。
7.细胞侵袭实验:将无血清的RPMI1640培养基和10mg/m l的Matrigel以5∶1的比例混合,以25微升/孔平铺于 Transwell小室的聚碳酸酯微孔膜上,放于超净工作台内用紫外线照射10h。将含细胞数2×105个的400μl各组细胞悬液分别接种到不同的小室内,再将小室放在预先放入含趋化因子的培养基500μl的24孔板中;再置于37℃和5%CO2的恒温细胞培养箱中培养24h。最后将液体吸出,用棉签擦净上室细胞,膜下层细胞用95%乙醇固定20min后进行结晶紫溶液染色,倒置显微镜下观察并计数,实验重复3次。侵袭抑制率(%)=[(对照组穿膜细胞数-处理组穿膜细胞数)/对照组穿膜细数]×100%。
8.统计学方法:数据用SPSS 13.0统计分析软件包分析,以(x±s)表示,进行one-way ANOVA检验及两个独立样本的t分析,P<0.05为差异有统计学意义。
结 果
1.Western blot检测转染前后相关蛋白情况:如图1和图2所示,Msi1 siRNA组SW -480细胞内Msi1和MMP-9蛋白表达都减少,与空白对照组、脂质体组和阴性对照组相比,差异具有统计学意义(P<0.05);而在空白对照组、脂质体组和阴性对照组细胞中Msi1和MMP-9蛋白表达却无明显改变(P >0.05)。
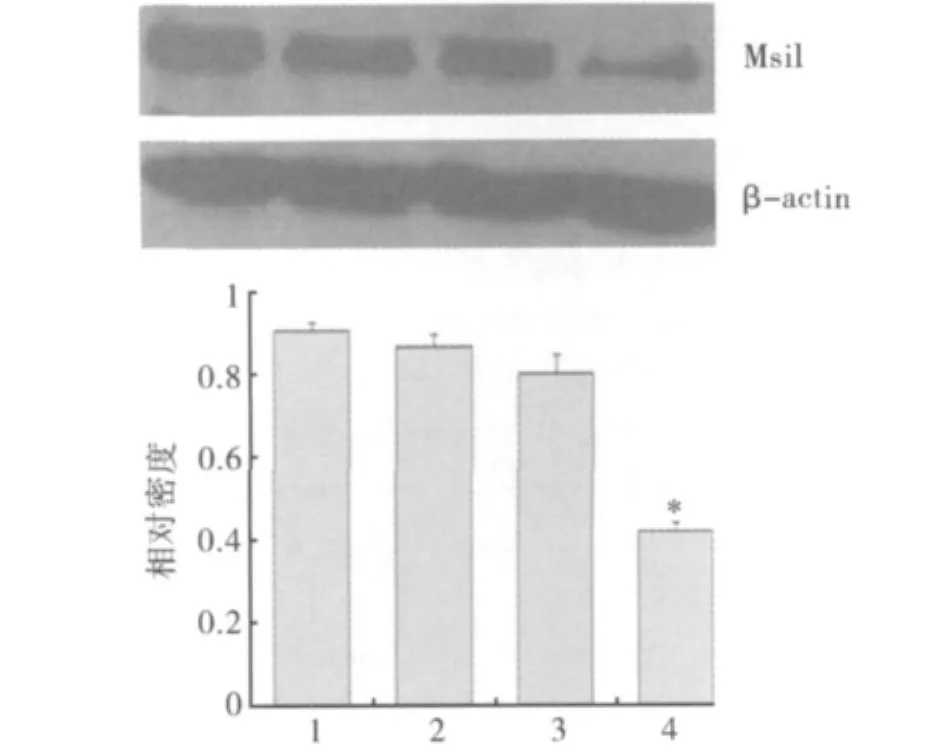
图1 Msi1 siRNA对SW-480细胞Msi1蛋白表达的影响
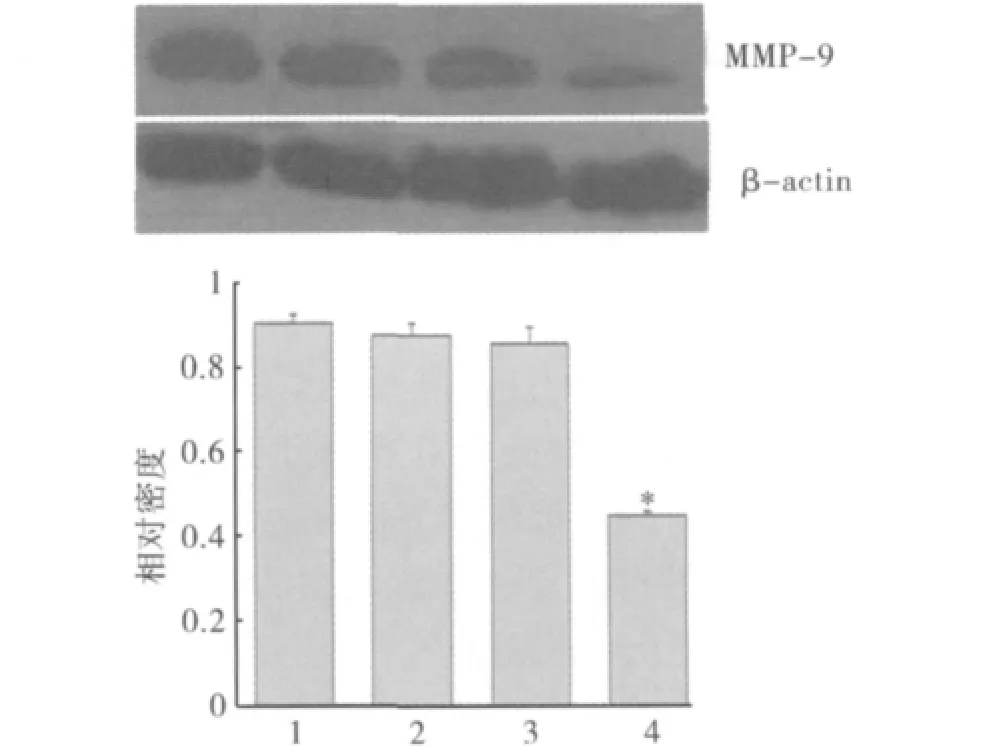
图2 Msi1 siRNA对SW-480细胞MMP-9蛋白表达的影响
2.免疫组化观察转染前后MMP-9蛋白的表达情况:如图3所示,MMP-9蛋白在SW-480细胞胞质中呈强阳性表达,经Msi1 siRNA作用48h以后,MMP-9蛋白的表达与空白对照组、脂质体组和阴性对照组相比明显下降。
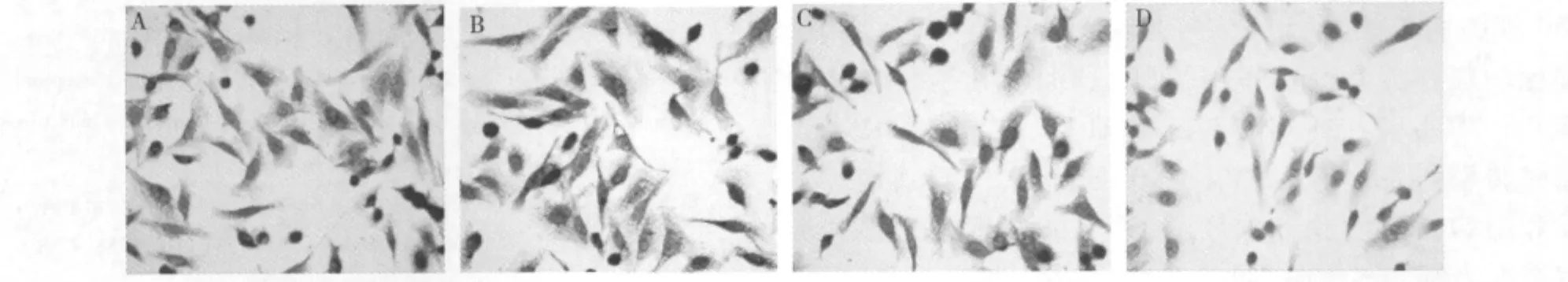
图3 Msi1 siRNA对SW-480细胞MMP-9蛋白表达的影响(×400)
3.Msi1 siRNA对SW-480细胞迁移的影响:人结肠癌SW-480细胞转染Msi1 siRNA后,与空白对照组、脂质体组和阴性对照组细胞比较,其细胞的划痕伤口愈合速度明显减慢(P<0.05,表1)。
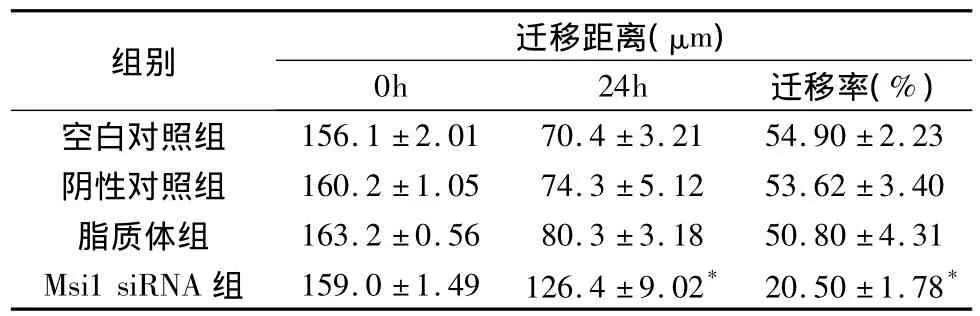
表1 Msi1 siRNA对SW-480细胞迁移距离的测定
4.Msi1 siRNA对SW-480细胞侵袭的影响:人结肠癌SW-480细胞转染Msi1 siRNA后,其穿透聚碳酸脂膜的细胞数(26.32±1.63个)明显低于空白对照组(89.6 ±1.32 个)、脂质体组(83.20 ±2.10个)和阴性对照组(86.7±2.18个)(P<0.05,表2)。
讨 论
结肠癌细胞的迁移和侵袭是影响患者生存预后最为关键的因素之一,因此明确其迁移和侵袭的发生机制,抑制其迁移和侵袭的能力成为目前根治结肠癌的重要手段之一,而肿瘤细胞的迁移侵袭必须依靠细胞外基质蛋白的降解,与其最为密切的是 MMP家族,研究表明MMP-9在肿瘤的迁移和侵袭过程中扮演着重要的角色[7]。MMP-9可通过降解细胞外基质从而促进肿瘤细胞的迁移和侵袭[8]。目前结肠癌的分子靶向性治疗主要是针对致癌过程中的一些关键因子对其进行干扰,沉默其表达而达到抑制肿瘤细胞增殖、侵袭和转移及促进细胞凋亡的目的,也为结肠癌的治疗提供了新的思路[9]。

表2 Msi1 siRNA对SW-480细胞侵袭细胞计数
Msi家族是RNA结合蛋白中进化比较保守的家族群,在哺乳动物中包含分别由Msi1和Msi 2基因编码的Msi1和Msi2两种蛋白[10]。研究表明,Msi1在子宫内膜癌、肝癌、膀胱癌、胶质母细胞瘤、视网膜母细胞瘤、神经胶质瘤、星形细胞瘤中高表达,其作用是促进肿瘤细胞的增殖、抑制肿瘤细胞的凋亡[11]。但Msi1在肿瘤细胞中的功能仍未明确,有研究表明Msi1是通过维护周期性依赖性蛋白激酶抑制剂p21CIP1的功能和增强notch通路的活性从而达到维持肿瘤干细胞自我更新的能力[12]。
我们的前期实验发现,Msi 1在人结肠癌SW-480细胞中有表达,沉默Msi1对人结肠癌SW-480细胞增殖有负性调节作用,可明显抑制其生长和增殖[6]。本实验在前期实验的基础上,将Msi1 siRNA瞬时转染到人结肠癌SW-480细胞后,细胞划痕实验和细胞侵袭实验分别显示:SW-480细胞迁移和侵袭能力都明显下降,同时Western blot结果发现,沉默Msi1基因后,不仅使Msi1蛋白表达水平降低,而且使MMP-9蛋白表达水平也明显降低,进一步说明沉默Msi 1后,由于MMP-9的减少,对细胞外基质的降解进一步减少,从而使得人结肠癌SW-480细胞迁移和侵袭能力的降低,这与免疫细胞化学实验结果相符合。本实验表明沉默Msi1后,SW-480细胞的迁移和侵袭能力降低,和MMP-9蛋白表达下调密切相关,但其作用机制需要进一步的研究。
综上所述,沉默Msi1基因不仅可以下调人结肠癌SW-480细胞中Msi1和MMP-9蛋白的表达,而且还可以抑制其迁移和侵袭的能力。Msi1基因可否成为一个有效的基因治疗靶点从而被用于肿瘤的分子靶向治疗,还有待于基础和临床的进一步研究。
1 Dotan E,Cohen SJ.Challenges in themanagement of stageⅡ colon cancer[J].Semin Oncol,2011,38(4):511 - 520
2 Morgan SC,Yasin S,Uwanogho D,et al.Positional specification in a neural stem cell line involvesmodulation ofmusashi1 expression[J].Stem Cells Dev,2010,19(4):579 -592
3 Nikpour P,Emadi-Baygi M,Steinhoff C,et al.The RNA binding protein musashi1 regulates apoptosis,gene expression and stress granule formation in urothelial carcinoma cells[J].JCellMolMed,2011,15(5):1210-1224
4 Robert IG,Wang XY,Yuan HY,etal.Musashi1:a stem cellmarker no longer in search of a function [J].Cell Cycle,2008,7(17):2635-2639
5 De Sousa Abreu R,Sanchez-Diaz PC,Vogel C,etal.Genomic analyses of musashi1 downstream targets show a strong association with cancer related processes[J].JBiol Chem,2009,284(18):12125 -12135
6 魏建国,赵芳,孙爱静.Msi1 siRNA对人结肠癌SW-480细胞增殖的影响[J].临床与实验病理学杂志,2012,28(2):801 -804
7 Streit M,Schmidt R,Hilgenfeld RU,et al.Adhesion receptors in malignant transformation and dissemination of gastrointestinal tumors[J].JMol Med,1996,74(5):253 -268
8 Watanabe H.Extracellularmatrix-regulation of cancer invasion and metastasis[J].Gan To Kagaku Ryoho,2010,37(11):2058 -2061
9 Asayama M,Kadowaki S,Yamaguchi K.Issues ofmolecular targeted therapies in combination with chemotherapy in metastatic colorectal cancer[J].Nihon Rinsho,2011,69(3):464 - 471
10 Sakakibara S,Nakamura Y,Satoh H,et al.Rna- binding protein musashi2:developmentally regulated expression in neural precursor cells and subpopulations of neurons in mammalian CNS[J].JNeurosci,2001,21(20):8091 -8107
11 Sharma P,Cline HT.Visual activity regulates neural progenitor cells in developing xenopus CNS through musashi1[J].Neuron,2010,68(3):442-455
12 Wang XY,Yin Y,Yuan H,etal.Musashi1modulatesmammary progenitor cell expansion through proliferin-mediated activation of the Wnt and Notch pathways[J].Mol Cell Biol,2008,28(11):3589 -3599
