内质网应激参与细胞脂肪变性的研究
2012-11-06李伟平施杰民戴利成刘春燕
刘 江 李伟平 施杰民 戴利成 刘春燕 丁 健 唐 涛
近年来,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)发病率日益升高,已经成为潜在重大疾病隐患。NAFLD包括单纯性脂肪肝、脂肪性肝炎、脂肪性肝炎相关的肝硬化3个病理阶段[1]。目前的研究大多是针对脂肪性肝炎,往往忽视单纯性脂肪肝的研究。最近有一项关于胰岛素增敏剂罗格列酮治疗脂肪性肝炎的随机对照的扩展研究发现,尽管罗格列酮能够缓解细胞脂肪变性和改善胰岛素抵抗,但是不能改善肝脏的纤维化和炎症程度[2]。因此学者们提出改善胰岛素抵抗是否有助于改善脂肪性肝炎的疑问,同时也提出了是否应该把干预靶点提前到疾病的更早阶段——单纯脂肪变性。因此,单纯脂肪变性作为良性病变而无需治疗的观点已受到挑战。
内质网应激是指未折叠的蛋白质在内质网腔内聚集和细胞内钙离子自我平衡的失衡状态。氧化应激、化学性毒物损害、肝细胞病毒感染、代谢失衡以及滥用药物和酗酒都可以导致内质网应激的发生[3,4]。内质网应激已被证实参与多种疾病的分子机制,包括肥胖和2型糖尿病,后两者都是NAFLD的高危因素,并且肥胖者往往同时合并有血浆游离脂肪酸升高。然而没有见到关于内质网应激是否参与了游离脂肪酸诱导的细胞脂肪变性的研究。既往研究表明,保存和恢复内质网的功能可能是改善NAFLD的治疗手段,但没有见到关于治疗性药物比如二甲双胍对内质网应激影响的研究[5]。
本文利用游离脂肪酸诱导 HepG2细胞建立NAFLD 的单纯脂肪变性阶段的体外细胞模型[6,7];明确内质网应激是否参与了脂肪肝的细胞脂肪变性过程;阐述内质网应激与SREBP1c的关系;用二甲双胍干预细胞脂变,探讨其是否能改善内质网应激以及这个过程中可能涉及的机制。
材料与方法
1.材料:10%胎牛血清(杭州四季青生物工程材料有限公司),MEM培养基(Gibco,美国),cell lysis,BCA Protein Assay Reagent(PIERCE,美国),甘油三酯试剂盒(温州津玛生物有限公司),RT-PCR试剂盒(Takara,大连),油酸、棕榈酸以及二甲双胍(Sigma,美国),GRP78(78KD Santa Cruz,美国)、SREBP1(68KD,ABCAM,美国)。
2.方法:(1)细胞培养和处理:HepG2细胞用含有10%胎牛血清的MEM培养基、37℃、5%CO2恒温培养箱中培养72h,细胞约70% ~80%融合度时,更换培养液。实验分为4组,空白对照组(C组)换用新鲜MEM培养基;二甲双胍组(MET组)换用含有2mmol/L二甲双胍的培养基;游离脂肪酸组(FFA组)换用含有1mmol/L游离脂肪酸混合物(2∶1油酸∶棕榈酸)的培养基;干预组(FFA+MET组)换用含有2mmol/L二甲双胍和1mmol/L游离脂肪酸混合物的培养基。实验重复3次,每次1瓶75cm2细胞。诱导24h收获细胞,检测细胞活力和甘油三酯。半定量 RT-PCR检测GRP78、SREBP1cmRNA 的表达,Western blot检测 GRP78、SREBP1c蛋白水平表达。(2)细胞活力测定:诱导24h后,PBS洗涤,以0.25%胰酶/0.02%EDTA消化,离心,收获细胞,取细胞悬液0.1m l加入0.3m l1%台盼蓝染液,混匀,取 20μl从盖玻片一侧加入到盖玻片下,在显微镜下以10×物镜观察计数四角大方格中的细胞数。细胞存活百分率(%)=(四角大方格中的活胞数/四角大方格中的活胞数+死细胞)×100%。(3)蛋白定量和脂质测定:PBS洗涤细胞后,加入cell lysis裂解细胞,放在冰上30min,然后10000r/min离心30min,取上清检测用来甘油三酯水平和GRP78以及SREBP1蛋白水平。用BCA Protein Assay Reagent定量蛋白。参照甘油三酯检测试剂盒说明书检测甘油三酯水平。(4)RT-PCR:Trizol提取HepG2细胞总RNA,取6.0μl用二步法RT-PCR试剂盒行反转录得到20μl cDNA,检测 GRP78,SREBP1c,和 β -actin的表达。引物由上海生工生物工程技术服务有限公司合成。各引物序列为:GRP78:5'-AATGTCTTTGTTTGCCCACC-3'和 5'-TCCTATGTCGCCTTCACTCC-3';SREBP1c:5'-GGGCTGGGGTAGCCTAAC-3'和5'-CGCGGAGCCATGGATTGC-3';βactin:5'-CATAGTCCGCCTAGAAGC -3'和 5'-GTTGCTATCCAGGCTGTG-3'。PCR 反应参数为:94℃ 5min,94℃ 30s,58℃30s,72℃ 30s,35个循环,最后72℃ 5min。β -actin 引物作为所有基因的内对照。产物用1.5%琼脂糖凝胶电泳分析。用PDQuestTM半定量分析比较各个PCR产物条带灰度。(5)Western blot:每个标本取60μg蛋白,100℃加热5min,点样,10%SDS聚丙烯酰胺凝胶电泳,然后转膜、封闭,加入GRP78、SREBP1一抗,洗涤,加入二抗后洗涤,用ECL显色、曝光、定影,然后将条带扫描,定量分析GRP78和SREBP1蛋白的表达。
3.统计学方法:实验重复3次。采用SPSS 11.0软件分析,数据以均数±标准差(x±s)表示。数据分析采用单因素方差分析,并用LSD检验进行post hoc多重比较。二甲双胍对内质网应激的影响采用配对t检验。P<0.05为差异有统计学意义。
结 果
1.细胞形态和活力:显微镜观察各组HepG2细胞形态均为不规则或圆形。台盼蓝染色法观察细胞活力。空白对照组、二甲双胍组、游离脂肪酸组、干预组的细胞活力分别为(95.33±1.10)%,(94.33±1.50)%,(94.67 ±1.50)%,(94.0 ±1.0)%。4 组之间没有显著性差异(P >0.05,F=0.556)。
2.脂肪变性细胞内脂质含量以及二甲双胍对其的影响:肝细胞脂肪变性的特点是甘油三酯在细胞内的聚集。空白对照组、二甲双胍组、游离脂肪酸组的TG含量分别为 63.33±24.66、76.67±14.01和298.00±59.63mmol/mg蛋白,游离脂肪酸组的脂肪变性的细胞内TG含量较空白对照组和二甲双胍组明显升高(P<0.05)。而干预组的TG含量较游离脂肪酸组有所降低,但是没有显著性差异(表1、表2)。
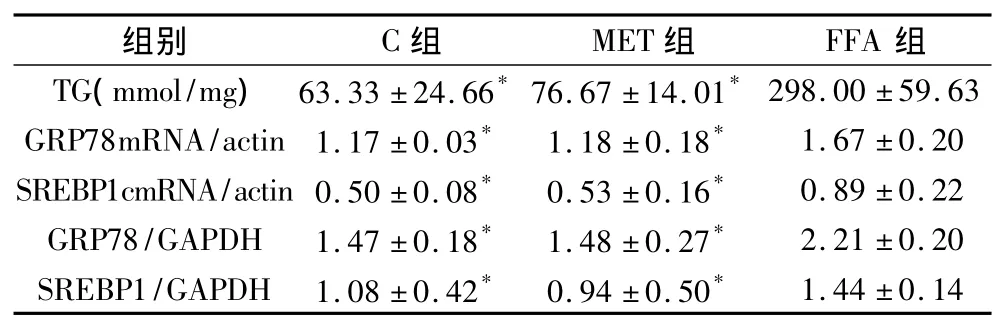
表1 不同组别的TG、GRP78、SREBP1c比较
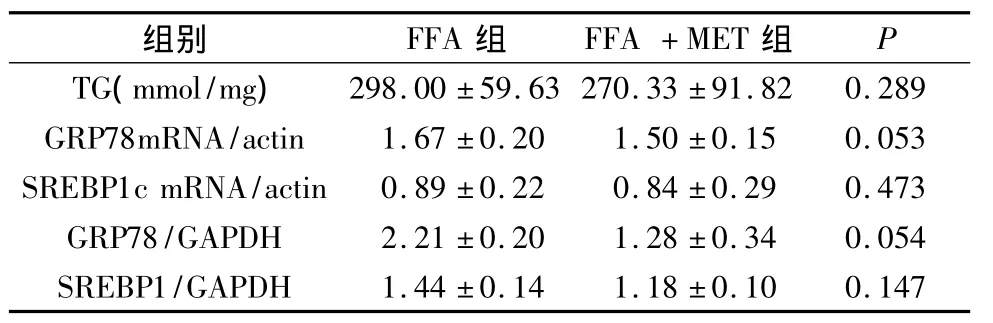
表2 游离脂肪酸组和干预组的TG、GRP78、SREBP1c的比较
3.脂肪变性细胞内GRP78的表达以及二甲双胍对其的影响:GRP78是内质网应激的标志物之一。生理状态下对内质网应激的反应的调节主要依靠3种跨膜蛋白质:IRE1、PERK kinase、ATF6。在未折叠蛋白反应中,这3种跨膜蛋白质的活化取决于内质网腔的分子伴侣GRP78从这些信号蛋白质的解离。游离脂肪酸组的GRP78mRNA和蛋白质水平较空白对照组和二甲双胍组明显升高(P<0.05)。干预组的GRP78mRNA和蛋白质水平较游离脂肪酸组有所降低,尽管没有显著性差异,但是P接近0.05(P分别为0.053、0.054,表 1、表 2 和图1、图2)。
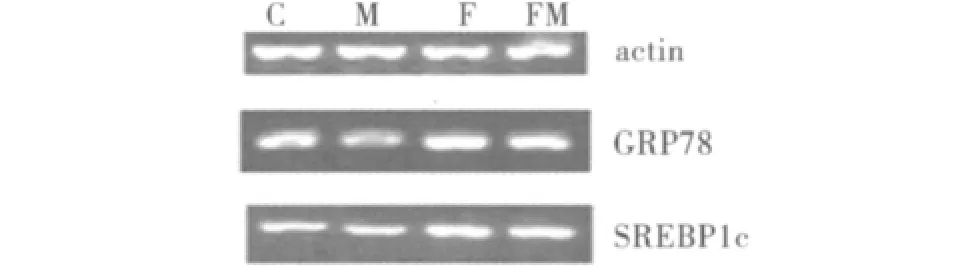
图1 GRP78、SREBP1c m RNA表达水平
4.脂肪变性细胞内SREBP1c的表达以及二甲双胍对其的影响:固醇调节元件结合蛋白(SREBP)有3
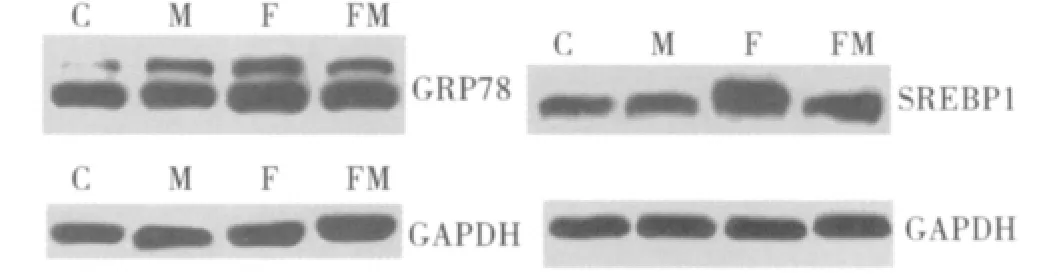
图2 GRP78,SREBP1蛋白表达水平
种同工酶:SREBP1a、SREBP1c和 SREBP2。肝脏内以SREBP1c和SREBP2为主。SREBP1c是调节游离脂肪酸生物合成的转录因子。SREBP1c能导致参与游离脂肪酸合成途径的基因的表达升高,如脂肪酸合成酶,硬脂酰基辅酶A脱氢酶。表1表明游离脂肪酸组的SREBP1cmRNA和蛋白质水平较对照组和二甲双胍组明显升高(P<0.05)。干预组 SREBP1c mRNA和蛋白质水平较游离脂肪酸组有所降低,但是没有显著性差异(P>0.05,表2和图1、图2)。
讨 论
以往的研究已经表明,游离脂肪酸是重要的脂毒性因子,能通过多种方式引起胰岛素抵抗、糖脂代谢紊乱,脂质过氧化等,在诱发脂肪肝的机制中起了重要作用。游离脂肪酸具有细胞毒性并能导致脂质的堆积,因此可能是重要的脂毒性和脂肪细胞凋亡的介导因子[8,9]。血浆游离脂肪酸升高的患者往往合并有单纯性脂肪肝,也是临床上常见的病因之一,因此,本研究中采用游离脂肪酸混合物孵育HepG2细胞来模拟过多的游离脂肪酸进入肝脏。肝细胞能够以一种称为未折叠蛋白反应的适应性反应来应对内质网应激。这种未折叠蛋白反应能够提高内质网内蛋白质的折叠和降解,下调所有蛋白质的合成。并且,有文献表明,同型半胱氨酸诱导的内质网应激能够通过活化SREBP导致脂质合成失衡。而SREBP是能诱导固醇/甘油三酯生物合成、摄取的基因的内质网固有的转录因子[10,11]。如果未折叠蛋白质反应能早期及时、有效地应对内质网应激的不利效应,就能提高细胞的存活。然而,长时间内质网应激会产生严重后果。除了引起细胞的死亡和炎症外,长时间内质网应激还能导致细胞内脂质堆积。而这个过程是通过内质网相关的跨膜转录因子SREBP介导的。SREBP1c和2通常与固醇敏感跨膜蛋白SCAP结合后以一种复合物的形式分布在内质网中[12]。内质网应激时,SREBP-SCAP与内质网固有蛋白Insig分离后,转运至高尔基体内,在高尔基体内SREBP得以剪切和活化[13,14]。通常情况下,Insig 翻译合成很快,它能抑制SREBP的裂解加工。而内质网应激诱导的翻译停顿能引起Insig快速降低,导致SREBP逃逸。一旦活化,转录因子SREBP1c和2就能调节控制甘油三酯和胆固醇合成的基因和细胞摄取脂蛋白的基因[14]。这个研究表明,游离脂肪酸诱导的内质网应激能够提高脂质的生物合成和摄取,可能是通过活化SREBP来完成的。这也可能是血浆游离脂肪酸升高的肥胖患者单纯脂肪变性发生发展的原因。
有文献通过未折叠蛋白反应的保护性作用证实了内质网的功能紊乱和脂质代谢的调节有直接联系,也提示了一种可能性——内质网应激是肝细胞脂肪变性发展中的促进因素[15]。也有研究发现,保护或恢复内质网功能可能是一种改善NAFLD的治疗手段。然而,在近年来的研究中,除了有关于一些分子伴侣能够促进蛋白质的折叠并防御内质网应激,从而减轻这些动物模型的疾病症状的研究外,没有关于治疗性药物比如二甲双胍对内质网应激有何影响的研究[5]。二甲双胍是目前被认为最有希望用来改善NAFLD的药物之一。它能够减少肝脏的脂肪生成,在肝脏通过线粒体解偶联效应,二甲双胍能够活化AMP活化的蛋白激酶。AMP活化的蛋白激酶的激动受ATP/AMP下降的诱导。当这个激酶活化后,它能够抑制脂肪生成酶类的表达并降低乙酰辅酶A羧化酶的活性,同时也增加脂肪酸的氧化。因此,理论上二甲双胍有助于减轻肝细胞的单纯脂肪变性。因为保护和恢复内质网的功能可能是改善NAFLD的治疗手段,因此很有必要研究二甲双胍对内质网应激的潜在影响。本研究的干预组中,二甲双胍能够下调GRP78、SREBP1c的mRNA和蛋白质水平,但是没有显著性差异。我们分析可能与实验重复次数较少、诱导模型的方法,或者二甲双胍本身确实不具备这样的治疗潜力这些因素相关,具体原因值得进一步探讨。
本实验表明内质网应激参与了游离脂肪酸诱导的细胞脂肪变性脂质合成过程。因此,内质网应激可能是NAFLD发病机制中新的干预靶点和治疗靶点。
1 Adams LA,Angulo P,Lindor KD.Nonalcoholic fatty liver disease[J].CMAJ.2005;172(7):899 -905
2 Ratziu V,Charlotte F,Bernhardt C,etal.Long-term efficacy of rosiglitazone in nonalcoholic steatohepatitis:results of the fatty liver improvement by rosiglitazone therapy(FLIRT2)extension trial[J].Hepatology,2010,51(2):445 -453
3 Hitomi J,Katayama T,TaniguchiM,A,et al.Apoptosis induced by endoplasmic reticulum stress depends on activation of caspase-3 via caspase -12[J].Neurosci Lett,2004,357(2):127 -130
4 Rao RV,Ellerby HM,Bredesen DE,Coupling endoplasmic reticulum stress to the cell death program[J].Cell Death Differ,2006,13(3):415-425
5 Ozcan U,Yilmaz E,Ozcan L,et al.Chemical chaperones reduce ER stress and restore glucose homeostasis in amousemodel of type2 diabetes[J].Science,2006,313(5790):1137 -1140
6 Gómez- Lechón MJ,Donato MT,Martínez- Romero A,etal.A human hepatocellular in vitro model to investigate steatosis[J].Chem Biol Interact,2007,165(2):106 -116
7 刘江,厉有名,陈韶华,等.一种实用的体外非酒精性脂肪肝细胞模型[J].浙江大学学报:医学版,2009,28(6):626 -629
8 Malhi H,Bronk SF,Werneburg NW,et al.Free fatty acids induce JNK - dependenthepatocyte lipoapoptosis[J].JBiol Chem,2006,281(17):12093-12101
9 Malhi H,Gores GJ,Lemasters JJ.Apoptosis and necrosis in the liver:a tale of two deaths?[J].Hepatology,2006,43(Suppl 1):S31-S44
10 Roybal CN,Yang S,Sun CW,et al.Homocysteine increases the expression of VEGF by a mechanisMinvolving endoplasmic reticulum stress and transcription factor ATF4[J].J Biol Chem,2004,279(15):14844-14852
11 Ji C,Kaplowitz N.Betaine decreases hyperhomocysteinemia,endoplasmic reticulum stress,and liver injury in alcohol- fed mice[J].Gastroenterology,2003,124(5):1488 -1499
12 Goldstein JL,DeBose-Boyd RA,Brown MS.Protein sensors for membrane sterols[J].Cell,2006,124(1):35 - 46
13 Brown MS,Goldstein JL.The SREBP pathway:regulation of cholesterolmetabolism by proteolysis of a membrane-bound transcription factor[J].Cell,1997,89(3):331 - 340
14 Ron D,Oyadomari S.Lipid phase perturbations and the unfolded protein response[J].Dev Cell,2004,7(3):287 - 288
15 RutkowskiDT,Wu J,Back SH,etal.UPR pathways combine to prevent hepatic steatosis caused by ER stress-mediated suppression of transcriptionalmaster regulators[J].Dev Cell,2008,15(6):829 -840
