耐高温α-淀粉酶高密度高表达发酵条件的优化
2012-10-25胡建恩房耀维王淑军吕明生
胡建恩,曹 茜,,杨 帆,,房耀维,王淑军,*,吕明生,葛 亮,李 瑛
(1.大连海洋大学食品科学与工程学院,辽宁 大连 116023;2.淮海工学院海洋学院,江苏 连云港 222005;3.上海海洋大学食品学院,上海 201306;4.江南大学生物工程学院,江苏 无锡 214122)
耐高温α-淀粉酶高密度高表达发酵条件的优化
胡建恩1,曹 茜1,2,杨 帆1,2,房耀维2,王淑军2,*,吕明生2,葛 亮3,李 瑛4
(1.大连海洋大学食品科学与工程学院,辽宁 大连 116023;2.淮海工学院海洋学院,江苏 连云港 222005;3.上海海洋大学食品学院,上海 201306;4.江南大学生物工程学院,江苏 无锡 214122)
通过摇瓶实验对产耐高温α-淀粉酶的重组菌E. coliBL21的高密度高表达发酵条件进行研究。考察不同培养基和不同发酵条件对该菌株产耐高温α-淀粉酶的影响,并利用正交试验进行优化。结果表明:在葡萄糖0.5g/L,酵母粉15g/L,pH6.5,诱导时机为接种后发酵4h,诱导时间为6h,IPTG添加量为0.8mmol/L,接种量为体积分数3%的优化条件下,该重组菌发酵液菌体生物量为原来的1.29倍,酶活力达到8.754U/mL,是原来的1.55倍,目的蛋白的表达量也为原来的1.24倍。
耐高温α-淀粉酶;大肠杆菌BL21;发酵培养基;发酵条件
α-淀粉酶作为淀粉酶的一种,是目前一类最重要、最古老、应用范围最广的工业酶制剂之一,其中耐高α-淀粉酶凭借其热稳定上的优势经占据很大的市场。用耐高温α-酶代替普通α-淀粉酶起到推动新工艺新技术的运用与研究,降低消耗、降低成本的作用。近年来,我国耐高温α-淀粉酶的产量和出口量逐年增长,但生产成本愈来愈高,利润空间日渐趋小[1-3]。因此如何能以最低投入,实现单位发酵液的最高目的蛋白表达量,成为发酵工业生产中研究的重点。
本研究室从海底热液口获得了一株超嗜热古菌Thermococcus siculiHJ21,该菌株分泌的耐高温α-淀粉酶的最适作用温度为95℃,在100℃仍有60%的酶活力,酶的最适作用pH5.0,在pH4.5仍有80%的酶活力,酶在90℃的半衰期为5h,在100℃ 作用2h仍有40%的残余酶活力,酶的热稳定性不依赖Ca2+,比较符合淀粉工业加工过程中所需要的条件。对超嗜热古菌Thermococcus siculiHJ21α-淀粉酶基因进行了克隆、表达和定向进化研究,获得了活性、热稳定性提高的突变酶[4-7]。本研究中含有超嗜热古菌HJ21α-淀粉酶基因的突变基因工程菌产生的耐高α-淀粉酶,不仅具有更高的作用温度和更低的作用pH值,而且具有比其野生菌更好的热稳定性。本研究以突变的大肠杆菌BL21工程菌为基础,通过对其发酵培养基和发酵条件进行优化,以期提高其发酵液耐高温α-淀粉酶酶活力,降低成本,为该酶工业化生产提供参考。
1 材料与方法
1.1 菌株与培养基
含质粒pET28-amy的重组E.coli21,淮海工学院海洋微生物研究室保存。
LB培养基(g/L):蛋白胨10、酵母粉5、NaC1 10、卡那霉素0.05,pH7.5,卡那霉素与异丙基硫代半乳糖苷(IPTG)均由0.22μm微孔滤膜法过滤除菌,其他培养基成分均在121℃灭菌20min。
1.2 培养方法
种子液制备:将活化的菌种以体积分数1%接种量接入含有100mL LB培养基的250mL三角瓶中,37℃、180r/min摇瓶培养12h,作为种子液。
发酵培养:将种子液以1%接种量接入装有100mL LB培养基的250mL三角瓶中,在37℃、180r/min条件下摇床培养,当培养菌液OD600nm达到0.5(约4h)时,再加入诱导剂IPTG(终浓度为1mmol/L),诱导4h。测菌液OD600nm,酶活力及目的蛋白表达量。
1.3 发酵培养基的优化
1.3.1 碳源的选择
以10g/L蛋白胨为氮源,添加5g/L的葡萄糖、甘油、蔗糖、麦芽糖、糊精、可溶性淀粉作为碳源,筛选出最佳碳源。配制碳源0.1、0.2、0.5、1.0、2.0、5.0g/L和10g/L的不同LB培养基,筛选出最佳碳源的最适质量浓度。
1.3.2 氮源的选择
以最适质量浓度的最适碳源为最佳碳源,添加10g/L的蛋白胨、酵母粉、豆饼粉、硫酸铵、硝酸钠、尿素作为氮源,筛选出最佳氮源。配制氮源5、1 0、15、20、25g/L的培养基,筛选出最佳氮源的最适质量浓度。
1.3.3 无机盐的影响
在LB液体培养基中添加KH2PO4和MgSO4无机盐进行发酵试验,添加KH2PO4终质量浓度分别为0、1.0、2.0、4.0、8.0、16g/L和32g/L,添加MgSO4使其终质量浓度分别为0、0.2、0.6、1.0、1.4、1.8、2.2g/L,进行发酵培养,筛选出最佳无机盐添加量。
1.4 发酵条件优化
1.4.1 诱导温度的影响
以LB培养基为基础,在37℃条件下培养菌液使其OD600nm达到0.5(约4h)时,加入诱导剂IPTG(终浓度为1 mm o l/L),再分别转移至2 7、3 2、37、4 2、4 7℃的恒温摇床,进行发酵培养,筛选出最佳诱导温度。
1.4.2 诱导pH值的影响
以L B培养基为基础,加入下列不同的缓冲液(10mmol/L)[8],再分别用NaOH调节液体LB培养基的pH值:pH5.5~6.0(2-(N-吗啉代)乙磺酸缓冲液,MES),pH6.5~7.0(取代磺酸哌嗪缓冲液,PIPES),pH7.5~8.0(4-羟乙基呱嗪乙硫磺酸,HEPES),进行发酵培养,筛选出最佳诱导pH值。
1.4.3 诱导时机的确定
以L B培养基为基础,分别在接种后培养2、3、4、5、6 h时加入I P T G进行诱导,筛选出最适诱导时机。
1.4.4 诱导时间的确定
以L B培养基为基础,分别诱导2、4、6、8、10h,筛选出最适诱导时间。
1.4.5 诱导剂量的确定
以LB培养基为基础,加入IPTG至其终浓度分别为0.6、0.8、1.0、1.2、1.4mmol/L,筛选出最适诱导剂量。
1.4.6 接种量的确定
以LB培养基为基础,分别按接种体积分数为0.5%、1%、2%、3%、4%进行发酵培养,筛选出最适接种量。
1.4.7 装液量的确定
以LB培养基为基础,分别按25、50、75、100mL和125mL的装液量(总体积250mL)进行发酵培养,筛选出最佳装液量。
1.5 正交试验优化发酵条件
在上述各单因素试验的基础上,选取碳源、氮源、pH值、诱导时机、诱导时间、IPTG添加量、接种量几个主要影响因素,同时以菌体生物量、酶活力、目的蛋白表达量为考察指标,利用L18(37)正交试验对以上单因素进行优化组合试验,筛选出最佳高密度高表达的试验方法。表1为正交试验水平表。
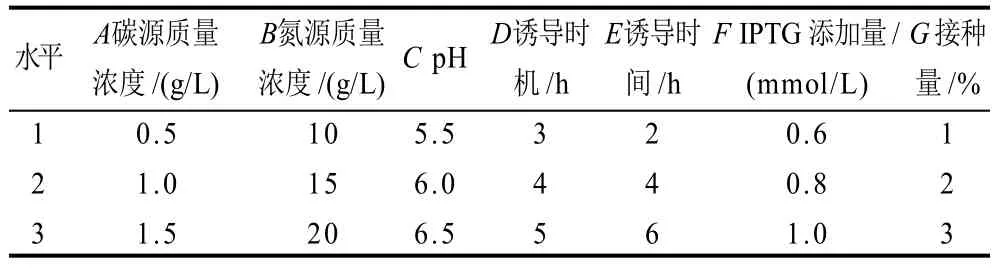
表1 正交试验因素水平Table 1 Coded values and corresponding real values of the optimization parameters tested in orthogonal array design
1.6 分析方法
1.6.1 菌体生物量测定
测定不同培养时期发酵液在600nm波长处的光密度值,用O D600nm表示。
1.6.2 酶活力测定
将发酵液于10000r/min离心5min,弃去上清液,用50mmol/L、pH7.0磷酸缓冲液重悬菌体,在1280psi(1psi=6.895kPa)条件下超高压破碎,12000r/min离心10min,收集上清液作为粗酶液。将10μL酶液加入到190μL 1%的可溶性乙酸钠缓冲溶液(50mmol/L,pH5.0)中,在95℃水浴中反应30min,用3,5-二硝基水杨酸(DNS)法测定还原糖[9]。酶活力单位定义:在上述反应条件下,每分钟催化产1μmol麦芽糖的酶量为一个酶活力单位,记为U。
1.6.3 目的蛋白表达量的测定
按照1.6.2节方法制备粗酶液,用考马斯亮蓝染色法(Bradford法)测定粗酶液中的总蛋白质含量[10]。用15%分离胶和5%浓缩胶对粗酶液进行SDS-PAGE电泳,电泳完毕后的凝胶一半用考马斯亮蓝染色30min后用甲醇-乙酸脱色液脱色,另一半在90℃水浴里反应30min后用碘-碘化钾进行染色[11]。用Bandscan分析SDS-PAGE电泳图[12],测定目的蛋白表达比例,结合总蛋白含量计算出目的蛋白表达量。
2 结果与分析
2.1 培养基成分对重组菌生长和目的蛋白表达的影响
2.1.1 碳源的影响

表2 不同碳源对菌体生物量和酶活力的影响Table 2 Effect of carbon source on cell density and amylase activity
由表2可知,葡萄糖对重组大肠杆菌的高密度高表达发酵中效果最好,可见,大肠杆菌对糖类的利用,单糖优于双糖,这与普通微生物对碳源利用的规律一致[13]。虽然有报道以甘油代替葡萄糖作为细菌生长的碳源可减少代谢抑制物质——乙酸的积累,更易达到重组菌的高密度和外源蛋白的高表达[14],但是在本研究中甘油效果仍然不及葡萄糖。如图1所示,在葡萄糖质量浓度为1.0g/L左右时大肠杆菌菌体生物量和目的产物表达量都达到最高。而当葡萄糖质量浓度大于10g/L时,细菌生长以及其产物的表达受到明显的抑制。

图1 葡萄糖质量浓度对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig. 1 Effect of glucose concentration on the growth, amylase activity and protein expression of recombinant E. coli
2.1.2 氮源的影响
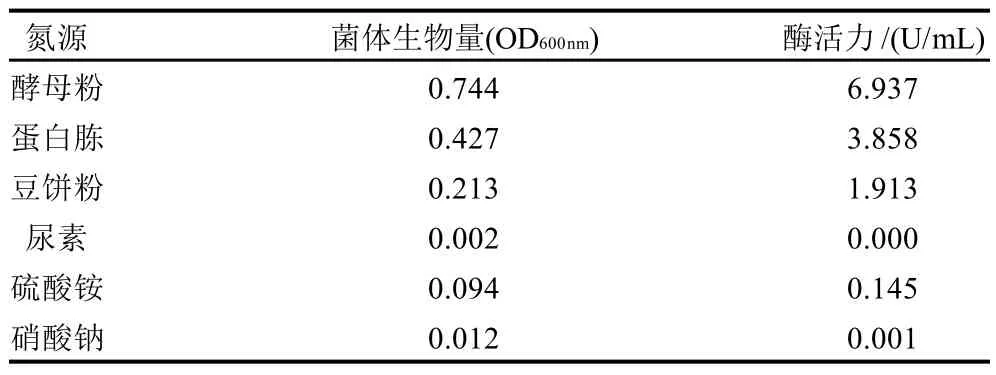
表3 不同氮源对菌体生物量和酶活力的影响Table 3 Effect of nitrogen source on cell density and amylase activity
氮源是细胞生长、繁殖和酶生产必不可少的营养物质。因此,在微生物产酶发酵中,氮源是必不可少的重要原料。以1g/L的葡萄糖为碳源,考察10g/L的酵母粉、蛋白胨、豆饼粉、尿素、硫酸铵、硝酸钠对细菌高密度高表达的影响。结果如表3所示:重组大肠杆BL21在分别以蛋白胨和酵母粉为氮源的培养基中生长良好,在硫酸铵和硝酸铵为氮源的培养基中略有生长,硝酸钠和尿素不能作为其生长利用的氮源,因此选取酵母粉作为最适氮源。
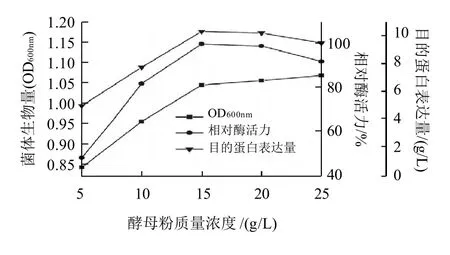
图2 酵母粉质量浓度对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig. 2 Effect of yeast extract concentration on the growth, amylase activity and protein expression of recombinant E. coli
如图2所示,酵母粉质量浓度达到15g/L时,酶活力和目的蛋白的表达都较高,随着酵母粉质量浓度逐渐增大,菌体的生长增长不明显,酶活力和目的蛋白表达量都有所降低。可能是由于过量的氮源是细菌的吸收营养物质的速度大于其利用速度,不利于其代谢。因此,酵母粉作为该发酵中氮源的最适质量浓度为15g/L。
2.1.3 无机盐的影响
2.1.3.1 磷酸盐的影响
大多数微生物发酵,需添加磷酸盐、镁、锰、铁、钾盐和氯化物以维持适当的离子强度和渗透压,虽然它们不是作为营养物,但有时对微生物的生长和产物生成会产生重大影响。尤其是无机磷酸盐,会阻遏次级代谢物的合成。图3结果显示适量的磷酸盐促进菌体生长和目的蛋白的表达,磷酸二氢钾质量浓度在2g/L左右时菌体生物量、酶活和目的蛋白表达量都达到最高,因此2g/L的磷酸二氢钾为最适的磷酸盐质量浓度。

图3 KH2PO4质量浓度对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig. 3 Effect of KH2PO4 concentration on the growth, amylase activity and protein expression of recombinant E. coli
2.1.3.2 硫酸镁的影响
镁以离子状态存在于菌体中,对多种酶的活性有促进作用。图4结果显示,添加硫酸镁可促进菌体生长和目的蛋白的表达,当硫酸镁质量浓度达到1.0g/L时,菌体生物量相对较高,相对酶活力和目的蛋白都达到最大,之后随硫酸镁质量浓度的继续增加菌体浓度虽略有增加,但相对酶活力与目的蛋白表达量均下降,综合考虑适宜的硫酸镁质量浓度为1.0g/L。

图4 MgSO4质量浓度对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig. 4 Effect of MgSO4 concentration on the growth, amylase activity and protein expression of recombinant E. coli
2.2 发酵条件对重组菌生长和目的蛋白表达的影响
2.2.1 诱导温度的影响

图5 温度对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig. 5 Effect of cultivation temperature on the growth, amylase activity and protein expression of recombinant E. coli
培养温度是影响细菌生长和调控细胞代谢的重要因素。如图5所示,重组大肠杆菌在37℃生长较好,该温度也是菌体产酶和目的蛋白表达较好的温度,过高和过低都不利于菌体生长和蛋白表达。
2.2.2 诱导pH值的影响
微生物在一定的pH值环境中才能正常生长繁殖,如果pH值不适,不但妨碍微生物菌体的正常生长,还会改变微生物的代谢途径和代谢产物的性质。本实验采用加入缓冲液来保持培养基的pH值,以研究重组菌高密度和高表达的适宜pH值。如图6所示,重组菌的生长适宜pH值为6.0~6.5,该pH值也利于菌株产酶,在pH值为6.5时目的蛋白表达量占总蛋白的比例较高,综合各因素pH值为6.0较好。
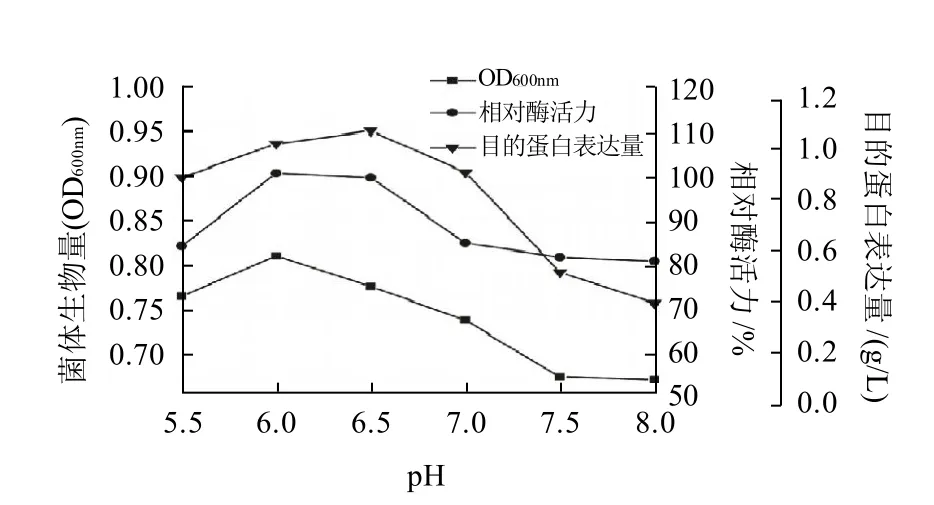
图6 pH值对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig.6 Effect of pH on the growth, amylase activity and protein expression of recombinant E. coli
2.2.3 诱导时机的影响
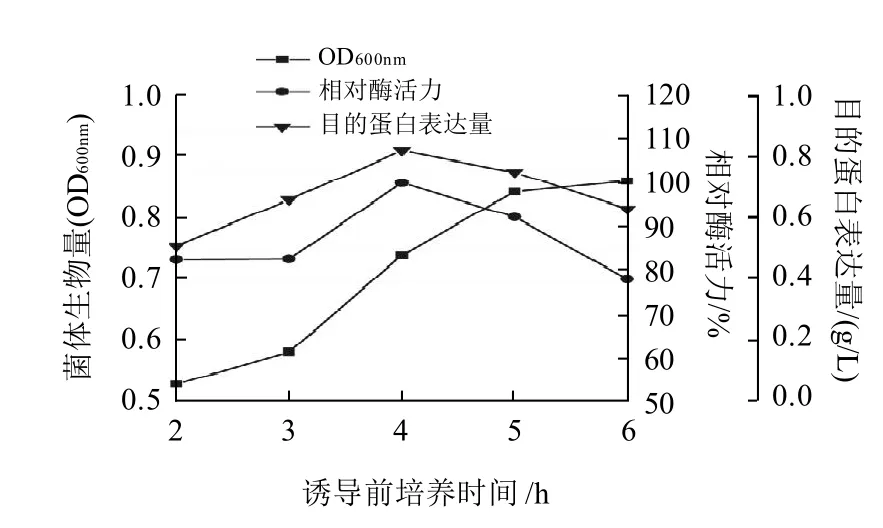
图7 诱导时机对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig.7 Effect of induction time point on the growth, amylase activity and protein expression of recombinant E. coli
重组大肠杆菌通常在对数生长期进行诱导,其最佳的诱导起始时间需要针对不同的宿主菌及不同的质粒体系加以优化。如图7所示,菌体在摇瓶中生长4h(菌体OD600nm达到0.5左右)时,对其进行诱导,相对酶活达到最高,目的蛋白得到最大表达,菌体生物量虽不断增大,但不利于耐高温α-淀粉酶的表达。
2.2.4 诱导时间的影响

图8 诱导时间对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig.8 Effect of induction duration on the growth, amylase activity and protein expression of recombinant E. coli
如图8所示,加入IPTG后分别培养2、4、6、8h和10h。随着诱导时间的延长,菌体浓度逐渐增大。酶活力与目的蛋白表达量先由迅速升高,而后略有下降趋势,分别在4h和6h时达到高峰。从经济角度及IPTG可能存在的副作用方面考虑,认为加入IPTG再诱导4h,利于重组菌的生长和目的蛋白的表达,4h为最适诱导时间。
2.2.5 诱导剂添加量的影响
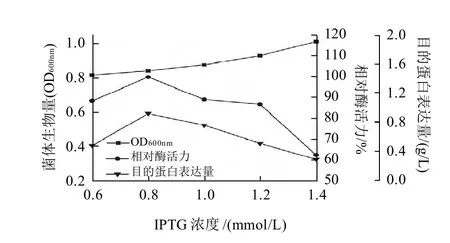
图 9 IPTG添加量对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig.9 Effect of IPTG amount on the growth, amylase activity and protein expression of recombinant E. coli
诱导剂IPTG在培养基中不被利用,其浓度也比较稳定,但选择不同的诱导浓度对目的基因的表达存在较大的影响。如图9所示,IPTG添加量对重组菌的产酶活性有一定影响,而对菌体的生长影响不大,高浓度的IPTG对目的蛋白的表达不利,添加IPTG适宜的浓度为0.8mmol/L。
2.2.6 接种量的影响
接种量的大小对发酵周期的长短和产酶水平高低的影响较大,接种量过小则菌体生长缓慢,对数生长期延长,菌体培养时间延长,菌种活力降低,接种量过大,虽然缩短了培养时间,但菌种则容易衰老,酶活力不高,所以选择合适的接种量对产酶影响较大[15]。图10结果显示,接种量为2%时,酶活力和目的蛋白表达量均达到达到最大,随着接种量的继续增加,虽然菌体生物量仍有所上升,但酶活力和目的蛋白表达量菌呈下降趋势,综合各因素考虑,最佳的接种量为2%。

图 10 接种量对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig.10 Effect of inoculum amount on the growth, amylase activity and protein expression of recombinant E. coli
2.2.7 装液量的影响

图11 装液量对重组菌生长、相对酶活力及目的蛋白表达量的影响Fig.11 Effect of medium amount in shake flasks on the growth,amylase activity and protein expression of recombinant E. coli
培养过程中装液量决定了培养瓶中的溶氧量,溶氧浓度是高密度发酵过程中影响菌体生长的重要因素之一。大肠杆菌的生长代谢过程需要氧的参与,溶氧量对菌体的生长和产物生成影响很大,溶氧量过高或过低都会影响细菌的代谢。由图11可见,在50mL/250mL装液量时菌体生物量最高,但当装液量达到75mL/250mL时,酶活力和目的蛋白的表达同时达到最高,综合各因素考虑,适宜的装液量为75mL/250mL。
2.3 培养基成分及发酵条件优化的正交试验结果
如表4所示,根据极差分析,各因素影响菌体生物量的顺序为C>D>G>F>E>A>B,最优条件组合为A3B2C3D2E1F2G3,其中A、B、E因素影响不大,且当取得C3D2F2G3时发酵液菌体生物量最大;同理,影响酶活力的主次顺序为D>G>C>F>E>A>B,最优组合为A1B1C3D2E3F2G3,其中B因素影响最小,当取得A1C3D2E3F2G3时发酵液酶活力最大;以目的蛋白表达量为考察指标,影响其的主次顺序为G>C>D>A>B>F>E,最优组合为A1B2C3D2E1F2G3,其中E因素影响最不显著,当取得A1B2C3D2F2G3时发酵液目的蛋白表达量最大。为获得高密度、高表达的发酵结果,应同时考虑发酵液中菌体生物量、酶活力及目的蛋白表达量与各因素的关系,综合以上3个结果的组合,最终确定最优发酵条件为A1B2C3D2E3F2G3,即葡萄糖0.5g/L,酵母粉15g/L,pH6.5,诱导时机为接种后发酵4h,诱导时间为6h,IPTG添加量为0.8mmol/L,接种量为3%。经过优化,该重组菌发酵液菌体生物量为原来的1.29倍,酶活力达到8.754U/mL,是原来的1.55倍,目的蛋白的表达量也为原来的1.24倍。

表4 培养基成分及发酵条件优化正交试验结果Table 4 Orthogonal array design and results
3 结 论
通过摇瓶发酵试验对产耐高温α-淀粉酶大肠杆菌重组菌BL21培养基和培养条件的优化,确定了该菌高密度高表达发酵方案:葡萄糖0.5g/L酵母粉15g/LpH6.5,诱导时机为接种后发酵4h,诱导时间为6h,IPTG添加量为0.8mmol/L,接种量为3%。经优化后,该重组菌发酵液菌体生物量为原来的1.29倍,酶活力达到8.754U/mL,是原来的1.55倍,目的蛋白的表达量也为原来的1.24倍。该研究得到的高密度高表达的发酵参数可为发酵罐的放大实验和工业化生产提供理论参考。
[1] GUPTA R, GIGRAS P, MOHAPATRA H, et al. Microbialα-amylases:a biotechnological perspective[J]. Process Biochemistry, 2003, 38(11):1599-1616.
[2] 刘春莉, 张文学, 杨瑞. 特殊α-淀粉酶的应用研究现状和前景展望[J]. 四川食品与发酵, 2002, 38(4): 5-9.
[3] 余诗庆. 耐高温α-淀粉酶发酵活力提高的研究和应用[D]. 天津: 天津大学, 2007.
[4] 王淑军, 陆兆新, 吕明生, 等. 一株深海热液口超嗜热古菌的分类鉴定及高温酶活性研究[J]. 南京农业大学学报, 2009, 32(2): 130-136.
[5] 王淑军, 邓祥元, 李富超, 等. 耐高温酸性α-淀粉酶基因部分序列的克隆与分析[J]. 海洋科学, 2007, 31(12): 69-75.
[6] 王淑军, 陆兆新, 秦松, 等. 超嗜热古菌耐热酸性α-淀粉酶的发酵条件和酶学性质研究[J]. 海洋与湖沼, 2009, 40(1): 19-25.
[7] WANG Shujun, LU Zhaoxin, LMingsheng, et a1. Identification of archaeon-producing hyperthermophilicα-amylase and characterization of theα-amylase[J]. Appl Microbiol Biotechnol, 2008, 80(4): 605-614.
[8] JOLIVET E, CORRE E, L’HARIDON S, et al.Thermococcus marinussp. nov. andThermococcus radiotoleranssp. nov., two hyperthermophilic archaea from deep-sea hydrothermal vents that resist ionizing radiation[J]. Extremophiles, 2004, 8(3): 219-227.
[9] 王淑军. 超嗜热古菌Thermococcus siculiHJ21高温酸性α-淀粉酶及其基因克隆的研究[D]. 南京: 南京农业大学, 2008.
[10] 张龙翔, 张庭芳, 李令媛. 生化实验方法和技术[M]. 2版. 北京: 高等教育出版, 1997: 138-140.
[11] BROWN S H, COSTANTINO H R, KELLY R M. Characterization of amylolytic enzyme activities associated with the hyperthermophilic archaebacteriumPyrococcus furiosus[J]. Appl Environ Microbiol, 1990,56(7): 1985-1991.
[12] 刘旭光, 张杰. 分子生物学软件应用[M]. 北京: 北京大学医学出版社, 2007: 53-54.
[13] 朱伟萍, 张晶. 水处理生物学[M]. 北京: 中国电力出版社, 2008: 87-88.
[14] KORZ D J, RINAS U, HELLMUTH K, et al. Simple fed-batch technique for high cell density cultivation ofEscherichia coli[J]. Biotechnol,1995, 39(1): 59-65.
[15] 李进, 张伟国.L-异亮氨酸产生菌的选育及发酵条件优化[D]. 无锡:江南大学, 2005.
Optimization of Fermentation Conditions for High Cell Density Cultivation and High Hyperthermophilicα-Amylase Expression in RecombinantE. coli
HU Jian-en1,CAO Qian1,2,YANG Fan1,2,FANG Yao-wei2,WANG Shu-jun2,*,LMing-sheng2,GE Liang3,LI Ying4
(1. College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China;2. School of Marine Science ,Huaihai Institute of Technology, Lianyungang 222005, China;3. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;4. School of Biothechnology, Jiangnan University, Wuxi 214122, China)
In order to achieve high-cell-density cultivation and high expression of recombinantE. coliBL21 producing hyperthermophilicα-amylase, the medium composition and shake flask fermentation conditions were optimized using orthogonal array design. The optimal cultivation conditions for the production ofα-amylase were achieved by using a pH 6.5 medium composed of 0.5 g/L glucose and 15 g/L yeast extract and an inoculum size of 3%, and adding 0.8 mmol/L IPTG for 6 h induction after 4 h of fermentation. Under these conditions, the biomass of recombinantE. coliBL21 was increased by 1.29-fold, theα-amylase activity by 1.55-fold (reaching 8.754 U/mL) and the protein expression level by 1.24-fold compared to the preoptimization results.
hyperthermophilicα-amylase;E. coliBL21;cultivation medium;cultivation conditions
O623.54
A
1002-6630(2012)01-0219-07
2011-02-07
江苏省科技厅农业科技支撑计划项目(BE2008340);江苏省高校自然科学研究重大项目(09KJA170001)
胡建恩(1962—),男,教授,博士,研究方向为生物资源利用。E-mail:huje@dlfu.edu.cn
*通信作者:王淑军(1965—),女,教授,博士,研究方向为海洋微生物及其活性物质。E-mail:shujunwang86@163.com
