诱导物对出芽短梗霉木聚糖酶活力和阿魏酰低聚糖合成的调控影响
2012-10-25张雨青余晓红顾振新
张雨青,余晓红,,*,顾振新,屠 康
(1.盐城工学院化学与生物工程学院,江苏 盐城 224003;2.南京农业大学食品科技学院,江苏 南京 210095)
诱导物对出芽短梗霉木聚糖酶活力和阿魏酰低聚糖合成的调控影响
张雨青1,余晓红1,2,*,顾振新2,屠 康2
(1.盐城工学院化学与生物工程学院,江苏 盐城 224003;2.南京农业大学食品科技学院,江苏 南京 210095)
以麦麸为原料诱变选育的不产黑色素出芽短梗霉为发酵菌株,利用其发酵过程中合成的木聚糖酶水解麦麸纤维,制备阿魏酰低聚糖(FOs)。研究碳源、氮源、金属离子和表面活性剂等诱导物对出芽短梗霉木聚糖酶活力和FOs合成的影响,以探明各物质对出芽短梗霉木聚糖酶活力和FOs合成的影响;利用正交试验设计方法研究各物质添加量对出芽短梗霉产酶和FOs的影响,确定芽短梗霉发酵制备FOs的最佳培养基。结果表明:50g/L麦麸处理液中添加15g/L葡萄糖、1g/L蛋白胨和1g/L玉米浆,FOs产量和木聚糖酶活力最高分别达到627nmol/L和52.66IU/mL。
麦麸;阿魏酰低聚糖;诱导物;合成调控;出芽短梗霉
阿魏酰低聚糖(feruloyl oligosaccharides,FOs)是阿魏酸(ferulic acid,FA)与糖的羟基通过酯键联接成的一类重要的功能性低聚糖,广泛存在于禾本科植物中[1]。FOs的制备方法有化学法[1]、物理法[2]和生物法[3]。化学法和物理法因存在反应条件苛刻、产物易分解等缺点而较少使用,目前使用最多的是生物酶法。生物酶法是以不溶性膳食纤维为原料[3],利用半纤维素酶等水解获取FOs,该方法反应温和、操作简便,但生产中增加了不溶性膳食纤维的制备工艺,步骤复杂。
生物发酵法已用于膳食纤维的制备[4]。该方法在FOs制备中报道较少,仅见Ferreira等[5]在用链霉菌发酵甜菜浆时,检出多聚半乳糖醛酸酶、阿魏酸酯酶、FOs和阿魏酸,表明微生物发酵制备FOs具有可行性。发酵法制备FOs旨在利用菌体生成的胞外酶水解麦麸细胞壁,释放FOs,其中木聚糖酶是该过程的关键酶[3],因而发酵过程中木聚糖酶活性至关重要。在发酵工艺中,影响产物生成的因素很多,其中培养基组成及发酵条件对微生物生长、产酶及其代谢物质的生成影响显著[6]。
本课题组诱变选育获得高产木聚糖酶、不产阿魏酸酯酶的出芽短梗霉菌株(Aureobasidium pullulans),其发酵液中检出大量的FOs,可将此菌株用于发酵麦麸制备FOs,该方面研究未见报道。拟通过比较碳源、氮源、金属离子和表面活性剂等诱导物成分对出芽短梗霉生成木聚糖酶和FOs的影响,以确定出芽短梗霉发酵制备FOs的最佳培养基组成,为后续进一步研究出芽短梗霉发酵法制备FOs的最佳工艺提供参考。
1 材料与方法
1.1 材料、菌株与试剂
麦麸由江苏省泰兴市纷华面粉有限公司提供。
出芽短梗霉(Aureobasidium pullulans)购自广东微生物研究所。
乳糖、蔗糖、木糖、ZnSO4、Fe2(SO4)3、Ca(CO3)2(均为分析纯) 南京化学试剂有限公司;吐温-80、植物油、蔗糖酯(均为食品级) 山东海杰化工有限公司。
1.2 仪器与设备
UV-2450紫外-可见分光光度计 日本岛津公司;HH-2数显恒温水浴锅 国华电器有限公司;GL21R冷冻离心机 上海知正离心机有限公司;Agilent 1200液相色谱仪 美国Agilent公司;DZ-900往复式摇床 太仓实验设备厂。
1.3 方法
1.3.1 麦麸液制备工艺流程
麦麸烘干→粉碎过40目筛子筛分→用2%硫酸溶液调pH值至5.5,并调节至50g/L→50℃保温2h
1.3.2 培养基的制备
保藏培养基:酵母浸膏6.7g/L、葡萄糖10g/L、(NH4)2SO42g/L、KH2PO45g/L,琼脂20g/L,pH值自然;母种培养基:酵母浸膏6.7g/L、葡萄糖10g/L、(NH4)2SO42g/L、KH2PO45g/L,pH值自然;碳源实验用培养基:在麦麸液中添加10g/L的葡萄糖、木糖、乳糖、木聚糖、蔗糖;氮源实验用培养基:在麦麸液中添加2g/L的酵母膏、蛋白胨、牛肉膏、豆粕、玉米浆、硫酸铵和硝酸铵;金属离子实验用培养基:在麦麸液中添加1mmol/L的Zn2+、Mg2+、Fe3+、Ca2+和K+;表面活性剂实验用培养基:在麦麸液中添加1g/L的吐温-80、植物油和蔗糖酯;麦麸培养基(发酵培养基):50g/L的麦麸液,添加1g/L的KH2PO4和1g/L的MgSO4·7H2O和0.1g/L的VB1;以上培养基均采用高压蒸汽灭菌,灭菌温度为121℃,时间20min。
1.3.3 菌种培养方法
母种培养:在温度为28℃,摇床转速180r/min,摇瓶装液量为50mL/250mL三角瓶,接种1块直径约为4mm的母种菌块,培养3d。
培养基确定用发酵条件:按体积分数10%的接种量取母种接种至已灭菌的发酵培养基中,28℃条件下180r/min往复摇床中培养,测定发酵液中木聚糖酶活力及FOs产量。
1.3.4 木聚糖酶活力测定
以燕麦木聚糖为底物,用3,5-二硝基水杨酸(DNS)法测定还原糖的生成量。取0.5mL适当稀释的出芽短梗霉木聚糖酶粗酶液,加入1.5mL用0.2mol/L、pH4.8醋酸缓冲液配制的1g/100mL木聚糖溶液中,50℃酶解30min,加入1.5mL 3,5-二硝基水杨酸试剂,沸水浴中加热5min,用冰水迅速冷却,定容到25mL,于520nm波长处测定OD值。同时以100℃灭活的粗酶液作对照,用木糖作标准曲线。
酶活力单位定义为上述条件下每分钟水解木聚糖产生1μmol木糖的酶量为一个酶活力单位(IU)。
1.3.5 FOs含量的测定[7]
样品处理:将各菌的发酵液于4000r/min离心15min,上清液为含有FOs的样品液。取样品液1mL于10mL离心管中,添加1mL浓度为1mol/L的氢氧化钠溶液,于100℃避光水解90min,使FOs水解,冷却后用1mol/L盐酸溶液中和。
样品测定:采用HPLC法测定FOs样品液及其水解液中阿魏酸含量,计算FOs样品水解前后阿魏酸的增加量,即为F O s产量。
阿魏酸的液相色谱测定条件:采用Agilent TCC18柱(250mm×4.6mm,5μm),25℃,进行HPLC分离,检测器为紫外检测器(UV)。洗脱液为0.5%的三氟乙酸(A)和乙腈(B),流速为0.6mL/min,梯度洗脱。进液量为20μL,检测波长为325nm,洗脱顺序见表1。

表1 阿魏酸洗脱顺序Table 1 Elution program for frulic acid
1.3.6 试验设计
以碳源、氮源、金属离子、表面活性剂进行单因素试验,考察其对FOs产量和木聚糖酶活力的影响,在单因素试验结果基础上,选择在麦麸处理液中添加筛选出的对FOs产量和木聚糖酶活力呈正效应的各因素,正交试验设计按表2进行。
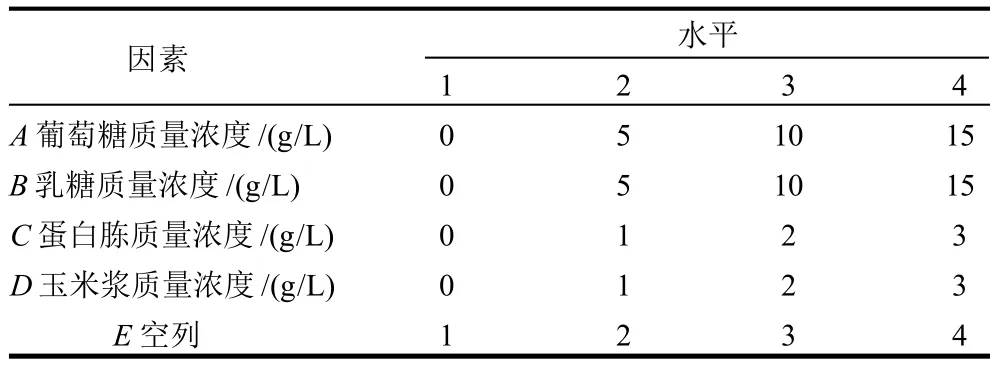
表2 培养基成分添加量正交试验因素水平表Table 2 Coded values and corresponding real values of the optimization parameters tested in orthogonal array design
2 结果与分析
2.1 不同碳源对出芽短梗霉木聚糖酶和阿魏酰低聚糖合成的影响
在麦麸液中分别添加10g/L的葡萄糖、蔗糖、木糖、木聚糖和乳糖,考察碳源对出芽短梗霉生成木聚糖酶和F O s的影响,结果见表3、4。碳源对出芽短梗霉合成木聚糖酶和FOs具有一定的影响。在空白麦麸发酵液中,出芽短梗霉合成木聚糖酶活力为24.56IU/mL。葡萄糖、乳糖和木糖的添加对木聚糖酶和F O s的合成具有一定的促进作用,其中葡萄糖和乳糖效果最好。随着发酵时间从4d延长到6d,FOs产量却下降,可能出芽短梗霉因为自身生长代谢的需要,在碳源逐渐消耗的情况下,会诱导FO s降解酶的合成,从而分解FO s以供菌体自身生长代谢,所以后续研究中控制发酵时间为4 d。
碳源诱导微生物产酶已有大量研究,但对诱导出芽短梗霉产木聚糖酶的调控作用不多见。本研究发现葡萄糖可促进出芽短梗霉菌体生长,类似于Kim等[8]的研究结果,可能缘于葡萄糖对出芽短梗霉菌体生长具有一定的促进作用,从而促进了木聚糖酶的合成。木聚糖未能促进出芽短梗霉木聚糖酶的合成,这区别于其他报道[9],其原因可能是本研究采用麦麸处理液作为空白,考察碳源的添加对木聚糖酶合成的影响,而麦麸对木聚糖酶的合成具有很好的诱导作用[10-11],诱导物则在一定质量浓度范围内对其诱导酶才具有促进作用,质量浓度增加效果不明显甚至会出现抑制作用[12],麦麸和木聚糖为木聚糖酶的同类诱导物,本研究中50g/L的麦麸已达到其对木聚糖酶的最佳诱导质量浓度[13],因而继续添加木聚糖未能促进出芽短梗霉木聚糖酶的生成。此外,研究表明不同菌株的木聚糖酶合成诱导物不同[14]。

表3 碳源对出芽短梗霉木聚糖酶生成的影响Table 3 Effect of carbon sources on biosynthesis of xylanase in Aureobasidium pullulans

表4 碳源对出芽短梗霉阿魏酰低聚糖生成的影响Table 4 Effect of carbon sources on biosynthesis of FOs in Aureobasidium pullulans
2.2 不同氮源对出芽短梗霉木聚糖酶和阿魏酰低聚糖合成的影响
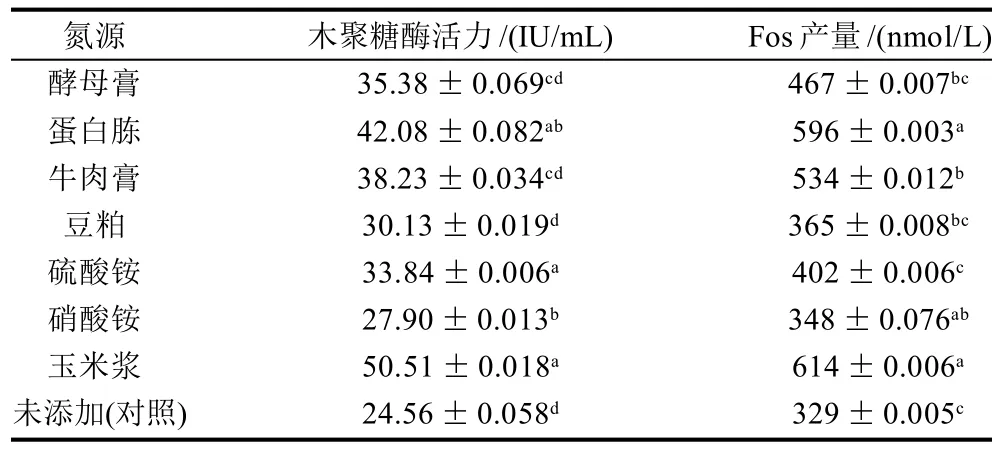
表5 氮源对出芽短梗霉生成木聚糖酶、阿魏酰低聚糖的影响Table 5 Effect of nitrogen sources on biosynthesis of xylanase and FOs in Aureobasidium pullulans
在麦麸处理液中分别添加酵母膏、蛋白胨等有机氮源和硫酸铵、硝酸铵等无机氮源使其质量浓度为2g/L,测定FOs含量和木聚糖酶活力,以考察氮源对出芽短梗霉生成木聚糖酶和FOs的影响,结果见表5。相比于无机氮源,有机氮源更适于真菌的生长及其代谢产物的生成[15]。有机氮源对出芽短梗霉产酶及FOs的合成具有较大影响,不同氮源具有不同的影响。玉米浆、蛋白胨对出芽短梗霉木聚糖酶的合成促进作用显著,显著的提高了FOs产量。类似于Oliveira等[16]和Cai等[17]的研究结果。玉米浆对出芽短梗霉产酶影响的报道未见,本研究结果显示玉米浆可促进出芽短梗霉木聚糖酶的合成和FOs产量的提高。Zhang Jianzhen等[18]研究表明铵盐为氮源时出芽短梗霉合成木聚糖酶能力最强。有机氮源对木聚糖酶具有激活作用,其中蛋白胨效果最佳[19];本研究结果与此类似,以蛋白胨为氮源时出芽短梗霉生成木聚糖酶活性较高。后续研究则以玉米浆和蛋白胨为氮源。
2.3 不同金属离子对出芽短梗霉木聚糖酶和阿魏酰低聚糖合成的影响
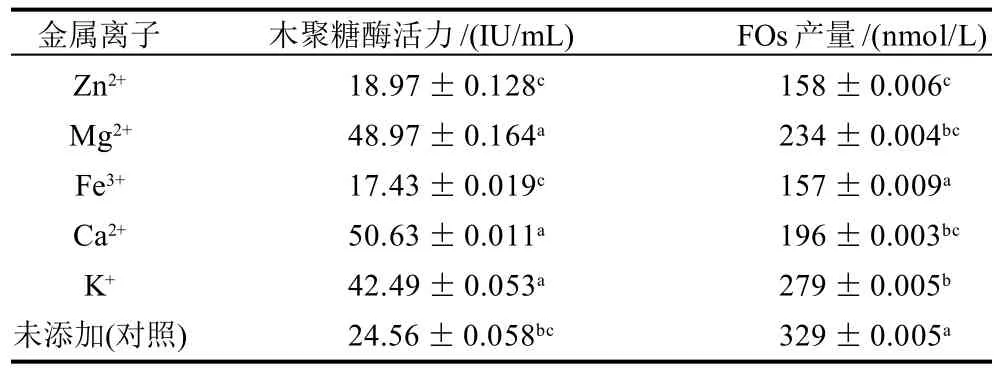
表6 金属离子对出芽短梗霉生成木聚糖酶、阿魏酰低聚糖的影响Table 6 Effect of metal ions on biosynthesis of xylanase and FOs in Aureobasidium pullulans
在麦麸处理液中,添加1mmol/L Zn2+、Mg2+、
Fe3+、Ca2+和K+等金属离子,考察金属离子对出芽短梗霉生成木聚糖酶及FOs的影响,结果见表6。金属离子对出芽短梗霉木聚糖酶的合成和FOs的生成具有不同的影响趋势,Ca2+、Mg2+和K+对木聚糖酶的合成具有促进作用,却使FOs产量减少。由此可推断发酵系统中FOs的产量下降不是缘于出芽短梗霉的消耗造成的,可能是出芽短梗霉木聚糖酶合成的同时,金属离子Ca2+、Mg2+和K+也激发了出芽短梗霉生成其他可水解酶系[20]。研究已证实金属离子可同时激活几种酶活性[21]。
2.4 不同表面活性剂对出芽短梗霉木聚糖酶和阿魏酰低聚糖生成的影响
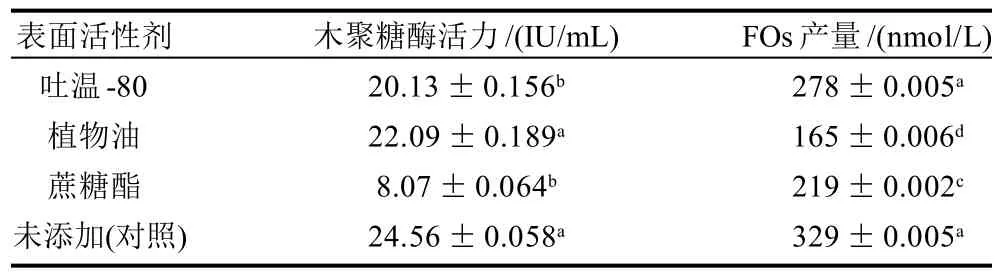
表7 表面活性剂对出芽短梗霉生成木聚糖酶和阿魏酰低聚糖的影响Table 7 Effect of surfactants on biosynthesis of xylanase and FOs in Aureobasidium pullulans
在麦麸处理液中,添加1g/L吐温-80、植物油和蔗糖酯,考察表面活性剂对出芽短梗霉木聚糖酶生成和FOs产量的影响,结果见表7。在麦麸处理液中添加表面活性剂后,出芽短梗霉发酵系统中,木聚糖酶活力和FOs的产量均下降了。因此,在后续实验中表面活性剂不再添加。Zeng Guangming等[22]研究表明表面活性剂添加量对Penicillium simplicissimum生成木聚糖酶具有一定的影响,质量浓度低时可促进木聚糖酶的合成,质量浓度过高则反之。Park等[23]研究表明适量植物油的添加可促进北虫草菌体生长及多糖分泌,添加量过多则出现抑制作用。植物油与表面活性剂相似,均可改变细胞膜的通透性,使得菌体生长及代谢产物的产量提高[24];本研究以麦麸为发酵系统,因麦麸含有2.86%脂肪[7],即培养基中已有一定浓度的油脂,因此,吐温-80和植物油等表面活性剂的添加未能促进出芽短梗霉木聚糖酶的合成和FOs的形成。
综上所述,由碳源、氮源、金属离子和表面活性剂对出芽短梗霉产酶和FOs的影响结果可知,添加金属离子和表面活性剂均未能提高出芽短梗霉发酵系统中FOs的产量,因而后续试验中不再添加。葡萄糖、乳糖、玉米浆及蛋白胨对出芽短梗霉木聚糖酶活性和FOs生成均呈正效应,具有促进作用,因此,后续试验进一步考察此正效应因素的最适添加量。
2.5 正交试验结果
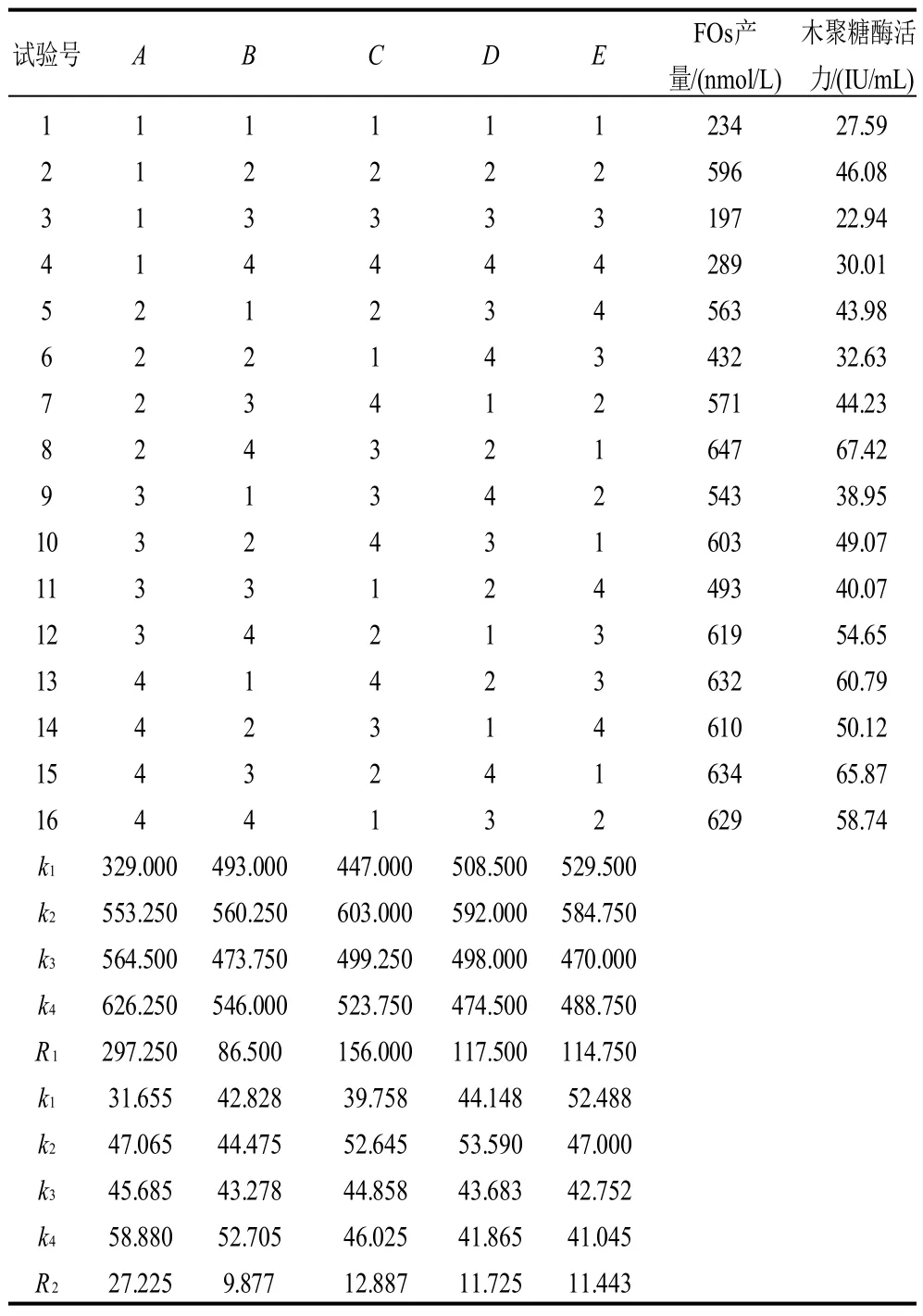
表8 正交试验设计及结果Table 8 Orthogonal array design and results

表9 正交试验结果方差分析Table 9 Variance analysis for the experimental results of orthogonal array design
正交试验方案及结果见表8。经Design Expert 7.0软件优化得,出芽短梗霉生成木聚糖酶和FOs的最佳培养基组成分别为A4B2C2D2和A4B4C2D2;由极差分析(表8)和方差分析(表9)可知,葡萄糖、乳糖、蛋白胨和玉米浆添加量对FOs产量和木聚糖酶活力的影响顺序均为A>C>D>E>B,其中A因素(葡萄糖添加量)对FOs产量的影响最为显著,B因素(乳糖添加量)对FOs产量、木聚糖酶活力的影响均最小,故不作添加,为获得出芽短梗霉发酵麦麸产阿魏酰低聚糖的最高产量,在培养基中添加葡萄糖、蛋白胨和玉米浆分别使其质量浓度达到15、1g/L和1g/L时,出芽短梗霉发酵后可同时获得最高产量的FOs和木聚糖酶,在该条件下,木聚糖酶活力和FOs产量分别为52.66IU/mL和627nmol/L。对实验结果进行方差分析(表9)可知,葡萄糖对FOs产量的影响显著。
3 结 论
出芽短梗霉在麦麸培养基中生长时能够合成木聚糖酶,适量的葡萄糖、蛋白胨和玉米浆均能促进出芽短梗霉木聚糖酶的合成及FOs的生成,添加金属离子和表面活性剂均未能提高出芽短梗霉发酵系统中FOs的产量。出芽短梗霉发酵制备FOs的培养基组成为:50g/L麦麸液中添加15g/L葡萄糖、1g/L蛋白胨和1g/L玉米浆;利用该培养基进行液态发酵,木聚糖酶活力可达52.66IU/mL,FOs产量达627nmol/L。为后续进一步研究出芽短梗霉发酵法制备FOs的最佳工艺提供参考。
[1] SAULNIER L, VIGOUROUX J, THIBAULT J. Isolation and partial characterization of feruloylated oligosaccharides from maize bran[J].Carbohydr Res, 1995, 272(2): 241-253.
[2] WANG Jing, YUAN Xiaoping, SUN Baoguo, et al. On-line separation and structural characterisation of feruloylated oligosaccharides from wheat bran using HPLC-ESI-MSn[J]. Food Chem, 2009,115(4): 1529-1541.
[3] YUAN Xiaoping, WANG Jing, YAO Huiyuan. Production of feruloyl oligosaccharides from wheat bran insoluble dietary fibre by xylanases fromBacillus subtilis[J]. Food Chem, 2006, 95(3): 484-492.
[4] ALLERDINGS E, RALPH J, STEINHART H, et al. Isolation and structural identification of complex feruloylated heteroxylan side-chains from maize bran[J]. Phytochemistry, 2006, 67(12): 1276-1286.
[5] FERREIRA P, DIEZ N, FAULDS C B, et al. Release of ferulic acid and feruloylated oligosaccharides from sugar beet pulp byStreptomyces tendae[J]. Bioresource Technol, 2007, 98(8): 1522-1528.
[6] MOREAU A, DURAND S, MOROSOLI R. Secretion of aCryptococcus albidusxylanase inSaccharomyces cerevisiae[J]. Gene, 1992, 116(1): 109-113.
[7] XIE Chunyan, GU Zhenxin, YOU Xuejiao. Screening of edible mushrooms for release of ferulic acid from wheat bran by fermentation[J].Enzyme and Microbial Technology, 2010, 46(2): 125-128.
[8] KIM H O, LIM J M, JOO J H, et al. Optimization of submerged culture condition for the production of mycelial biomass and exopolysaccharides byAgrocybe cylindracea[J]. Bioresource Technology, 2005, 96(10):1175-1182
[9] HWANG H J, KIM S W, XU C P, et al. Production and molecular characteristics of four groups of exopolysaccharides from submerge culture ofPhellinus gilvus[J]. Journal Applied Microbiology, 2003, 94(4):708-719.
[10] LIU Lihua, LIN Zhiwei, ZHENG Teng, et al. Fermentation optimization and characterization of the laccase fromPleurotus ostreatusstrain 10969[J]. Enzyme and Microbial Technology, 2009, 44(6/7): 426-433.
[11] GARRAWAY M O, EVANS R C. Fungal nutrition and physiology[M].New York: Wiley, 1984.
[12] LEE B C, BAE J T, PYO H B, et al. Submerged culture conditions for the production of mycelial biomass and exopolysaccharides by the edible BasidiomyceteGrifola frondosa[J]. Enzyme and Microial Technology,2004, 35(5): 369-376.
[13] PETRESCU I, LAMOTTE-BRASSEUR J, CHESSA J P, et al. Xylanase from the psychrophilic yeastCryptococcus adeliae[J]. Extremophiles,2000, 4(3): 137-144.
[14] AMORESANO A, ANDOLFO A, CORSARO M M, et al. Structura characterization of a xylanase from psychrophilic yeast by mass spectrometry[J]. Glycobiol, 2000, 10(5): 451-458.
[15] 付文杰, 张莎莎. 茶新菇液体发酵培养基优化研究[J]. 安徽农业科学, 2007, 35(19): 5668-5669.
[16] OLIVEIRA L A, PORTO A L, TAMBOURGI E B. Production of xylanase and protease byPenicillium janthinellumCRC 87M-115 from different agricultural wastes[J]. Bioresource Technol, 2006, 97(6): 862-867.
[17] CAI Qinghe, YUE Xiaoyu, NIU Tiangui, et al. The screening of culture condition and properties of xylanase by white-rot fungusPleurotus ostreatus[J]. Process Biochem, 2004, 39(11): 1561-1566.
[18] ZHANG Jianzhen, PANG Zongwen, LIANG Jingjuan, et al. The biosynthesis of xylanase byAureobasidium pulluansXYE-7[J]. Modern Food Science and Technology, 2007, 23(1): 5-7.
[19] 孙东平. 灵芝深层培养基及灵芝多糖纯化的研究[D]. 广州: 华南理工大学, 1996.
[20] XU Guoqian, CHU Ju, ZHUANG Yingping, et al. Effects of vitamins on the lactic acid biosynthesis ofLactobacillus paracaseiNERCB 0401[J].Biochemical Engineering Journal, 2008, 38(2): 189-197.
[21] LI Jian, LI Ping, LIU Fang. Production of theanine byXerocomus badius(mushroom) using submerged fermentation[J]. LWT, 2008, 41(5): 883-889.
[22] ZENG Guangming, SHI Jingang, YUAN Xingzhong, et al. Effects of Tween 80 and rhamnolipid on the extracellular enzymes ofPenicillium simplicissimumisolated from compost[J]. Enzyme and Microbial Technology, 2006, 39(7): 1451-1456.
[23] PARK J P, KIM S W, HWANG H J, et al. Stimulatory effect of plant oils and fatty acids on the exo-biopolymer production inCordyceps militaris[J]. Enzyme and Microbial Technology, 2002, 31(3): 250-255.
[24] HSIEH C, WANG Huiliang, CHEN C C, et al. Effect of plant oil and surfactant on the production of mycelial biomass and polysaccharides in submerged culture ofGrifola frondosa[J]. Biochemical Engineering Journal, 2008, 38(2): 198-205.
Effect of Inducers on Xylanase Activity and Biosynthesis of Ferulic Oligosaccharides inAureobasidium pullulans
ZHANG Yu-qing1,YU Xiao-hong1,2,*,GU Zhen-xin2, TU Kang2
(1. College of Chemistry and Biological Engineering, Yancheng Institute of Technology, Yancheng 224003, China;
2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Feruloyl oligosaccharides (FOs) could be produced as a result of the hydrolysis of wheat bran fiber by xylanase synthesized during fermentation by a mutant strain ofAureobasidium pullulanswithout the secretion of melanin bred using wheat bran. The effects of inducers such as carbon source, nitrogen source, metal ion and surfactant on the activity of xylanase and the formation of FOs were investigated. The medium composition for FOs production by the strain was optimized using the orthogonal array design method. The highest FOs production and xylanase activity, 627 nmol/L and 52.66 IU/mL, respectively,were achieved by using a medium comprised of 50 g/L wheat bran, 15 g/L glucose, 1 g/L peptone and 1 g/L corn syrup.
wheat bran;ferulic oligosaccharides;inducer;biosynthesis and control;Aureobasidium pullulans
Q939.97
A
1002-6630(2012)01-0209-06
2011-09-23
江苏省社会发展科技支撑基金资助项目(BE2011728);江苏省高校自然科学基金资助项目(11KJB550005);江苏省农业科技支撑基金资助项目(BE2010386);江苏省新型环保重点实验室开放课题基金资助项目(AE201041);盐城市产学研联合创新基金项目(YKA201102);盐城市科技局工业支撑基金资助项目(Yk2009047);盐城工学院应用化学研究所开放基金资助项目(XKY2009004)
张雨青(1963—),男,讲师,本科,研究方向为化学工程。E-mail:yczyq@ycit.cn
*通信作者:余晓红(1976—),女,副教授,博士研究生,研究方向为食品微生物、天然产物分离及应用。E-mail:yxh1127@163.com
