大麦芽极限糊精酶的分离纯化及酶学特性分析
2012-10-25彭雅莉
彭雅莉,胡 飞*
(华南理工大学轻工与食品学院,广东 广州 510640)
大麦芽极限糊精酶的分离纯化及酶学特性分析
彭雅莉,胡 飞*
(华南理工大学轻工与食品学院,广东 广州 510640)
将大麦芽提取的极限糊精酶粗酶液,利用硫酸铵沉淀、离子交换层析和凝胶过滤色谱等分离方法对极限糊精酶进行逐步分离纯化。结果表明:纯化倍数为31.23,回收率为8.81%。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,图谱显示样品具有较高的纯度,分子质量约为97kD。同时研究了纯化前后极限糊精酶在不同作用环境下酶的活性变化,发现纯化后样品在温度45℃和pH 5.5左右具有最大酶活性,与粗酶液中酶活性相比具有明显差异。在体系中添加不同浓度的金属离子,结果发现,Mg2+、Ca2+、Mn2+在浓度较低时,对酶活性具有激活作用,而浓度较高时,则具有抑制作用;整体上,K+对酶活性影响不大;Zn2+、Fe2+对酶活性具有抑制作用。
极限糊精酶;纯化;酶特性
麦芽是啤酒酿造的重要原料,主要贮藏物质是淀粉,其中包括20%~40%直链淀粉和60%~80%支链淀粉,两者都为高分子物质,必须由一系列酶作用形成小分子可发酵性糖才能被酵母利用[1-2]。麦芽中与淀粉降解密切相关的淀粉酶主要有α-淀粉酶、β-淀粉酶和极限糊精酶等[3-5]。α-淀粉酶可将淀粉分子链内的α-1,4-葡萄糖苷键任意水解;β-淀粉酶的作用是从非还原性末端的第二个α-1,4-葡萄糖苷键开始降解淀粉分子。大麦芽极限糊精酶又称植物普鲁兰酶,能够专一地催化普鲁兰、支链淀粉和极限糊精α-1,6-糖苷键。3种酶协同作用方可将大麦芽中淀粉降解为各种小分子糖,由于α-淀粉酶和β-淀粉酶不能水解支链糊精,因此两者协同作用虽可以加快淀粉的降解速度,并不能改变终产物的组成。而极限糊精酶具有高度的特异性,从而可以提高淀粉的糖化率[5-6]。
相比α-淀粉酶和β-淀粉酶,大麦芽极限糊精酶由于含量少、存在抑制蛋白[7]且检测方法不完善,一直未受到人们的重视,而且学术界对它的作用存在一定的争议。但近年来,作为麦芽中的一种淀粉酶,它的重要性越来越受到研究工作者的关注。现阶段,国内对极限糊精酶的相关研究主要集中于谷物籽粒发芽过程中极限糊精酶活性的变化[8-11],关于极限糊精酶提取纯化及特性的研究较少。因此,将大麦芽中极限糊精酶进行分离并达到一定的纯度,进而对其特性进行更深入的分析,既能丰富淀粉酶科学领域,又对食品酿造工业具有重要意义。
1 材料与方法
1.1 材料与试剂
麦芽(Kendall) 广州麦芽公司。
硫酸铵 天津市科密欧化学试剂有限公司;三羟甲基氨基甲烷(Tris) 天津市瑞金化学品有限公司;L-半胱氨酸盐酸盐、考马斯亮蓝G-250 上海伯奥生物科技有限公司;DEAE-琼脂糖凝胶FF(DEAE Fast Flow) 美国GE公司;葡聚糖凝胶G-100 上海浩宏生物科技有限公司;普鲁兰 爱尔兰Megazyme公司;透析袋 (截留相对分子质量14000) 美国光谱医学公司。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计 北京普析通用有限公司;FD-1B-50冷冻干燥机 上海精密科学仪器有限公司;DYCZ-3 型电泳槽、DYY-4C型电泳仪 北京六一仪器厂;HID3紫外检测仪 上海金鹏分析仪器有限公司;Purifer100纯化仪 美国GE公司。
1.3 方法
1.3.1 极限糊精酶分离纯化
1.3.1.1 麦芽极限糊精酶粗酶液的制备
对干燥后的大麦芽进行粉碎,过孔径35目筛,得到预处理麦芽粉。添加pH5.4的磷酸缓冲液(1:5.37,m/V)及适量22.3mmol/L还原剂(L-半胱氨酸盐酸盐)到麦芽粉中,振荡均匀,37.5℃水浴17.5h,然后3000r/min离心10min,得到麦芽淀粉酶粗提液Ⅰ。
1.3.1.2 硫酸铵分级沉淀
取一定量的粗酶液Ⅰ,缓慢加入适量研磨后的硫酸铵粉末,4℃静置过夜,3000r/min离心10min,沉淀用Tris-HCl缓冲液(20mmol/L,pH7.0)溶解后,用考马斯亮蓝G-250染色法[12]和普鲁兰法[13-14]分别测定上清液和沉淀溶解液中蛋白质含量和酶活力。据此选取最佳硫酸铵饱和度,得到的分离液为粗酶液Ⅱ。
1.3.1.3 酶液Ⅱ的透析
通过透析处理粗酶液Ⅱ中存在的无机离子和有机小分子物质。将粗酶液Ⅱ装入预处理后的透析袋中,置于4℃冰箱中,用5倍体积以上的去离子水充分透析,数小时更换一次,直至用BaCl2检测不到SO42-为止,冷冻干燥后备用。
1.3.1.4 离子交换层析(DEAE-琼脂糖凝胶FF)
取100mL DEAE-琼脂糖凝胶FF,用pH7.0的20mmol/L Tris-HCl缓冲液配成匀浆,脱气后填于 1.6cm×60cm的玻璃柱中,床体积约为80mL。将透析处理后的粗酶液Ⅱ上样 25mL,以0~0.5mol/L NaCl的缓冲液梯度洗脱,流速为4mL/min,检测波长为280nm。收集蛋白活性部分,测定蛋白质含量和极限糊精酶活力。收集液盐析后进行冷冻干燥。
1.3.1.5 凝胶过滤色谱(Sephadex G-100)
采用Sephadex G-100(1.6cm×40cm)柱层析分离提纯极限糊精酶,柱体积约为60mL。将经过离子交换层析的酶液上样5mL,以 pH5.5的20mmol/L醋酸缓冲液进行洗脱,流速为3mL/min,每管收集2mL,检测波长为280nm。收集蛋白质部分,测定蛋白质含量和极限糊精酶活力,收集液盐析后进行冷冻干燥。
1.3.2 蛋白质含量测定
考马斯亮蓝G-250在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置由465nm变为595nm,溶液的颜色也由棕黑色变为蓝色。在波长595nm处测定吸光度A595nm,其与蛋白质含量成正比。
1.3.3 极限糊精酶活力的测定
采用普鲁兰法[13-14],取酶液0.4mL,加入含0.5mg/mL牛血清白蛋白(BSA)的醋酸钠缓冲液(0.2mol/L,pH5.5)0.1mL,40℃水浴预热5min,加入底物溶液(0.5g普鲁兰溶于25mL,0.5mol/L KCl溶液),反应10min后于510nm波长处测定吸光度,计算酶活力。

式中:m1为还原糖质量/mg;V1为酶液体积/mL;n为稀释倍数;V2为反应液体积/mL;t为反应时间/min;m2为麦芽粉质量/mg。
其中还原糖质量由DNS法测得。
1.3.4 SDS-PAGE分析
采用SDS-聚丙稀酰胺凝胶电泳(SDS-PAGE)测定样品分子质量和酶的纯度。5%浓缩胶,12%分离胶。恒定电流作用4h后,用冷凝水冷却电泳槽。用考马斯亮蓝R-250进行染色,脱色后,拍照。
1.3.5 极限糊精酶酶学特性
1.3.5.1 温度对极限糊精酶活性的影响
取粗酶液Ⅰ或纯化后的酶液0.4mL加入含0.5mg/mL BSA的醋酸钠缓冲液(0.2mol/L,pH5.5)0.1mL,分别在35~70℃温度梯度下水浴预热5min,加入底物溶液(0.5g普鲁兰溶于25mL 0.5mol/L KCl溶液),反应10min后于510nm波长处测定吸光度。
1.3.5.2 pH值对极限糊精酶活性的影响
取粗酶液Ⅰ或纯化后的酶液0.4mL加入含0.5mg/mL BSA的醋酸钠缓冲液(0.2mol/L)0.1mL,缓冲液pH3.5~6.5,然后40℃水浴预热5min,加入底物溶液(0.5g普鲁兰溶于25mL,0.5mol/L KCl溶液),反应10min后于510nm波长处测定吸光度。
1.3.5.3 不同金属离子对极限糊精酶活性的影响
取纯化后的酶液0.4mL加入含0.5mg/mL BSA 的醋酸钠缓冲液(0.2mol/L pH5.5)0.1mL,其中缓冲液中加入不同金属离子(0~14mmol/L),40℃水浴预热5min,加入底物溶液(0.5g普鲁兰溶于25mL,0.5mol/L KCl溶液),反应10min后于510nm波长处测定吸光度。
2 结果与分析
2.1 极限糊精酶的分离纯化
2.1.1 硫酸铵分级沉淀
将酶萃取液(设其相对酶活力为100%)经硫酸铵盐析后,分析其酶集中分布区,结果如图1所示。当硫酸铵饱和度小于30%时,沉淀中相对酶活力较低,而上清液中相对酶活力较高,说明该饱和度以下,酶盐析量较少。随着硫酸铵饱和度的提高,沉淀中蛋白质含量增加,沉淀中相对酶活力也随之上升,表明由于盐析作用较多的酶沉淀下来。当饱和度达到80%后沉淀中相对酶活力基本不变。因此,选取饱和度为30%的硫酸铵去除杂蛋白,然后在上清液中补加硫酸铵至饱和度为80%,盐析后得到粗酶液Ⅱ,进行透析后冷冻干燥。

图 1 极限糊精酶盐析曲线Fig.1 Salting out curve of limit dextrinase
2.1.2 DEAE-琼脂糖凝胶FF分离
冷冻干燥的样品经DEAE-琼脂糖凝胶FF离子交换柱分离后主要得到3个蛋白质吸收峰,波长为280nm处Purifer100纯化仪检测值如图2所示。
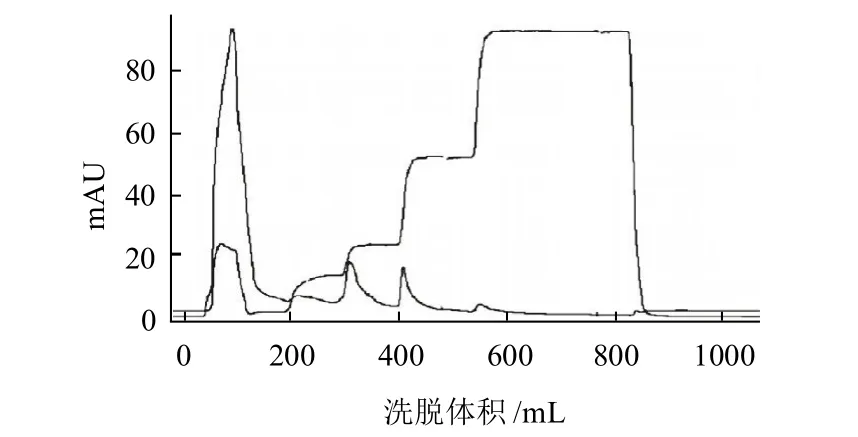
图2 离子交换层析波长280nm处检测值Fig.2 Elution curve of proteins on DEAE Sepharose FF column

图3 离子交换层析中极限糊精酶活力Fig.3 Elution curve of limit dextrinase on DEAE Sepharose FF column
在波长510nm处测定极限糊精酶活力,由图3可以看出,第1个峰中含有少量极限糊精酶,主要原因是在洗脱时,由于上样量稍多,一小部分目标蛋白随之洗出;同时由于提取过程采用水提法,粗提液中含有α-淀粉酶、β-淀粉酶等水溶性酶,故经离子交换层析时有较多的杂蛋白洗出。第2个峰中极限糊精酶含量很少。第3个峰含有较高的极限糊精酶活力,将该部分进行收集,测定其酶活力和蛋白质含量,并进行冷冻干燥。
2.1.3 凝胶过滤色谱纯化
经上述离子交换柱层析后,再经凝胶过滤色谱柱按分子质量大小进一步分离,洗脱结果如图4所示,主要得到两个蛋白质吸收峰,吸光度为HID3紫外检测仪在波长280nm处检测值。在波长510nm处测定极限糊精酶活力(图5)发现:图4第1个峰极限糊精酶活力较高,主要为极限糊精酶;而图4第2个峰极限糊精酶活力较低,主要为一些小分子质量的蛋白质。收集含有极限糊精酶部分的溶液,测定酶活力和蛋白质含量。再次透析后进行冷冻干燥,得到样品。

图4 凝胶过滤色谱在280nm检测值Fig.4 Elution curve of proteins on Sephadex G-100 column
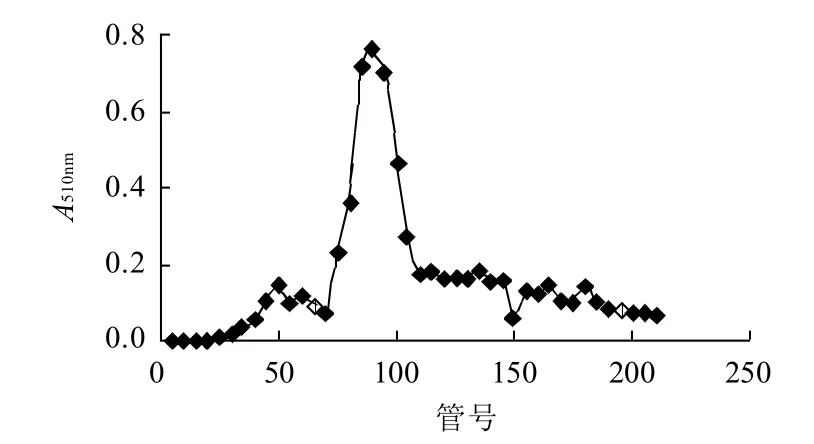
图5 凝胶过滤色谱中极限糊精酶活力Fig.5 Elution curve of limit dextrinase on Sephadex G-100 column
2.1.4 纯化结果分析
经上述各步分离纯化后得到的结果如表1所示,最终酶比活力为22.09mU/mg,回收率为8.81%,纯化倍数为31.23,可以看出经过多步分离纯化后,得到了纯度较高的极限糊精酶样品。

表1 各步纯化结果分析Table 1 A summary of purification of limit dextrinase
在强还原剂作用下,蛋白质分子中的二硫键将被还原,蛋白质解聚为多肽链。在聚丙烯酰胺凝胶电泳中加入一定量的十二烷基硫酸钠,使得形成的蛋白质-SDS复合物带有大量的电荷,掩盖了不同蛋白质间电荷的差异,电泳时蛋白质-SDS复合物的迁移率主要取决于其分子质量的大小,而其他因素对电泳的影响可以忽略,从而可将不同分子质量的蛋白分离开来。将纯化后样品进行SDS-PAGE分析,结果见图6。可以看出纯化后极限糊精酶样品主要有一条带,因此可认为所制备得到的样品纯度较高,同时与标准蛋白分子质量相比,该酶分子肽链的分子质量约为97kD。

图6 纯化样品SDS-PAGE分析结果Fig.6 SDS-PAGE analysis of purified limit dextrinase
2.2 极限糊精酶的酶学特性
2.2.1 最适温度
由图7可见,极限糊精酶纯品在45℃左右具有最大活性,而对比研究表明麦芽粗提液Ⅰ中极限糊精酶活力最适温度为55℃,糖化过程中温度达到60℃时仍具有一定的酶活力。最适温度发生显著变化的原因可能在于麦芽浸出物中的其他成分对极限糊精酶起到了一定的热保护作用,使得纯化后的极限糊精酶的最适温度显著降低。
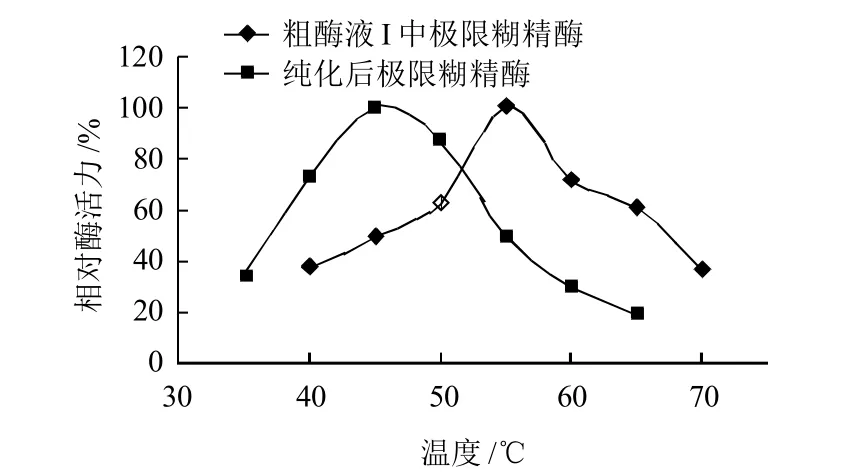
图7 温度对极限糊精酶活性的影响Fig.7 Effect of temperature on the activity of limit dextrinase
2.2.2 最适pH值

图8 pH值对极限糊精酶活性的影响Fig.8 Effect of pH on the activity of limit dextrinase
如图8所示,纯化后的极限糊精酶最适pH值为5.5,与粗提液Ⅰ中极限糊精酶相比有所增加。说明极限糊精酶作用环境的物质组成不同,体现出不同的最适pH值要求。也有研究报道[15]在极限糊精酶粗提液中加入牛血清蛋白时,极限糊精酶最适pH值会提高到5.5~6.5。
2.2.3 金属离子对酶活性的影响
在反应体系中分别加入不同的金属离子,以不加金属离子的相对酶活力为100%,40℃条件下测定其相对酶活力。由图9可知,Mg2+、C a2+、M n2+在浓度较低(8~10mmol/L以下)时,对酶活性有一定的激活作用,浓度较高时,则会抑制酶活性。 整体上,K+对酶活性影响不大,Zn2+、Fe2+对酶活性有抑制作用,特别是随着浓度的增大,抑制作用显著增强。
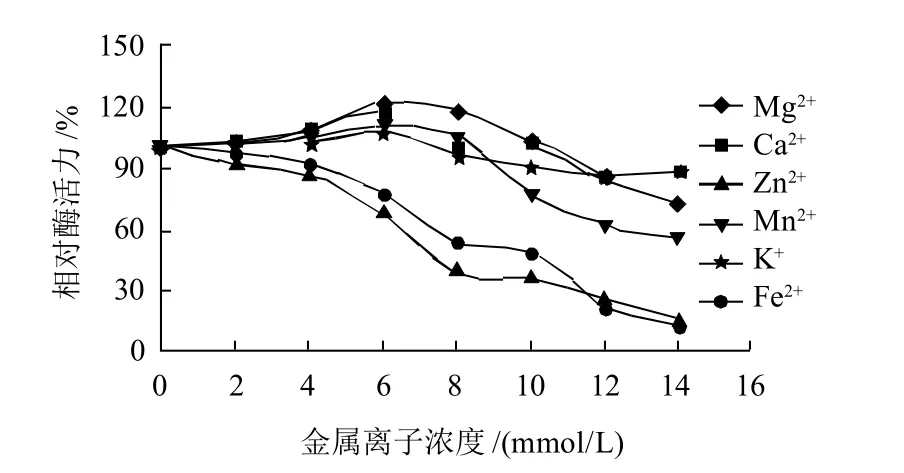
图9 金属离子浓度对酶活性的影响Fig.9 Effect of metal ions on the activity of limit dextrinas
3 结 论
3.1 大麦芽极限糊精酶的粗提液经硫酸铵沉淀、离子交换层析和凝胶过滤色谱法纯化后,酶比活力由粗酶液中的0.71mU/mg提高至纯化后的22.09mU/mg,纯化倍数达到了31.23倍,说明样品经多步分离纯化后已具有较高的纯度。同样经电泳证实,图谱上显示出单一谱带,分子质量约为97kD。极限糊精酶的回收率仅为8.81%,说明它在淀粉酶中的含量相对较少。
3.2 对纯化后样品的最适温度和pH值进行研究,发现其与粗酶液Ⅰ中酶特性具有一定差异,纯化样品在温度45℃和pH5.5左右具有最大活性,而粗酶液Ⅰ在温度55℃和pH5.0时具有最大酶活性。
3.3 通过添加不同浓度的金属离子研究其对极限糊精酶酶活性的影响,发现Mg2+、Ca2+、Mn2+在8~10mmol/L以下时,对酶活性有一定的激活作用,浓度较高时,则会抑制酶活性。整体上,K+对酶活性影响不大,Zn2+、Fe2+对酶有抑制作用,特别是随着浓度的增大,抑制作用显著增强。
[1] 周广田. 啤酒酿造技术[M]. 济南: 山东大学出版社, 2005.
[2] MYRBACK K. Enzymic degradation of starch and the structure of the starch macromolecule[J]. Journal for Prakische Chemic, 1943,162: 29-62.
[3] WOLFGANG K. 啤酒工艺实用技术[M]. 湖北轻工职业技术学院翻译组, 译. 北京: 中国轻工业出版社, 1998
[4] MACGERGOR A W, BAZIN S L, MACRI L J, et al. Modelling the contribution of alpha-amylase, beta-amylase and limit dextrinase to starch degradation during mashing[J]. Journal of Cereal Science, 1999, 29(2):161-169.
[5] 周会, 张军杰, 黄玉碧. 淀粉去分支酶研究进展[J]. 河南农业科学,2006(9): 5-8.
[6] ENEVOLDSEN B S. Debranching enzymes in brewing [J]. Proc Congr Eur Brew Conv, 1975, 15: 683-697.
[7] SISSONS M J, LANCE R C, WALLAC E W. Bound and free forms of barley limit dextrinase[J]. Cereal Chemical, 1994, 71(5): 520-521.
[8] 李芬, 朱筱娟, 王兴智. 啤酒大麦极限糊精酶的研究进展[J]. 东北师范大学学报: 自然科学版, 1998(4): 68-75.
[9] 艾志录, 张晓宇, 崔建涛, 等. 小麦芽制备过程中品种间极限糊精酶活力的变化[J]. 河南农业大学学报, 2007, 41(2): 212-216
[10] 王洪振, 王淑范. 吉啤2号大麦发芽过程中极限糊精酶变化规律的研究[J]. 吉林师范大学学报, 2005, 26(4): 6-7.
[11] 梁秀梅, 李芬, 王洪振, 等. 啤酒大麦发芽过程中极限糊精酶变化规律的研究[J]. 中国农业科学, 2002, 35(5): 493-497.
[12] 李志江. 考马斯亮蓝G250染色法测定啤酒中蛋白质的含量[J]. 酿酒,2008, 35(1): 70-72.
[13] LEE W J, PYLER R E. Improved assay procedure for limit dextrinase in malt extracts[J]. Brewer , s Digest, 1982, 57(7): 24-27.
[14] SERRE L, LAURIERE C. Limit dextrinase in cereal seeds[J]. Sci Aliments, 1989, 9(4): 645-663.
[15] MACGREGOR A W, MACRI L J, SCHROEDER S W, et al. Limit dextrinase from malted barley: extraction, purification, and characterization[J]. Cereal Chemistry, 1994, 71(6): 610-617.
Purification and Enzymatic Characterization of Limit Dextrinase from Malted Barley
PENG Ya-li,HU Fei*
(College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
This study was carried out to separate and purify limit dextrinase from malted barley by (NH4)2SO4 salting out, DEAE Sepharose FF column chromatography and Sephadex G-100 column chromatography. A purification fold of 31.23 and a recovery of 8.81% were achieved. The SDS-PAGE pattern of the purified limit dextrinase revealed a single band of protein (97 kD). The effects of temperature and pH on limit dextrinase in both the crude extract and purified sample were studied. The results indicated that maximum activity of the purified limit dextrinase was observed under the conditions of 45 ℃ and pH 5.5 and showed an obvious difference as compared with the crude enzyme extract. Moreover, Mg2+, Ca2+and Mn2+increased the activity of the enzyme at low concentrations, whereas Zn2+and Fe2+inhibited the activity at high concentrations. K+did not exhibit any effects on the activity of the enzyme.
limit dextrinase;purification;enzymatic characterization
TS201.2
A
1002-6630(2012)01-0204-05
2011-05-25
广东省科技计划项目(2007A020100001-12)
彭雅莉(1987—),女,硕士研究生,主要从事谷物化学与工程研究。E-mail:ppyhoo@163.com
*通信作者:胡飞(1972—),男,副教授,博士,主要从事粮食资源化学与技术研究。E-mail:g95216@163.com
