海参对糖尿病大鼠肾脏的保护作用及其机制的研究
2012-10-25龙腾腾王静凤李晓林薛长湖李兆杰
龙腾腾,王静凤,赵 芹,张 珣,李晓林,薛长湖,李兆杰*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
海参对糖尿病大鼠肾脏的保护作用及其机制的研究
龙腾腾,王静凤,赵 芹,张 珣,李晓林,薛长湖,李兆杰*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
目的:研究海参对链脲佐菌素(STZ)诱导的糖尿病大鼠肾脏的保护作用,并探讨其作用机制。方法: 采用一次性腹腔注射STZ的方法建立糖尿病大鼠模型,在长期高血糖环境下造成对肾脏的损伤。灌胃海参(800mg/(kg·d)8周后,分别检测大鼠空腹血糖值、尿糖含量、肾脏指数和尿总蛋白、微量白蛋白(mAlb)、N-乙酰-β-D-氨基葡萄糖苷酶(NAG)排泄率;采用RT-PCR方法测定大鼠肾脏中过氧化物酶体增殖物激活受体γ(PPAR γ)、转化生长因子β1(TGF-β1)和结缔组织生长因子(CTGF) mRNA的表达水平。结果:海参能显著降低STZ诱导的糖尿病大鼠空腹血糖值、尿糖含量、肾脏指数以及尿总蛋白、mAlb和NAG排泄率(P<0.05或P<0.01),并且能显著上调糖尿病大鼠PPARγ mRNA,下调TGF-β1和CTGF(P<0.05) mRNA的表达。结论:海参对糖尿病大鼠具有良好的降血糖及改善肾脏滤过功能的作用,其机制可能与促进肾脏中PPARγmRNA的表达,抑制TGF-β1和CTGF mRNA的表达有关,最终实现对糖尿病大鼠肾脏的保护作用。
糖尿病;日本刺参;过氧化物酶体增殖物激活受体γ;转化生长因子β1;结缔组织生长因子
糖尿病肾病(diabetic nephropathy,DN)是糖尿病微血管并发症之一,已成为糖尿病病人死亡的主要原因。DN的典型病理改变是肾小球硬化,其发病机制目前还不完全清楚。已有研究表明,生长因子如过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor-γ,PPARγ)、转化生长因子β1(transforminggrowth factor beta 1,TGF-β1)和结缔组织生长因子(connective tissue growth factor,CTGF)在DN发病机制中起着重要作用,促使细胞外基质(extracelluar material,ECM)蛋白表达增多并抑制其降解[1-2],而ECM 在肾小球的异常沉积是引起肾小球硬化的主要原因[3]。
海参自古以来被誉为“海产八珍”之一,是世界上少有的高蛋白低脂低胆固醇的营养保健食品,海参中含有海参多糖、海参皂苷、胶原蛋白、脑苷脂、硫酸软骨素、维生素等多种活性成分,具有抗肿瘤、提高免疫力、调节血脂、延缓衰老等药理功能[4-7]。本实验用海参灌胃链脲佐菌素(streptozocin,STZ)诱导的糖尿病模型大鼠,研究其对糖尿病大鼠肾脏功能的调节作用,并通过RT-PCR检测肾脏PPARγ、TGF-β1和CTGF mRNA的表达情况,从分子水平上初步探究海参对肾脏的保护机制,旨在为其合理开发应用提供参考。
1 材料与方法
1.1 材料与试剂
干制日本刺参(Apostichopus japonicus),经超微粉碎后以蒸馏水配制成所需浓度悬浊液备用。
SD雄性大鼠,体质量(200±20)g,SPF级,北京维通利华公司。
链脲佐菌素(streptozotocin,STZ) 美国Sigma公司;葡萄糖试剂盒 中生北控生物科技有限公司;N-乙酰-β-D-氨基葡萄糖苷酶(N-a c e t y l-β-D-glucosaminidase,NAG)测定试剂盒 南京建成生物工程研究所;尿微量白蛋白(microalbuminuria,mAlb)测试盒 上海太阳生物技术公司;PPARγ、TGF-β1、CTGF及β-actin引物 上海生工生物工程技术服务有限公司。
1.2 仪器与设备
Model680酶标仪 美国Bio-Rad公司;UV-2550紫外-可见分光光度计 日本岛津公司;CP100MX离心机日本日立公司;ABI 7500PCR热循环仪 美国ABI公司;GIS-2008凝胶成像系统 上海天能公司;DYY-6B稳压稳流电泳仪 北京六一公司;HW.SY11-K电热恒温水浴锅 北京长风公司。
1.3 方法
1.3.1 模型建立及动物实验
SD大鼠适应性喂养5d,随机取出10只作为正常对照组,其余大鼠禁食不禁水12h,一次性腹腔注射STZ 60mg/kg。STZ临用前溶解于0.1mmol/L的柠檬酸-柠檬酸钠缓冲液(pH4.3),质量浓度为2g/100mL。正常对照组大鼠按10mL/kg注射相应体积缓冲液。继续饲养3d后,禁食不禁水5h,尾静脉采血测空腹血糖值,以血糖值≥16.7mmol/L者为造模成功[8]。
取造模成功的大鼠,按照体质量及血糖值随机分为模型对照组和海参剂量组,每组10只。剂量组大鼠灌胃海参 800mg/(kg·d),正常对照组和模型对照组灌胃生理盐水,灌胃体积为10mL/kg,每天1次,共8周。大鼠于实验结束前3d,单只入代谢笼收集24h尿液,离心分装,4℃保存待测;于末次给药后,大鼠禁食不禁水5h,尾静脉取血,按照试剂盒方法分离上清,待测血糖水平。处死大鼠,迅速摘取双肾称质量,取肾皮质0.1g置于液氮内保存、备用。
1.3.2 空腹血糖和尿糖含量的测定
按照试剂盒说明书测定。
1.3.3 尿总蛋白、mAlb排泄率(UAER)的测定
尿总蛋白含量,采用双缩脲法测定;尿总蛋白排泄率为尿蛋白含量与24h尿量乘积。mAlb含量,参照试剂盒方法检测;UAER为mAlb含量与24h尿量乘积。
1.3.4 尿液中NAG排泄率测定
尿液中NAG含量,参照试剂盒方法检测。NAG排泄率为尿液中NAG含量与24h尿量乘积。
1.3.5 肾肥大指数的测定

1.3.6 肾脏中TGF-β1、CTGF 和PPARγmRNA的表达量测定
采用Trizol试剂提取肾皮质总RNA。采用两步法RTPCR检测目的基因的表达量。PCR反应条件为:94℃预变性5min;94℃变性45s,退火30s,72℃延伸45s,循环数次;最后72℃再延伸10min。

表l 引物设计、退火温度及循环数Table 1 Primers, annealing temperatures and cycle numbers
对PCR产物进行2%琼脂糖凝胶电泳,并利用凝胶成像分析系统进行光密度扫描分析,以β-actin作为内参校正,用目的基因与β-actin条带灰度比值代表目的基因的相对表达含量。
1.4 统计学分析
数据分析采用SPSS11.0软件进行单因素方差分析。以P<0.05为具有统计学意义上的差异。实验结果用±s表示。
2 结果与分析
2.1 海参对空腹血糖和尿糖的影响
表2 海参对大鼠空腹血糖值、尿糖含量、肾脏指数以及尿总蛋白、mAlb排泄率的影响(±s,n=10)Table 2 Effect of Apostichopus japonicus on fasting blood glucose,urine glucose, kidney index and the excretion amounts of protein and mAlb in diabetic rats (±s,n=10)

表2 海参对大鼠空腹血糖值、尿糖含量、肾脏指数以及尿总蛋白、mAlb排泄率的影响(±s,n=10)Table 2 Effect of Apostichopus japonicus on fasting blood glucose,urine glucose, kidney index and the excretion amounts of protein and mAlb in diabetic rats (±s,n=10)
注:#.与正常对照组相比较,有显著性差异(P<0.05);##.与正常对照组相比较,有极显著性差异(P<0.01);*.与模型对照组相比较,有显著性差异(P<0.05);**.与模型对照组相比较,有极显著性差异(P<0.01)。
组别 空腹血糖值/ 24h尿糖值/尿总蛋白排泄率/ UAER/ 肾脏指数(mmol/L) (mmol/L) (mg/24h) (mg/24h) (g/kg)/正常对照组 6.51±0.56 0 10.40±2.75 0.37±0.05 3.84±0.50模型对照组30.02±2.05## 78.32±11.18##34.97±9.15# 0.87±0.05#7.29±0.67#海参组 21.26±3.05** 54.51±6.81** 30.24±6.94 0.70±0.07*6.10±0.78**
如表2所示,模型对照组的空腹血糖和尿糖含量均显著高于正常对照组(P<0.01)。经灌胃海参后,二者含量均显著下降;与模型对照组相比,分别降低了29.18%(P<0.05)和16.60%(P<0.01),表明海参对STZ诱导的糖尿病大鼠的高血糖症状具有明显的改善作用。
2.2 海参对尿总蛋白排泄率、UAER的影响
尿总蛋白及mAlb往往被作为早期糖尿病肾病的诊断指标。由表2可见,与正常对照组比较,模型对照组大鼠的尿总蛋白排泄率和UAER分别提高了236.25%(P<0.05)和135.14% (P<0.05),出现了明显的糖尿病肾病状态。与模型对照组相比,海参组尿总蛋白排泄率和UAER分别降低了13.53%和19.54%(P<0.05),表明海参能够降低尿总蛋白的排泄率并显著抑制尿中mAlb的排出,提示海参对糖尿病肾病大鼠有治疗作用。
2.3 海参对肾脏指数的影响
肾脏肥大是糖尿病肾病早期的重要病理特征。由表2可见,与正常对照组相比,模型对照组大鼠的肾脏指数升高了89.84%(P<0.05)。灌胃海参后肾肥大指数较模型对照组下降了16.32%(P<0.01),说明海参可显著抑制高血糖引起的肾脏肥大。
2.4 对尿液中NAG排泄率的影响
NAG是一种溶酶体酶,其活性增高可作为肾小管细胞损伤的早期标志物[9]。由图1可见,模型对照组大鼠NAG排泄率较正常对照组增高了2.87倍(P<0.01),说明模型大鼠已出现肾小管损伤。经灌胃海参后,海参组NAG排泄率较模型对照组降低了16.10%(P<0.05),表明海参对肾小管具有保护作用。

图1 海参对模型大鼠NAG排泄率的影响(±s,n=10)Fig.1 Effect of Apostichopus japonicus on the excretion amount of NAG in diabetic rats (±s,n=10)
2.5 对大鼠肾脏中TGF-β1、CTGF以及PPARγ mRNA表达量的影响
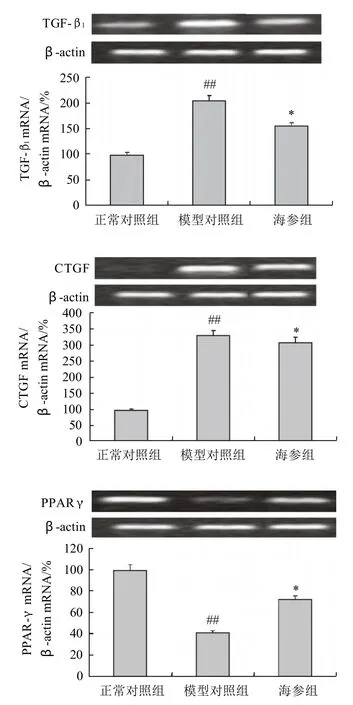
图2 海参对糖尿病大鼠 TGF-β1、CTGF以及PPARγmRNA 表达的影响(x-± s,n=10)Fig.2 Effect of Apostichopus japonicus on the expression of TGF-β1,CTGF and PPARγ in diabetic rats (±s,n=10)
由图2可见,模型对照组大鼠肾脏中TGF-β1和CTGF mRNA 表达均显著升高(P<0.01),灌胃海参样品后,二者表达量均显著降低,与模型对照组相比,分别下降了24.39%(P<0.05)和6.3%(P<0.05)。与此同时,模型对照组PPARγmRNA表达量明显下降(P<0.01),经灌胃海参后,PPARγmRNA表达量较模型对照组显著提高了77.99%(P<0.05)。
3 讨 论
糖尿病所致肾损伤是糖尿病严重的并发症之一,是糖尿病致残致死的重要原因,其病理学特征主要是肾脏体积增大,细胞外基质积聚,肾小球滤过率增加和蛋白尿[10]。高血糖是糖尿病、肾病的启动因素,也是DN发生和发展的基本因素,其可通过多种途径损害肾脏[11-12],因此,控制血糖是防治DN的关键。mAlb是反映肾小球滤过功能的主要指标,在正常情况下,mAlb很难通过肾小球基底膜,当糖尿病肾病发生后由于肾小球滤过膜电荷的丢失,尤其是基底膜孔径的改变,导致了mAlb的排出。NAG是来自肾近曲小管溶酶体内的酸性水解酶,是反映肾小管功能的灵敏指标[13]。蛋白尿不仅反映肾小球损伤,而且对肾小球系膜有毒性作用,损害肾小管间质等[14-15]。本实验通过检测STZ诱导的糖尿病大鼠的空腹血糖值、肾脏指数和尿总蛋白、mAlb、NAG的排泄率,综合评价了其肾损害的程度,结果表明,海参给药8周,可明显降低糖尿病大鼠空腹血糖值、尿糖值和肾脏指数,有效抑制尿总蛋白、mAlb和NAG的排泄率,增强肾皮质中PPARγmRNA的表达,降低肾皮质中TGF-β1、CTGF mRNA的表达。
近年来的研究发现,细胞因子的改变与DN的发病和细胞外基质成分的合成及代谢密切相关[16-17]。TGF-β是一种多功能的肽类物质,由多种细胞分泌的具有多重生物学效应的细胞因子,主要存在3种异构体,其中肾脏中以TGF-β1为主。TGF-β1是致肾小球硬化最强的细胞因子,主要由肾小球系膜细胞和肾小管上皮细胞分泌,通过自分泌与旁分泌途径,诱导肾小球及ECM积聚,加速 DN 的形成[18]。人体研究表明,DN时肾小球和肾小管间质部TGF-β1表达水平均升高[19]。本实验研究结果显示,海参能显著抑制糖尿病模型大鼠肾脏中TGF-β1mRNA的表达(P<0.05),说明抑制TGF-β1的表达是海参保护糖尿病大鼠肾脏的有效途径之一。
CTGF是一种富含半胱氨酸的生长调节因子,在肾脏中含量最丰富。在体外细胞培养实验中,应用特异性抗CTGF抗体或CTGF反义寡核苷酸探针,可有效抑制TGF-β诱导的成纤维细胞增生和胶原合成,这提示了CTGF作为TGF-β的下游调节因子, 介导和增强了TGF-β1的促胶原合成与致肾小球硬化作用[20]。Wang Shinong等[2]也认为,TGF-β是诱导糖尿病肾病大鼠近曲小管上皮细胞产生CTGF增多的主要原因,而CTGF作用于间质成纤维细胞,使ECM过量合成而沉积,最终导致糖尿病肾病大鼠肾间质纤维化的发生。本实验结果显示,海参可显著抑制DN大鼠肾脏中CTGF mRNA表达,进而抑制其肾脏纤维化的进程,起到保护肾脏的作用。
过氧化物酶体增殖物激活受体(PPARs)是一类由配体激活的核转录因子超家族,分为3种亚型,其中PPAR γ被认为是一种新的治疗肾脏疾病的靶点,其与TGF-β1和CTGF关系密切[21-22]。卢颖[23]认为,PPARγ活化可抑制TGF-β1及肾间质成纤维细胞激活,使CTGF表达和细胞外基质合成减少。Zeng等[24]也报道,PPARγ激动剂能延缓和减轻STZ诱导的糖尿病模型大鼠蛋白尿的发生和程度,减少肾小球细胞外基质的储积,下调TGF-β1的表达,与本实验结果一致,表明海参可激活PPARγ,继而调控下游的细胞因子,具有直接、有益的肾脏保护作用。
综上所述,海参对STZ诱导的糖尿病大鼠具有显著的降血糖及肾脏保护作用,其作用机制可能是海参中含有的多糖、皂苷、胶原蛋白和脑苷脂等活性成分通过激活PPARγ,抑制TGF-β1活性的发挥,下调CTGF的表达,从而减少ECM的积聚,抑制肾小球肥大,阻断和减轻肾脏微细血管病变,提高肾小球的滤过率,缓解肾小球硬化,以此实现对糖尿病大鼠肾脏的保护作用。
[1] MIZUNO S, MATSUMOTO K, KUROSAWA T, et al. Reciprocal balance of hepatocyte growth factor and transforming growth factor-β1in renal fibrosis in mice[J]. Kidney Int, 2000, 57(3): 937-948.
[2] WANG Shinong, DENICHILO M, BRUBAKER C, et al. Connective tissue growth factor in tubulointerstitial injury of diabetic nephropathy[J]. Kidney Int, 2001, 60(1): 96-105.
[3] 李兴, 张木勋. HGF对糖尿病肾病TGF-β1mRNA表达的影响[J].山西医科大学学报, 2006, 37(7): 703-706.
[4] 赵芹, 王静凤, 薛勇, 等. 三种海参的主要活性成分和免疫调节作用的比较研究[J]. 中国水产科学, 2008, 15(1): 154-159.
[5] 高森, 王静凤, 王玉明, 等. 冰岛刺参调节血脂及其作用机制[J]. 武汉大学学报, 2009, 55(3): 324-328.
[6] AMININ D L, PINEGIN B V, PICHUGINA L V, et al. Immunomodulatory properties of Cumaside[J]. Int Immunopharmacology, 2006, 6(7): 1070-1082.
[7] 胡晓倩, 王玉明, 任兵兴, 等. 海参主要活性成分对大鼠脂质代谢影响的比较研究[J]. 食品科学, 2009, 30(23): 393-396.
[8] 王静凤, 李晓林, 张珣, 等. 海参虫草复剂对糖尿病大鼠肾脏保护作用机制的研究[J]. 中国药理学通报, 2010, 26(9): 1238-1242
[9] 欧阳涓, 姜傥. 肾脏的损伤性诊断[J]. 中华检验医学杂志, 2005, 28(8): 877.
[10] LEEHEY D J, SINGH A K, ALAVI N, et al. Role of angiotensin Ⅱin diabetic nephropathy[J]. Kidney Int, 2000, 77: 93-98.
[11] 房辉, 徐刚, 于德民, 等. TGF-β1和 ECM 与糖尿病肾病关系的实验研究[J]. 中国糖尿病杂志, 2000, 8(4): 227- 230.
[12] 陈秋. IV 型胶原与糖尿病肾病[J] . 国外医学: 内分泌学分册, 1998,18(4): 206-209.
[13] 叶任高, 许韩师. 尿溶菌酶和N-乙酰-β-氨基葡萄糖苷酶测定对肾小管-间质病变的诊断价值[J]. 中国实用内科杂志, 1999, 19(4): 198.
[14] REMUZZI G, RUGGENENTI P, BENIGNI A. Understanding the nature of renal disease progerssion[J]. Kidney Int, 1997, 51: 2-15.
[15] BURTON C J, HARPER S J, BAILEY E, et al. Turnover of human tubular cells exposed to proteinsin vivoandin vitro[J]. Kidney Int,2001, 59: 507-514.
[16] AKAHORI H, OTA T, TORITA M, et al. Tranilast prevents the progression of experimental diabetic nephropathy through suppression of enhanced extracellular matrix gene expression[J]. J Pharmacol Exp Ther,2005, 314(2): 514-521.
[17] CHEN S, HONG S W, LGLESIAS-de la CRUZ M C, et al. The key role of the transforming growth factor beta system in the pathogenes is of diabetic nephropathy[J]. Renal Failure, 2001, 23: 471-481.
[18] ZIYADEH F N. Mediators of diabetic renal disease: the case for TGF-beta as the major mediator[J]. J Am Soc Nephrol, 2004, 15: 55-57.
[19] IWANO M, KUBO A, NISHINO T, et al. Quantification of glomerular TGF-β1mRNA in patients with diabetes mellitus[J]. Kidney Int, 1996,49: 1120 -1126.
[20] 宋恩峰, 刘蒙, 贾汝汉, 等. 厄贝沙坦对糖尿病肾病模型大鼠结缔组织生长因子的影响[J]. 医药导报, 2008, 7(8): 902-904.
[21] 刘辉, 于晓艳, 魏海峰, 等. PPAR γ激活对糖基化终末产物引起的大鼠肾系膜细胞TGF-β1及CTGF mRNA表达的影响[J]. 中国老年学杂志, 2010, 30(4): 1062-1064.
[22] WANG Weiming, LIU Feng, CHEN Nan. Peroxisome proliferator activated receptor-γ agonist the profibrotic response induced by TGF-β1in renal interstitial fibroblasts[J]. Mediators Inflamm, 2007, 10(7): 134-140.
[23] 卢颖. 过氧化物酶体增殖物激活受体-γ与肾脏纤维化的研究进展[J]. 上海交通大学学报: 医学版, 2010, 30(1): 104-107.
[24] ZENG F, FOMONI A, ELLIOT S J, et al. Upregulation of typeⅠcollagen by TGF-β in mesangial cells is blocked by PPARγ activation[J]. Am J Physiol Renal Physiol, 2002, 282(4): 639-648.
Protective Effect and Mechanism ofApostichopus japonicuson Kidney of Diabetic Rats
LONG Teng-teng,WANG Jing-feng,ZHAO Qin,ZHANG Xun,LI Xiao-lin,XUE Chang-hu,LI Zhao-jie*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Objective: To explore the protective effect ofApostichopus japonicuson the kidney of streptozotocin (STZ)-induced diabetic rats and its possible mechanisms. Methods: A diabetic rat model was developed by a single intraperitoneal injection of STZ at the dose of 60 mg/kg and kidney damage was induced by long-term high levels of blood glucose. The diabetic rats were administered withApostichopus japonicusat the daily dose of 800 mg/kg for 8 consecutive weeks. The changes in fasting blood glucose, urine glucose, renal index, and the excretion amounts of urine protein, mAlb and NAG were determined. The mRNA expression of peroxisome proliferation activated receptor-γ (PPAR γ), transforming growth factor beta 1 (TGF-β1) and connective tissue growth factor (CTGF) in kidney were assessed by RT-PCR. Results:Apostichopus japonicusshowed remarkable a suppressive effect on fasting blood glucose, uric glucose, kidney index and the excretion amounts of protein, mAlb and NAG in diabetic rats. The expression level of PPARγ mRNA was markedly increased, while the mRNA expression levels of TGF-β1 and CTGF were effectively suppressed byApostichopus japonicus. Conclusion:Apostichopus japonicuscan remarkably reduce blood glucose through improving the expression of PPAR γ and restraining the expression of TGF-β1 and CTGF, which results in a protective effect on kidney damage.
diabetes;Apostichopus japonicus;PPARγ;TGF-β1;CTGF
R322.6;R587.1
A
1002-6630(2012)01-0252-05
2011-03-11
国家海洋局海洋公益性行业科研专项(201105029);国际科技合作项目(2010DFA31330)
龙腾腾(1986—),女,硕士研究生,研究方向为海洋生物活性物质。E-mail:kenanlong@126.com
*通信作者:李兆杰(1970— ),男,高级工程师,研究方向为水产品加工。E-mail:lizhaojie@ouc.edu.cn
