产单宁酶菌株的筛选及选育
2012-10-25陶素芬赵祥颖刘建军
陶素芬,赵祥颖,刘建军,,*
(1.山东轻工业学院食品与生物工程学院,山东 济南 250353;
2.山东省食品发酵工程重点实验室,山东 济南 250013)
产单宁酶菌株的筛选及选育
陶素芬1,赵祥颖2,刘建军1,2,*
(1.山东轻工业学院食品与生物工程学院,山东 济南 250353;
2.山东省食品发酵工程重点实验室,山东 济南 250013)
为得到高产单宁酶的菌株,从多年种植的茶园、柿子园以及掩埋柿子、五倍子和茶叶的花园土壤中通过平板初筛和三角瓶固体发酵复筛筛选到一株产单宁酶的曲霉菌株DNM1-39,固体培养其产单宁酶活力为1.58U/g。以DNM1-39为出发菌株,经紫外线照射、硫酸二乙酯单独处理和紫外线照射-硫酸二乙酯复合诱变处理,获得突变株UD-6,其产酶活力达2.80U/g。连续传代实验结果表明,该菌株产酶活力不变,性能稳定。
单宁酶;单宁;没食子酸;筛选;诱变
单宁酶即单宁酯酰水解酶,它可以水解没食子酸单宁中的酯键和缩酚羧键,生成没食子酸和葡萄糖[1]。单宁酶在食品、啤酒、葡萄酒、饲料加工和精细化工等行业都有着广泛的应用,例如可以用来处理茶饮料的浑浊及酒类的沉淀,降低它们的涩味,提高它们的感官品质,具有高效、无毒副作用的优势[2-3]。
生产单宁酶的关键就是要有高产酶能力的菌株,目前国内外关于这方面的报道,筛选出的菌多是黑曲霉[4-5]、青霉[6]、细菌[7-8],少量的毛霉、根霉[9-10]。高产单宁酶菌种的选育是提高单宁酶产量和质量的先决条件。本研究从茶园土壤中筛选单宁酶产生菌,并对其进行物理化学诱变,以获得单宁酶产量高、遗传性状稳定的菌株。
1 材料与方法
1.1 材料与试剂
土样采自日照茶园、柿子园以及笔者掩埋柿子、五倍子和茶叶的花园土壤。茶叶购自济南某茶叶店,五倍子购自济南某中药铺。
没食子酸标准品 中国药品生物制品检定所;硫酸二乙酯(DES)等所用试剂均为国产分析纯。
1.2 培养基
富集培养基[11]:五倍子粉10g、水10mL。平板初筛培养基:蔗糖20g、NaNO33.0g、K2HPO41.0g、MgSO4·7H2O0.5g、KCl 0.5g、FeSO4·7H2O 0.01g、1%溴酚蓝 30mL、单宁 10g、琼脂 20g、加水定容至1000mL,pH值自然,121℃灭菌20min。 斜面培养基:马铃薯 200g,切成小块,加1000mL水煮沸30min,用双层纱布滤成清液,加水补充减少的水分,蔗糖 30g、单宁 1.5g、琼脂 20g、121℃灭菌30min。固体初筛培养基:将麸皮(每100g麸皮添加2g单宁)与盐溶液(盐溶液(g/L):NaCl 1、MgSO4·7 H2O 1、NH4Cl 10)按固液比1:1(m/V)混合均匀,121℃灭菌30min。固体复筛培养基:同固体初筛培养基。平板完全培养基:蔗糖 2 0 g、N a N O33.0 g、K2H P O41.0 g、MgSO4·7H2O 0.5g、KCl 0.5g、FeSO4·7H2O 0.01g、单宁10g、琼脂 20g、加水定容至1000mL,pH值自然,121℃灭菌20min。
1.3 仪器与设备
GNP-9080型隔水式恒温培养箱 上海精宏实验设备有限公司;HG-超净工作台 北京东联哈尔滨仪器制造有限公司;CHK-BI45光学显微镜 日本日立公司;BH-2 Olympus显微镜 日本Olympus Optical公司;722型可见分光光度计 上海菁华科技仪器有限公司;HH-S21-4电热恒温水浴锅 北京长安科学仪器厂;DGB/20-002台式干燥箱 重庆实验设备厂。
1.4 方法
1.4.1 菌株筛选方法
1.4.1.1 平板初筛
取1g土样,磨碎后加入到富集培养基中,30℃恒温培养36h,适当稀释后涂布于平板初筛培养基上,30℃恒温培养72h,观察菌落生长情况,将产透明圈较大或使培养基变黄的单菌落转接到斜面保藏培养基上。
1.4.1.2 菌种初筛
每个250mL三角瓶装10g固体初筛培养基,以1株接1瓶的方式进行接种,30℃恒温培养72h。发酵结束后,测定各株菌发酵产物的酶活力,选取较高的菌株进行下一步的复筛。
1.4.1.3 菌种复筛
每个250mL三角瓶装10g固体复筛培养基,以1株接3瓶的方式接种初筛所得菌株,30℃恒温培养72h,然后测定各菌株发酵产物的酶活力。经多次复筛,多次传代培养,以得到酶活力很高且能稳定遗传的菌株。
1.4.2 单宁酶的浸提
培养结束后向三角瓶中加入50mL pH5.0的柠檬酸缓冲液,用玻璃棒使固体发酵基质分散,然后置于摇床上,振荡浸提90min,然后用滤纸过滤,滤液用于酶活力测定[11]。
1.4.3 单宁酶活力的测定[12]
取7支试管,分别为空白管(0)、样品管(1、2、3)、对照管(4、5、6),并依次标记。试管中分别加入0.25mL 1mmol/L没食子酸丙酯溶液,放入30℃水浴中预热5min,然后在空白管中加入0.25mL柠檬酸缓冲液,在样品管和对照管中,分别加入0.25mL对应的经预热后的浸提酶液和沸水浴灭活酶液,再放入30℃水浴中保温5min。所有试管分别加入0.3mL 0.05mol/L乙醇-绕丹宁溶液,30℃水浴中再保温5min,再分别加入0.5mol/L的KOH溶液0.2mL,30℃再保温5min,然后每支试管再加4mL蒸馏水,30℃保温5min后在520nm波长处测定反应混合物的吸光度。所有测定都做3个平行实验,取算术平均值。酶活力单位定义:在上述反应条件下每分钟产生1μmol没食子酸所需的酶量定义为一个酶活力单位(U)。
1.4.4 菌种诱变
1.4.4.1 孢子悬浮液制备
取培养96h的新鲜斜面培养基,刮取孢子两环于装有玻璃珠和30mL无菌生理盐水的250mL三角瓶中,充分打散,过滤去除菌丝体和成团孢子,再用无菌生理盐水洗涤两遍,加入生理盐水振荡,使孢子均匀悬浮在液体中,使孢子浓度控制在108~109个/mL。
1.4.4.2 紫外线(UV)诱变[13]
20W的紫外灯预热20min,取孢子悬液10mL,置于直径9cm的无菌培养皿中,放置于紫外灯诱变箱内,照射距离为30cm,照射时间分别为60、75、90、105、120、150s,适当稀释后涂布完全培养基的平板,未经处理的孢子悬液适当稀释后也涂布完全培养基的平板,30℃恒温避光培养96h,统计两种平板上的菌落数以及菌落周围透明圈大小,分别计算诱变致死率和正突变率。选择正突变率最高的照射时间处理筛选获得的产酶菌株,挑选透明圈直径和菌落直径比(D/d)较大的菌落,进行固体发酵初筛、复筛。并做传代稳定性实验。致死率和正突变率计算公式如下。

1.4.4.3 硫酸二乙酯诱变[14-15]
吸取50%的硫酸二乙酯-乙醇溶液0.3mL于250mL三角瓶中,加入0.1mol/L pH 5.0的柠檬酸-柠檬酸钠缓冲液5mL和待诱变菌株的孢子悬液5mL,于30℃分别振荡处理15、30、45、60、75min,处理完毕后加入1mL 25%的硫代硫酸钠溶液终止反应,适当稀释后涂布平板完全培养基,30℃恒温培养96h,计算诱变致死率和正突变率,选择最佳处理时间。
用所选时间处理待诱变菌株的孢子悬液,挑选透明圈直径和菌落直径比(D/d)较大的菌落,进行固体发酵初筛、复筛。并做传代稳定性实验。
1.4.4.4 UV-硫酸二乙酯复合诱变处理
吸取孢子悬液9.5mL,置于直径9cm的无菌干燥培养皿中,在培养皿中加入50%的硫酸二乙酯-乙醇溶液0.5mL,用20W的紫外灯照射,照射距离30cm,照射一定时间,适当稀释后涂布于完全培养基平板上,30℃恒温避光培养96h,挑选D/d较大的菌落,进行固体发酵初筛、复筛。
2 结果与分析
2.1 产单宁酶菌株的筛选结果
从筛选材料中,经过平板初筛共计得到290株产透明圈的菌株,将上述菌株接种固体发酵培养,然后测定各菌株酶活力的大小。通过3轮筛选,得到30株产酶活力较高的菌株,再以1株接3瓶复筛得到12株产酶活力高且稳定的菌株,结果见表1。
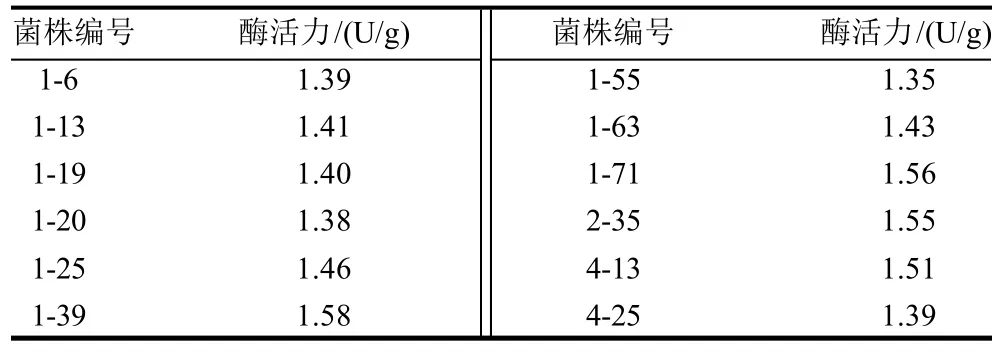
表1 产单宁酶菌株的筛选Table 1 Screening of tannase-producing strains
由表1可见,分离自茶园土样的霉菌菌株1-3 9(DNM1-39)产单宁酶活力最高,经过多次传代培养,该菌株产酶性能稳定,因此选择该菌株为出发菌株进行诱变处理,进一步提高其产酶活力。
2.2 菌株DNM1-39的诱变
2.2.1 紫外线照射诱变结果

图1 紫外线照射时间与致死率和正突变率的关系Fig. 1 Relationships between ultraviolet irradiation time and lethal rate or positive mutation rate
由图1可以看出,随着照射时间的延长致死率逐渐升高直至稳定,而正突变率在开始90s内呈上升趋势,处理时间再延长正突变率反而下降,所以选取90s作为紫外线诱变的照射时间。
将被紫外灯照射90s的菌悬液稀释涂布分离平板,30℃恒温培养72h后,选取透明圈较大的183株菌,经过发酵初筛、复筛后得到10株的酶活力较高的菌株(表2),其中酶活力最高的为突变株UV-27,酶活力达到1.95U/g,是出发菌株DNM1-39的1.23倍。
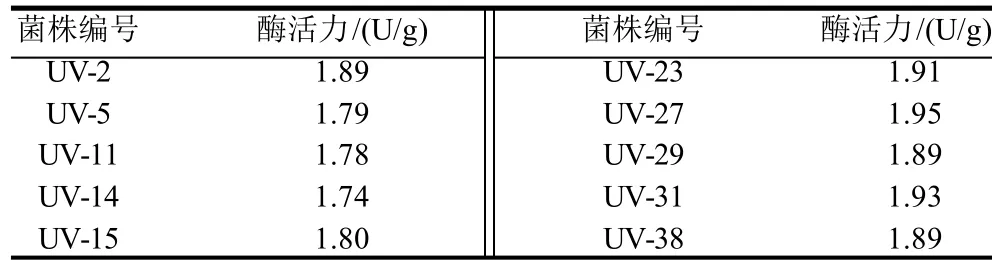
表2 紫外线照射诱变菌株筛选结果Table 2 Mutant strains with high tannase activity induced by ultraviolet irradiation
对菌株UV-27进行传代培养实验,传至第6代,发酵酶活力仍为1.94U/g,表明该突变株产酶性能稳定。为了获得更高酶活力的菌株,选择菌株UV-27进行下一轮硫酸二乙酯诱变选育。
2.2.2 硫酸二乙酯诱变结果
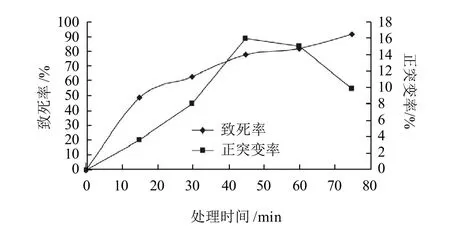
图 2 硫酸二乙酯处理时间与致死率和正突变率的关系Fig. 2 Relationships between DES treatment time and lethal rate or positive mutation rate
由图2可知,随着处理时间的延长致死率逐渐升高,而正突变率在处理时间为45min时达到最大,因此选取45min作为硫酸二乙酯诱变的处理时间。
菌株UV-27经过硫酸二乙酯处理45min的初筛、复筛后结果见表3。其中产酶活力最高的突变株为菌株DES-10,酶活力达到2.19U/g,是菌株UV-27的1.39倍。且多次传代后能稳定产酶。继续对菌株DES-10进行紫外线和硫酸二乙酯复合诱变处理。

表3 硫酸二乙酯诱变处理筛选到的高产菌株Table 3 Mutant strains with high tannase activity induced by DES
2.2.3 UV-硫酸二乙酯复合诱变处理DNM1-39,通过对其进行物理、化学诱变,选育到一株产酶活力有明显提高的菌株UD-6,其酶活力达到了2.80U/g,是出发菌株DNM1-39的1.77倍。菌种选育是实现发酵生产最关键的一步。紫外线照射诱变和硫酸二乙酯诱变均使单宁酶的产量得到了提高,并且得到遗传性状稳定的菌株。

表4 UV-硫酸二乙酯复合诱变处理筛选到的高产菌株Table 4 Mutant strains with high tannase activity induced by both ultraviolet irradiation and DES
由表4可知,菌株DES-10经紫外线和硫酸二乙酯复合诱变处理后经过多次初筛、复筛,最终得到1株单宁酶产量较高的菌株UD-6,连续传代6次,其单宁酶活力仍能达到2.55U/g。
按照1.4.1.3节的方法,考察突变株UD-6的产单宁酶固体发酵进程,结果见图3。

图3 菌株UD-6发酵进程曲线Fig. 3 Fermentation course curve of strain UD-6
由图3可见,突变株UD-6培养前期主要进行菌体的生长,酶活力增加比较缓慢。培养30h后酶活力迅速增加,50h后候趋于平稳,60h时单宁酶活力达最高值2.80U/g。由此分析,如果进行发酵条件的进一步优化,菌株UD-6所产单宁酶活力仍有进一步提升的空间。
3 结 论
本实验从自然环境中分离筛选到一株单宁酶产生菌
[1] 李秧针, 邱树毅, 保玉心, 等. 单宁酶发酵生产的研究进展[J]. 中国酿造, 2008(11): 1-6.
[2] 刘如石, 邱义兰, 谢达平, 等.Asp.nigerNo.3单宁酶纯化及性质的研究[J]. 食品与机械, 2000(4): 15-16.
[3] 郭鲁宏, 杨顺楷. 单宁酶产生菌的筛选和发酵条件研究[J]. 应用与环境生物学报, 1998, 4(4): 386-389.
[4] 刘如石, 李清明, 谢达平, 等.Asp.nigerNo.3液态发酵生产单宁酶条件的研究[J]. 食品科学, 2001, 22(2): 28-32.
[5] SHARMA S, AGARWAL L, SAXENA R K. Statistical optimization for tannase production fromAspergillus nigerunder submerged fermentation[J]. Indian J Microbiol, 2007, 47: 132-138.
[6] 刘小兰, 杨顺楷, 王忠彦. 青霉单宁酶高活性菌株的诱变选育[J]. 微生物学杂志, 2006, 26(3): 108-110.
[7] HADI T A, BANERJEE R, BHATTACHARYYA B C. Optimization of tannase biosynthesis by a newly isolatedRhizopus oryzae[J]. Bioprocess Engineering, 1994(11): 239-243.
[8] MONDAL K C, BANERJEE R, PATI B R. Tannase production byBacillus licheniformis[J]. Biotechnology Letters, 2000, 22(9): 767-769.
[9] AYED L, HAMDI M. Culture conditions of tannase production byLactobacillus plantarum[J]. Biotechnology Letters, 2002, 24: 1763-1765.
[10] KUMAR R, KUMAR A, NAGPAL R, et al. A novel and sensitive plate assay for screening of tannase-producing bacteria[J]. Ann Microbiol,2010, 60: 177-179.
[11] 郭鲁宏, 杨亚力, 金丹, 等. 黑曲霉单宁酶产生菌的筛选及处理滇橄榄汁的研究[J]. 天然产物研究与开发, 2006, 18(增刊1): 16-18.
[12] 保玉心, 邱树毅, 李秧针, 等. 一种胞外单宁酶的活力检测方法[J].精细化工, 2008, 25(6): 621-624.
[13] 卞小莹, 吴文君, 王群利, 等. 秦岭链霉菌的原生质体再生与诱变育种[J]. 微生物学通报, 2008, 35(6): 929-933.
[14] 孙金凤, 吴薇, 潘翔. 产壳聚糖酶菌株的分离筛选及其诱变育种[J].工业微生物, 2008, 38(2): 56-59.
[15] 周定, 王建龙. 柠檬酸产生菌黑曲霉诱变选育的研究[J]. 微生物学杂志, 1993, 13(2): 4-7.
Breeding and Screening of a High-Yield Tannase-Producing Strain
TAO Su-fen1,ZHAO Xiang-ying2,LIU Jian-jun1,2,*
(1. School of Food and Biological Engineering, Shandong Polytechnic University, Jinan 250353, China;
2. Research and Design Institute of Food and Fermentation Industries of Shandong Province, Jinan 250013, China)
Tannase plays an important role in the food and fine chemical industries. The breeding and screening of a strain with high tannase activity are desired. A tannase-producing strain, DNM1-39, was isolated from resources rich in tannin. The activity of tannase in solid state medium after fermentation by the strain was 1.58 U/g. The strain was identified asAspergillusthrough morphologic observation. A mutant strain named as UD-6 was obtained from DNM1-39 mutagenization with ultraviolet irradiation alone, DES treatment alone and both of them. The tannase activity produced by UD-6 was 2.80 U/g. The tannaseproducing ability of UD-6 remained the same after continuous passages and displayed excellent genetic stability.
tannase;tannin;gallic acid;screening;mutagenesis
Q815
A
1002-6630(2012)01-0226-04
2011-01-26
陶素芬(1985—),女,硕士研究生,研究方向为微生物资源开发。E-mail:taosufen3729@126.com
*通信作者:刘建军(1962—),男,教授,博士,研究方向为微生物资源开发。E-mail:liujj-2000@163.com
