N-烷基芳胺合成的研究进展
2012-10-19严新焕
杨 芳,严新焕
(浙江工业大学绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310014)
进展与述评
N-烷基芳胺合成的研究进展
杨 芳,严新焕
(浙江工业大学绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310014)
N-烷基芳胺是非常重要的有机原料和精细化工中间体,广泛应用于染料、塑料、医药和农药等领域。介绍了芳胺与烷基化试剂如卤代烃、羰基化合物、醇等进行的取代烷基化反应合成N-烷基芳胺的反应机理及烷基化工艺;重点阐述了以芳香硝基化合物为原料一锅法合成N-烷基芳胺的生产工艺,分别讨论了以羰基化合物、腈、醇作为烷基化试剂的优劣,认为以醇为烷基化试剂的反应条件温和、不需要添加任何配体,具有较好的应用前景。指出开发适合以醇为烷基化试剂的选择性高的催化剂是以后的研究方向。
芳胺;芳香硝基化合物;N-烷基芳胺;N-烷基化
N-烷基芳胺是重要的化工原料,广泛应用在有机合成、化学中间体、染料、橡胶助剂、农药、医药等领域[1-2]。随着染料、橡胶工业的不断发展,农药、医药的用量也不断增加,N -烷基芳胺的需求量迅速增长,与其相应的合成开发也备受关注。
N-烷基芳胺的合成一般采用芳胺和烷基化试剂(醇、醚、卤代烃、硫酸酯等)为原料,生产方法分为液相法和气相法[3]。传统的液相法一般以H2SO4、H3PO4以及氢卤酸等无机酸为催化剂。其合成工艺的优点是反应温度低、产物选择性高,缺点是生产效率低、对设备腐蚀严重、废酸排放量大。现多以负载型贵金属为催化剂,避免酸对设备的腐蚀,且催化活性高,但贵金属价格相对昂贵。气相法则采用分子筛、金属氧化物等为催化剂,其合成工艺的优点是设备投资少、避免了对环境污染和设备腐蚀、操作简便、生产成本低,缺点是选择性比液相法低、催化剂容易失活。目前,国内大部分生产单位仍采用液相法生成,其主要原因是液相法技术相对比较成熟。
以芳胺为初始原料合成N-烷基芳胺的方法中,芳胺主要由芳香硝基化合物通过化学还原法或者催化加氢法制得。其中化学还原法通常采用铁粉、锌粉和硫化物等将芳香硝基物还原为芳胺,但该过程中产生大量的污染物[4]。近年来国内外许多研究工作者将芳香硝基化合物加氢还原生成芳胺和芳胺N-烷基化反应在同一催化剂下同一反应器内连续制备N-烷基芳胺,工艺大为简化,产品损失少,收率高,该过程属清洁工艺,对环境友好,发展前景较为广阔。本文对近年来国内外以芳胺为初始原料合成N-烷基芳胺进行了综述,着重介绍了以芳香硝基化合物为初始原料合成N-烷基芳胺的研究进展。
1 芳胺N-烷基化反应
芳胺烷基化反应按反应类型及所用烷基化试剂可分为3种:以醇、卤代烷烃和酯类为烷基化试剂的取代烷基化;以丙烯酸衍生物、环氧化合物等为烷基化试剂的加成烷基化;以醛和酮为烷基化试剂的缩合还原烷基化。
1.1 取代烷基化
取代烷基化是应用最广泛的烷基化工艺,最常用的烷基化试剂有卤代烷烃、醇和酯。醇为烷基化试剂的反应需加催化剂方能使之顺利进行。以卤代烷烃和酯类为烷基化试剂,反应条件比以醇为烷基化试剂温和,但烷基化试剂价格比醇高,且原料对环境造成污染。取代烷基化反应得到的烷基化产物的选择性不高,很容易得到双取代或多取代物。
Narayanan等[5]认为芳胺的烷基化反应是连续的反应,他们认为芳胺先与烷基化试剂发生单取代烷基化,接下来生成的二烷基芳胺是由单烷基芳胺反应而来的(图1)。
芳胺与醇进行N-烷基化反应也是很常见的合成路线。但是醇是弱亲电试剂,不容易进行N-烷基化反应,为了解决这个问题,通常采用过渡金属作为催化剂,通过氢转移的过程将醇转变为具有较强亲电性的羰基化合物。羰基化合物再与胺反应得到亚胺,亚胺经过还原后最终得到相应的N-烷基胺[6](图2)。
1.2 加成烷基化
芳胺与丙烯酸衍生物、环氧化合物为烷基化试剂的加成烷基化中,常用于芳胺引入羟乙基、氰乙基、羧乙基等N-乙基衍生物的制备。但由于两个氢原子具有相似的活性,进行双烷基化反应的概率很大,且在烷基化过程中还有聚合及O-烷基化等副反应发生,因而需要控制烷基化试剂的用量[7]。生成的产物都带有羟基,还需要进一步处理掉羟基[8]。无法与其它直接烷基化反应相比,应用较少。
1.3 缩合还原烷基化
缩合还原烷基化是先由醛、酮和芳胺缩合生成席夫碱,然后在还原剂作用下制得仲胺。如伯胺或仲胺用甲醛和甲酸进行还原甲基化反应机理见图3[8]。
2 以芳胺为原料合成N-烷基芳胺
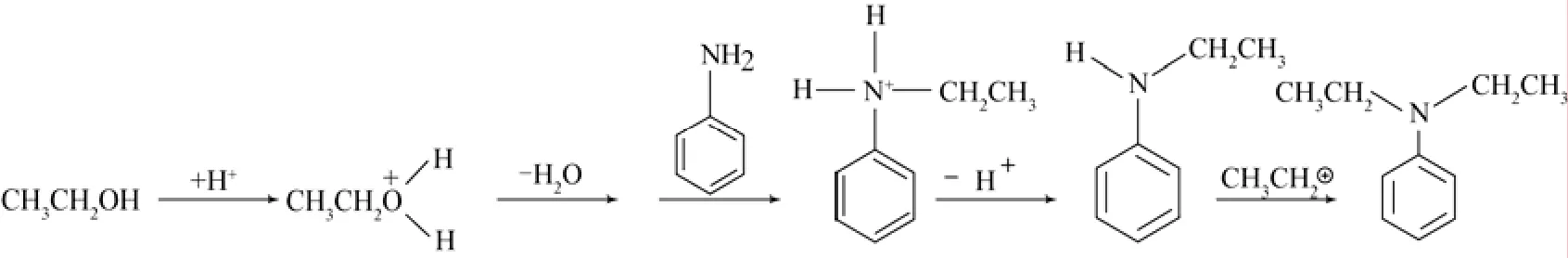
图1 苯胺N-乙基化反应机理
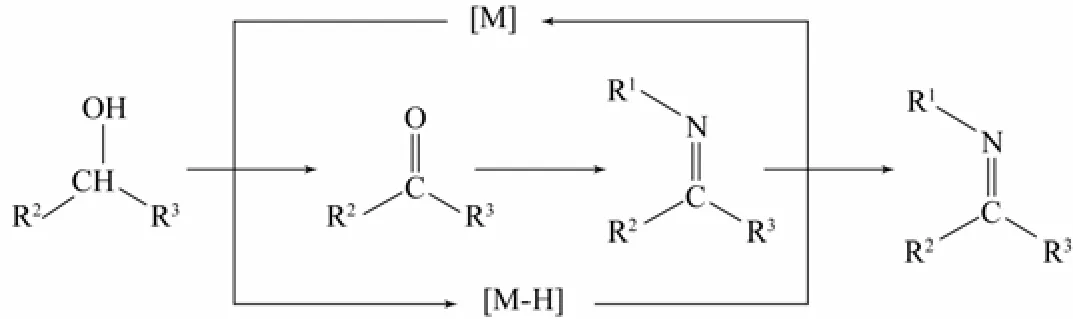
图2 醇为烷基化试剂的反应机理

图3 还原烷基化机理
芳胺N-烷基化反应是有机合成中的一类重要反应,最常用的合成方法是芳胺和烷基化试剂如醇、醚、卤代烷以及硫酸酯等进行烷基化反应。生产方法分为两大类,即液相法和气相法。
2.1 液相法制备
传统的液相法所用催化剂一般为H2SO4、H3PO4及氢卤酸等无机酸,反应需在高压下进行,对设备要求苛刻,且副产物多,三废处理难,生产间歇进行,效率低。现多以负载型贵金属为催化剂,将芳胺与烷基化试剂(卤代烃、羰基化合物和醇)进行N-烷基化反应。该工艺不需要使用酸作为催化剂,但是贵金属价格昂贵。
2.1.1 以卤代烃为烷基化试剂
Basu等[9]采用硅胶为催化剂,探讨在室温下胺与卤代烃发生N-烷基化反应。发现烷基化试剂的用量对烷基化产物的选择性有很大的影响。当卤代烃与胺的摩尔比为1∶1时,主要得到单烷基化产物。而当加入过量的卤代烃则有利于二取代烷基化产物的生成。且该催化剂可以循环使用10次以上。Gawande等[10]使用Al2O3-OK为催化剂,在常温下胺与卤代烷烃反应。结果表明,在K2O存在下,以乙腈为溶剂反应效果最好,收率为85%。该反应对不同的卤代烃和胺都适用。
2.1.2 以羰基化合物为烷基化试剂
以羰基化合物为烷基化的反应,首先得到过渡态的亚胺,经过还原后得到烷基化产物。Gomez等[11]以Ni为催化剂,羰基化合物与NH3和H2反应合成相应的二级胺。Stoter等[12]用酮与胺在加入分子筛后,能够得到85%的选择性和94%的ee值。该反应适用于多种芳胺以及杂环芳胺。Mizuta等[13]以Ir为催化剂,胺与相应的醛在Et3SiH存在下反应,得到相应三级胺收率为99%。但该反应过程中需要使用高活性的羰基化合物,且醛和醇很容易发生羟醛缩合,生成不可逆的副产物。
2.1.3 以醇为烷基化试剂
醇作为烷基化试剂由于其廉价易得,且生成的副产物只有水,对环境友好,具有很大的应用前景。Saidi等[14]以[Cp*IrI2]2为催化剂,在水中不加碱及其它添加剂情况下胺与醇进行烷基化反应。结果显示,对于无分支的芳胺与醇反应得到二级胺的收率为94%。而在无水条件下,反应5 h的转化率只有48%。采用不同的醇与胺反应,芳香醇与胺可获得98%的收率,对于直链醇也能顺利进行,得到80%~90%的收率。Hamid等[15-16]以[Ru(p-cymene)Cl2]2为催化剂,在温和的反应条件下考察不同配体对反应的影响。结果表明,以1,1'-双(二苯基膦二茂铁)(DPPF)为配体,在10% K2CO3存在下,单烷基胺的收率达到100%。Kwon等[17]以Pd为催化剂,考察不同载体、不同醇以及不同胺对反应的影响。研究表明,Pd/AlO(OH)的催化活性最高,对于大部分的醇和胺,在1 atm(1atm=1.013×105Pa)H2室温下得到单烷基化产率>80%,而在1 atm O290℃环境下,则可以得到>90%的亚胺。
近年来,也有许多研究者使用非贵金属为催化剂。Martinez等[18]以廉价易得的赤铁矿为催化剂,分别考察在碱存在下芳胺和直链胺以及芳香醇和直链醇对单烷基化产物的影响。研究表明,含有吸电子基团和供电子基团的芳胺与芳香醇反应得到较高的收率。对于富含电子的杂原子化合物,单烷基化产物选择性>99%。但直链醇与直链胺基本无反应。Likhar等[19]以Cu/Al水滑石为催化剂,在K2CO3存在下,考察含不同取代基团的醇和胺对N-烷基化产物的影响。研究表明,对于大部分的醇和胺,在160 ℃下反应9 h,得到单烷基化产物的收率为70%~98%。
Zhang等[20]以Pd/Fe2O3为催化剂,在不添加任何碱和有机配体、160 ℃下,芳香醇与胺反应可以得到>90%的收率,直链醇与胺反应得到80%~86%的收率,直链醇与直链胺反应得到78%~81%的收率。Fujita等[21]以[Cp*IrCl2]2为催化剂,在K2CO3存在下,芳胺与芳香醇反应可以得到>83%的产率,与直链醇反应,产率为63%~79%,而对于环状脂肪醇,收率为85%以上。
2.2 气相法
气相法以固体酸为催化剂,避免了无机酸对设备的严重腐蚀,反应条件温和,消除了对环境的严重污染,但选择性低,催化剂易失活。气相法进行芳胺N-烷基化反应的催化剂主要包括黏土、分子筛、氧化物、过渡金属催化剂等。
Yadav等[22]研究了各种醇与胺在K10催化作用下的反应情况。结果表明,弱酸环境以及低温有利于N-烷基产物的生成。各种烷基化产物的稳定顺序为:p-烷基胺>o-烷基胺>N-烷基胺。此外,烷基的链长对产物的稳定性也有影响,其顺序为:N-甲基胺>N-乙基胺>>N-异丙基胺>N-丁基胺>>N-四丁基胺。Nehate等[23]将十二钨磷酸(DTPA)负载在K10上催化合成N-甲基苯胺。结果表明,20%(质量分数)的DTPA/K10反应效果最佳,胺的转化率为79%,N-甲基苯胺的选择性达到99%。
分子筛作为固体酸催化剂用于烷基化反应已被广泛报道。Luque等[24]以Al-MCM-41为催化剂,考察了反应温度、催化剂酸度对产物的影响。结果表明,催化剂经过NH4F处理后,得到单烷基化的选择性高,且催化剂不易失活。低温、中等酸度有利于N-烷基化反应,而高温、强酸则更有利于C-烷基化反应。
氧化物也是使用在工业过程中的催化剂之一,广泛用在脱氢、氧化、氨解氧化、聚合等反应中。陶克毅等[25-26]采用乙醚作为烷基化试剂,以氧化铝为催化剂对气相法合成N,N-二乙基苯胺进行了研究,考察了反应温度、原料配比和空速等因素对反应的影响。结果表明,在反应温度为310 ℃、空速1.0 h-1,n(乙醚)/n(苯胺)=1.5时,反应效果最好,且该催化剂具有很好的稳定性。以苯胺和甲醇混合物为原料,结果表明,在甲醇/苯胺摩尔比为3∶1、苯胺液体空速为0.5 h-1、反应温度为300 ℃时,苯胺的转化率接近100%,N,N-二甲基苯胺的选择性达到95%,没有苯环取代物生成。唐靖等[27]在固定床催化反应器中研究了常压下芳胺和醇的气相法N-烷基化反应,考察了反应条件对该反应的影响。结果表明,当甲醇和苯胺的摩尔比为3∶1时,反应温度为280 ℃,液体空速为0.3 h-1的条件下,苯胺转化率为99%,生成N,N-二甲基苯胺的选择性为92%。此外还考察了不同取代基团对反应的影响,其转化率顺序为:苯胺≈对甲苯胺≈间甲苯胺>邻甲苯胺。随着醇中碳原子数目的增加,醇的反应活性降低,正构醇和苯胺反应与异构醇和苯胺反应随温度升高的变化趋势相反。
过渡金属及其氧化物用于芳胺N-烷基化反应因具有转化率高、选择性好、产品质量高、三废少等优点而应用较广。Vijayaraj等[28]以Cu1-xZnxFe2O4为催化剂催化芳胺衍生物进行单N-甲基化反应。在最佳的反应条件下(MeOH∶胺∶水=3∶1∶1,空速为3.58 h-1,反应温度为543~603 K),当x=0.5时,胺的转化率最高。由于电子效应的影响,邻位和对位取代的衍生物中胺的转化率降低,空间效应只影响二取代基团的衍生物。当甲醇的量增大时,形成N,N-二甲基化产物的选择性增加。
3 以芳香硝基化合物为原料合成N-烷基芳胺
上述N-烷基化反应都是采用芳胺为初始原料,而芳胺主要由芳香硝基化合物通过化学还原法或者催化加氢法制得,导致产物分离难,效率不高。因此,如果把上述两个工艺放在同一反应器内进行,则简化了生产步骤,提高了生产效率、降低了成本。且中间产物不需要分离,避免了大多数芳胺毒性大、易变质、不易储存的缺点,是一种有较大发展前途的生产工艺。近年来也有很多相关报道。
3.1 以羰基化合物为烷基化试剂
Bae等[29-30]以10% Pd/C为催化剂,羰基化合物为烷基化试剂,采用B10H14为还原剂,室温下将芳香硝基化合物与羰基化合物一锅法合成N-烷基芳胺,最高可得到单烷基芳胺的收率为93%。在该反应中B10H14分两次加入,首先添加30%将硝基还原为氨基,再加入20%进行还原胺基化反应。对含不同取代基的芳香硝基化合物进行N-烷基化反应,得到N-单烷基化产物的收率为84%~93%。此外,当向反应体系中添加37%的甲醛溶液时,则可以得到三级胺(图4)。不同取代基团的芳香硝基化合物依次与酮和甲醛反应,常温下得到三级芳胺的收率为72%~99%。

图4 以B10H14为还原剂制备N-烷基芳胺

图5 二硝基物的N-烷基化反应
Byun等[31]也以Pd/C为催化剂,在醇水溶剂中以甲酸铵作为原位氢供体,将芳香硝基化合物与醛反应合成N-单烷基取代芳胺。考察不同的溶剂对产物收率的影响。结果表明,在i-PrOH/H2O (10∶1,体积比)环境下得到N-单烷基芳胺的收率最高,且不生成N,N-二烷基取代产物。不同的脂肪醛与硝基苯反应,得到N-单烷基苯胺的收率为50%~98%,含不同取代基团的芳香硝基化合物与丁醛反应,都能顺利完成。其中当取代基团为供电子基团时,N-丁基芳胺的收率为88%~99%,而当取代基团为吸电子基团时,反应效果较差,N-丁基芳胺的收率为49%~78%。
Sydnes等[32]以10% Pd/C为催化剂,脂肪醛为烷基化试剂,H2为还原剂,一锅法合成N-单烷基芳胺。反应1 h得到的产物全是芳胺,延长反应时间,则得到N-单烷基芳胺。考察了醛的用量对产物的影响。结果表明,当醛的摩尔用量为反应物的1.0~1.7倍时,得到的都只是N-单烷基化产物。但对于甲醛而言,则必须控制用量,否则很容易得到二取代烷基胺。此外,通过改变反应条件,可以使芳香硝基物与甲醛的收率由61%提高到99%。
Dell’Anna等[33]以聚合物负载的Pd为催化剂,以H2为还原剂,硝基化合物与羰基化合物一锅法合成N-单烷基芳胺。考察不同芳香衍生物与苯甲醛反应情况。实验表明,对于含有供电子基团的物质,单烷基化收率在93%以上,而含有吸电子基团的收率稍低,为82%。当同时含有两个硝基时,得到70%的二取代烷基芳胺。不同的脂肪醛与硝基苯反应,得到N-单烷基苯胺的选择性为75%~85%。而对于芳香醛效果相对较差,但延长反应时间可以提高收率。
Sreedhar等[34]以阿拉伯树胶(GA)为稳定剂制备胶体Pd纳米颗粒催化剂,在1 atm H2、室温下将芳香硝基化合物与不同的醛反应合成N-烷基芳胺。结果表明,对于含有不同取代基团的芳香醛和脂肪醛与硝基苯的反应效果都很好,得到N-单烷基芳胺的收率为85%~96%。对于含有不同取代基团的芳香硝基化合物与苯甲醛反应,得到N-单烷基芳胺的收率为76%~92%。如果以酮作为烷基化试剂,则无催化活性。
Jin等[35]考察了芳环上含有两个硝基的化合物与丙酮在10% Pd/C催化剂作用下的反应(图5)。在该反应中,反应条件对产物的分布有很大的影响。以乙酸为溶剂,当乙酸的量为0~40 mL时,反应3 min后,4,6-二氨基-1,3-苯二酚(DAR)的收率从0增至93%。延长反应时间至90 min,则4,6-二(异丙基氨基)-1,3-苯二酚(BPAR)的收率从21%增至98%。此外,丙酮在该反应中起着重要的作用,当溶剂中丙酮与2-丙醇的体积比从0∶1变为1∶0时,对产物的选择性有很大的影响,BPAR的收率由0增至98%。此外,氢压对反应也有一定的影响。
Yamane等[36]以Au/Fe2O3为催化剂,在2 MPa H2、120 ℃下硝基苯与苯甲醛反应得到单烷基取代物。结果显示,当硝基物与醛的摩尔比为1∶1.5、反应6 h时,得到单烷基化产物收率为80%。当硝基物中含有供电子基团时,收率95%以上,而含有吸电子基团时,收率为71%。
3.2 以腈为烷基化试剂
Nacario等[37]以Pd/C为催化剂、腈为烷基化试剂、甲酸铵为氢源,在室温下将硝基化合物还原烷基化为相应的二级胺。在该反应中,乙腈用量较大,因为其既是反应物,又是溶剂。向反应体系中加入适量的甲醇,既能提高硝基物的溶解度,又能提高腈的溶解度。对于含有不同取代基团的芳香硝基化合物与脂肪腈反应,得到N-单烷基芳胺的收率为71%~100%。对于脂肪族硝基化合物,反应效果相对较差,容易生成N,N-二取代胺。
Reddy等[38]以Pd(OH)2/C为催化剂,聚甲基氢硅氧烷(PMHS)为还原剂,室温下芳香硝基化合物与腈反应合成N-单烷基芳胺。考察含不同取代基团的芳香硝基化合物与乙腈的反应,得到N-乙基芳胺的收率为63%~73%,但该催化剂不能重复使用。
Ikawa等[39]以Pd/C和Rh/C为催化剂,H2为还原剂,室温下芳香硝基化合物与乙腈反应合成N-烷基芳胺。结果表明,当溶剂中添加乙酸乙酯(AcOEt)时,AcOEt与Pd形成弱的相互作用,从而有效地抑制了二烷基取代,而向体系中添加适量的乙酸铵(AcONH4)则可以有效地提高催化活性。当取代基团中含有苯环时,由于空间效应,得到的产物大部分为芳胺。如果延长反应时间,生成二取代产物的量增加。同时考察了不同腈与硝基苯的反应情况。结果表明,直链和支链腈与硝基苯反应都得到N-单烷基苯胺,但对于有空间位阻的腈,反应效果较差,只能得到苯胺。
3.3 以醇为烷基化试剂
吴祖望等[40-41]采用Raney Ni为催化剂,将硝基物的还原反应和N-烷基化反应在同一个反应釜中进行,加氢反应温度为50~150 ℃,氢气压力为0.5~4.0 MPa,反应0.5~3 h,烷基化反应温度为50~250 ℃,压力为0.2~3.0 MPa,硝基物的转化率≥99%,胺基物的转化率≥90%,N-单烷基物的选择性≥85%。同时考察了取代基团的位置和性质以及醇的结构对产物的影响。结果表明,空间效应是影响N-烷基化反应以及各种副反应发生的关键因素。与大部分直链醇反应得到N-单烷基芳胺的产率都很高,但由于甲醇较难脱氢,导致反应效果差。含支链的醇由于空间反应效果也较差。
Feng等[42]以Ru为催化剂,芳香硝基化合物和芳醇反应制备N,N-二烷基苯胺。考察催化剂以及配体对反应的影响,结果表明,以Ru(CO)H2(PPh3)3为催化剂、N-杂环卡宾(NHC)为配体时,在150 ℃下反应16 h后得到二烷基化产物的收率最高,为96%。与脂肪醇反应,得到54%~68%的二烷基取代芳胺。但该反应体系对二元醇几乎无活性。Cui等[43]以Ru为催化剂,考察不同配体对N-烷基化反应的影响。研究表明,当不加任何配体时,得到的都是亚胺。而以[Ru(p-cymene)Cl2]2为催化剂,1,4-双(二苯膦基)丁烷(DPPB)为配体,在K2CO3存在下,N-烷基化的选择性达到97%。对不同的硝基物与醇反应,得到N-烷基胺的收率为73%~95%。Lee等[44]以Ru为催化剂,磷酸铵为配体,在适当的t-BuOK存在下,将芳香硝基化合物与芳醇于150℃反应24 h。结果表明,当在空气中反应时,生成一定量的亚胺中间体,而向反应中通入1 atm的H2时,则全部得到N-单烷基取代芳胺,但与仲醇的反应效果较差。
Peng等[45]以Au为催化剂,将硝基化合物与醇反应合成N-烷基胺。研究表明,采用不同的氧化物为载体,只有Fe2O3的效果最好,增加Au的量对反应的转化率影响不大,但是能够显著地提高单烷基化的选择性。有趣的是,可以通过改变反应条件选择性地得到单烷基化合物或二烷基化合物,且得到的产率都在80%以上。但该催化剂对直链醇无催化活性。
上述研究都是从芳香硝基化合物为初始原料,一锅法合成N-烷基胺。但还存在一些问题,如需要用到外加氢气,有些需要用到有机配体和碱,对环境造成一定的影响,产物需要分离,反应时间长,催化效率低。为了避免使用各种有机添加剂、碱以及氢气,许多研究者致力于醇/水体系重整制氢,提高催化效率,避免使用外加氢气。
作者课题组曾提出了原位液相催化加氢反应体系[46-50],即将含氧化合物的液相重整制氢所得的活化氢直接用于液相加氢反应,从而可以避免使用外加氢源,提高操作的安全性。沈颖旎等[51]以Pt/Al2O3为催化剂,在固定床反应器中,以醇/水重整制氢为氢源,将硝基苯还原制备苯胺与苯胺N-烷基化反应相耦合。考察水的含量以及原料浓度对反应的影响,结果表明,当醇水体积比为70∶30时,硝基苯的质量浓度为8%时,反应效果最好,得到N-乙基和N,N-二乙基苯胺的总收率达到99.5%。Li 等[52-53]以Raney-Ni为催化剂,甲醇与硝基苯合成N,N-二甲基苯胺,考察反应温度以及水在反应中作用。结果显示,反应温度越高,得到二烷基胺的收率也越大,443 K达到最大为94.4%。当添加适当的水后,苯环容易加氢成环己烷,导致烷基化产物的选择性降低。这主要是因为有水存在下,水与醇容易制氢使整个体系处于富氢状态,从而使苯环加氢。Xiang等[54]以Pd为催化剂,硝基苯与甲醇在固定床反应器中进行,重点探讨水在其中的作用。结果表明,在水存在下可以大大提高反应的转化率和选择性,且甲醇是最好的氢供体。此外,该反应中氢来自于甲醇和水重整,因而原子利用率大大提高。
上述研究中,以羰基化合物和腈为烷基化试剂的反应,大部分都需要使用还原剂,且需要严格控制羰基化合物的用量,反应时间长,催化效率低。以醇为烷基化试剂的反应中,在温和的反应条件下不需要添加任何配体、还原剂的反应体系是目前研究的热点。
4 展 望
N-烷基芳胺在染料、橡胶工业、制药、精细化工等很多领域有广泛的应用价值,随着应用领域的开拓和发展,其需求量逐年增加。以芳胺为初始原料合成工艺中,芳胺需要经过芳香硝基化合物还原制得,生产工艺复杂,整体收率低,生产成本高。而以芳香硝基化合物为原料一锅法合成N-烷基芳胺这一工艺具有反应过程及分离操作简便、能耗低、三废污染少等特点,具有良好的发展前景。在以芳香硝基化合物为原料一锅法合成N-烷基芳胺工艺中,可以在以下几个方面展开重点研究:①开发出能够在常温常压下,以醇为烷基化试剂,不添加任何助剂的廉价催化剂;②能够很好地控制烷基化产物的选择性,通过控制反应条件选择性得到相应的N-(单、双)烷基芳胺;③开发出既对脂肪族硝基化合物又对芳香族硝基化合物都有很好活性的催化剂。
[1] Kim J S,Shon O J,Rim J A,et al. Pyrene-armed calix azacrowns as new fluorescent ionophores:Molecular taekwondo process via fluorescence change[J]. J. Org. Chem.,2002,67:2348-2351.
[2] Sunwanprasop S,Nhujak T,Roengsumran S,et al. Petroleum marker dyes synthesized from cardanol and aniline derivatives[J]. Ind. Eng. Chem. Res.,2004,43:4973-4978.
[3] Hargis D C. Catalytic alkylation of aromatic amines with alkanols:US,4613 705[P]. 1986.
[4] 杨庆荣.苯胺的生产现状及市场分析[J]. 河南化工,2005,22:12-13.
[5] Narayanan S,Deshpande K. Aniline alkylation over solid acid catalysts[J]. Appl. Catal. A:Gen.,2000,199(1):1-31.
[6] Hamid M H S A,Slatford P A,Williams J M J. Borrowing hydrogen in the activation of alcohols[J]. Adv. Synth. Catal.,2007,349:1555-1557.
[7] 周小建,吴祖望. 芳胺N-单烷基化定向控制工艺进展[J]. 化工进展,1996,15(1):5-9.
[8] 师华,陆峰,熊家锦,等. 芳胺的N-烷基化反应[J]. 精细化工中间体,2008,38:8-11.
[9] Basu B,Paul S,Nanda A K. Highly selective N-alkylation of amines promoted on silica:An efficient and recyclable surface[J]. Green Chem.,2009,11:1115-1120.
[10] Gawande M B,Deshpande S S,Satam J R,et al. A novel N-alkylation of amines by alkyl halides on mixed oxides at room temperature[J]. Catal. Commun.,2007,8:576-582.
[11] Gomez S,Peters J A,Maschmeyer T. The reductive amination of aldehydes and ketones and the hydrogenation of nitriles:Mechanistic aspects and selectivity control[J]. Adv. Synth. Catal.,2002,10:344.
[12] Stoter R,Carrera D E,Ni Y,et al. Enantioselective organocatalytic reductive amination[J]. J. Am. Chem. Soc.,2006,128:84-86.
[13] Mizuta T,Sakaguchi S,Ishii Y. Catalytic reductive alkylation of secondary amine with aldehyde and silane by an iridium compound[J]. J. Org. Chem.,2005,70:2195-2199.
[14] Saidi O,Blacker A J,Farah M M,et al. Iridium-catalysed amine alkylation with alcohols in water[J]. Chem. Commun.,2010,46:1541-1543.
[15] Hamid M H S A,Williams J M J. Ruthenium catalysed N-alkylation of amines with alcohols[J]. Chem. Commun.,2007(7):725-727.
[16] Hamid M H S A,Allen C L,Lamb G W,et al. Ruthenium-catalyzed N-alkylation of amines and sulfonamides using borrowing hydrogen methodology[J]. J. Am. Chem. Soc.,2009,131:1766-1774.
[17] Kwon M S,Kim S,Park S,et al. One-pot synthesis of imines and secondary amines by Pd-catalyzed coupling of benzyl alcohols and primary amines[J]. J. Org. Chem.,2009,74:2877-2879.
[18] Martinez R,Ramon D J,Yus M. Selective N-monoalkylation of aromatic amines with benzylic alcohols by a hydrogen autotransfer process catalyzed by unmodified magnetite[J]. Org. Biomol. Chem.,2009,7:2176-2181.
[19] Likhar P R,Arundhathi R,Kantam M L,et al. Amination of alcohols catalyzed by copper-aluminium hydrotalcite:A green synthesis of amines[J]. Eur. J. Org. Chem.,2009,31:5383-5389.
[20] Zhang Y,Qi X J,Cui X J,et al. Palladium catalyzed N-alkylation of amines with alcohols[J]. Tetrahedron Lett.,2011,52:1334-1338.
[21] Fujita K,Li Z,Ozeki N,et al. N-alkylation of amines with alcohols catalyzed by Cp*Ir complex[J]. Tetrahedron Lett.,2003,44:2687-2690.
[22] Yadav G D,Doshi N S. Alkylation of aniline with methyl-tert-butyl ether (MTBE) and tert-butanol over solid acids:Product distribution and kinetics[J]. J. Mol. Catal. A:Chem.,2003,194:195-209.
[23] Nehate M,Bokade V V. Selective N-alkylation of aniline with methanol over a heteropolyacid on montmorillonite K10[J]. Appl. Clay Sci.,2009,44:255-258.
[24] Luque R,Campelo J M,Luna D,et al. Catalytic performance of Al-MCM-41 materials in the N-alkylation of aniline[J]. J. Mol. Catal. A:Chem.,2007,269:190-196.
[25] 郑海涛,陶克毅. 气相法合成N,N-二乙基苯胺[J]. 石油化工,2001,30:844-846.
[26] 臧雅茹,陶克毅,赵永记,等. 苯胺气相N-甲基化反应与动力学研究[J]. 石油化工,1991,20:671-676.
[27] 唐靖,陈骏如,李瑞祥,等. 芳胺常压气相N-烷基化反应研究[J].化学研究和应用,1996,8:402-407.
[28] Vijayaraj M,Gopinath C S. Selective mono-N-methylation of aniline substrates on Cu1-xZnxFe2O4[J]. Appl. Catal. A:Gen.,2007,320:64-68.
[29] Bae J W,Cho Y J,Lee S H,et al. A one-pot synthesis of N-alkylaminobenzenes from nitroaromatics:Reduction followed by reductive amination using B10H14[J]. Chem. Commun.,2000(19):1857-1858.
[30] Jung Y J,Bae J W,Park E S,et al. An efficient conversion of nitroaromatics and aromatic amines to tertiary amines in one-pot way[J]. Tetrahedron,2003,59:10331-10338.
[31] Byun E,Hong B,Castro K A,et al. One-pot reductive mono-N-alkylation of aniline and nitroarene derivatives using aldehydes[J]. J. Org. Chem.,2007,72:9815-9817.
[32] Sydnes M O,Isobe M. One-pot reductive monoalkylation of nitro aryls with hydrogen over Pd/C[J]. Tetrahedron Lett.,2008,49:1199-1202.
[33] Dell’Anna M M,Mastrorilli P,Rizzuti A,et al. One-pot synthesis of aniline derivatives from nitroarenes under mild conditions promoted by a recyclable polymer-supported palladium catalyst[J]. Appl. Catal. A:Gen.,2011,401:134-140.
[34] Sreedhar B,Reddy P S,Devi D K. Direct one-pot reductive amination of aldehydes with nitroarenes in a domino fashion:Catalysis by gum-acacia-stabilized palladium nanoparticles[J]. J. Org. Chem.,2009,74:8806-8809.
[35] Jin Z H,Li D,Ma R,et al. One-pot method to synthesize 4,6-bis(isopropylamino)-benzene-1,3-diol by catalytic reductive mono-N-alkylation of amine derivatives[J]. Chim. J. Catal.,2008,29:878-880.
[36] Yamane Y,Liu X,Hanasaki A,et al. One-pot synthesis of Indoles and aniline derivatives from nitroarenes under hydrogenation condition with supported gold nanoparticles[J]. Org. Lett.,2009,11:5162-5165.
[37] Nacario R,Kotakonda S,Fouchard D M D,et al. Reductive monoalkylation of aromatic and aliphatic nitro compounds and the corresponding amines with nitriles[J]. Org. Lett.,2005,7:471-474.
[38] Reddy C R,Vijeender K,Bhusan P B,et al. Reductive N-alkylation of aromatic amines and nitro compounds with nitrils using polymethylhydrosiloxane[J]. Tetrahedron Lett.,2007,48:2765-2768.
[39] Ikawa T,Fujita Y,Mizusaki T,et al. Selective N-alkylation of amines using nitriles under hydrogenation conditions:Facile synthesis of secondary and tertiary amines[J]. Org. Biomol. Chem.,2012,10:293-304.
[40] 吴祖望,周小建,林莉,等. 硝基物还原-烷基化制N-单烷基芳胺:中国,1127748A[P]. 1996-07-31.
[41] Zhou X J,Wu Z W,Lin L,et al. Studies on the selective synthesis of N-monoalkyl aromatic amines[J]. Dyes Pigments,1999,40:205-209.
[42] Feng C,Liu Y,Peng S M,et al. Ruthenium-catalyzed tertiary amine fornation from nitroarenes and alcohols[J]. Org. Lett.,2010,12:4888-4891.
[43] Cui X J,Zhang Y,Shi F,et al. Ruthenium-catalyzed nitro and nitrile compounds coupling with alcohols:Alternative route for N-substitued amine synthesis[J]. Chem. Eur. J.,2011,17:2587-2591.
[44] Lee C C,Liu S T. Preparation of secondary and tertiary amines from nitroarenes and alcohols[J]. Chem. Commun.,2011,47:6981-6983.
[45] Peng Q L,Zhang Y,Shi F,et al. Fe2O3-supported nano-gold catalyzed one-pot synthesis of N-alkylated anilines from nitroarenes and alcohols[J]. Chem. Commun.,2011,47:6476-6478.
[46] 严新焕,李小年,罗雄军,等. 一种苯胺的制备方法:中国,1660 771[P]. 2005-08-31.
[47] 严新焕,李小年,罗雄军,等. 一种邻氯苯胺的制备方法:中国,1 660 774[P]. 2005-08-31.
[48] 杨建峰,孙军庆,李小年,等. 利用乙醇重整制氢进行硝基苯原位液相加氢合成苯胺[J]. 催化学报,2006,27:559-561.
[49] 姜莉,祝一锋,项益智,等. 甲醇水相重整制氢原位还原苯乙酮制备α-苯乙醇[J]. 催化学报,2007,28:281-286.
[50] 李小年,项益智. 一类新的液相催化氢化反应体系[J]. 中国科学B辑,2007,37:136-142.
[51] 沈颖旎,罗智伟,严新焕. 原位液相催化加氢法合成N-乙基苯胺和N,N-二乙基苯胺[J]. 催化学报,2008,29:612-616.
[52] Xu L,Li X N,Zhu Y F,et al. One-pot synthesis of N,N-dimethylaniline from nitrobenzene and methanol[J]. New J. Chem.,2009,33:2051-2054.
[53] 李小年,张军华,项益智,等. 硝基苯和乙醇一锅法合成N-乙基苯胺[J]. 中国科学 B辑:化学,2008,38:27-34.
[54] Xiang Y Z,Li X N,Lu C S,et al. Water-improved heterogeneous transfer hydrogenation using methanol as hydrogen donor over Pd-based catalyst[J]. Appl. Catal. A:Gen.,2010,375:289-294.
Progress in the synthesis of N-alkyl anilines
YANG Fang,YAN Xinhuan
(State Key Laboratory Breeding Base of Green Chemistry Synthesis Technology,Zhejiang University of Technology,Hangzhou 310014,Zhejiang,China)
N-alkyl anilines are widely used as synthetic intermediates for pharmaceuticals,agrochemicals,fine chemicals,bioactive compounds,and dyes chemicals. The mechanism and the research process of N-alkylation of aromatic amines with corresponding alkylating agents,such as alkyl halides,carbonyl compounds and alcohols were summarized in this paper. The one-pot synthesis of N-alkyl anilines from nitroaromatics as starting material with carbonyl compounds,nitriles and alcohols was highlighted. Recently,much attention has been paid to the use of alcohols as alkylating reagents for the N-alkylation of nitroaromatics due to the mild reaction conditions,without additional organic ligand. Therefore,the development of efficient catalyst for N-alkylation system with alcohol is still a challenging goal.
anilines;nitroaromatics;N-alkyl anilines;N-alkylation
TQ 246.3
A
1000-6613(2012)06-1306-08
2011-12-19;修改稿日期:2012-01-29。
国家自然科学基金(21076197)及浙江省自然科学基金
(Y4090440)项目。
杨芳(1987—),女,硕士研究生。联系人:严新焕,教授,博士生导师,研究方向为催化加氢。E-mail xinhuanyan139@hotmail.com。
