EGCG经NF-кB途径抑制肝癌HepG2细胞增殖的研究
2012-10-17方志雄罗招阳
方志雄,程 丹,罗招阳
1.湖南湘潭市中心医院肝病科,湖南 湘潭 411100;2.湖北黄石市传染病院肝病科;3.南华大学医学院病理教研室
肝癌是我国常见的恶性肿瘤之一,其发病呈逐年上升趋势[1]。由于其早期症状不明显,大部分患者就诊时已为晚期,因此,化疗成为肝癌治疗的重要手段[2]。然而,许多患者因无法耐受化疗药物的毒副作用,致使临床疗效难尽人意[3]。因此,寻找有效、低毒的抗癌药物,成为肿瘤研究的热点之一。本文旨在初步探讨EGCG抑制肝癌HepG2细胞增殖的作用机制。
1 材料与方法
1.1 细胞 肝癌HepG2细胞购自中科院上海细胞库,用含10%小牛血清(杭州四季青公司产品)的RPMI 1640培养基置于37℃、5%CO2饱和湿度的培养箱中培养。
1.2 EGCG EGCG为美国Sigma公司产品(纯度﹥98%),将其溶于PBS溶液中,过滤除菌后于4℃保存备用。
1.3 绘制细胞生长曲线 取对数生长期HepG2细胞,按2×103个/孔接种于24孔板,加入 EGCG至50.0 mg·L-1(≈IC50值,PBS 为阴性对照组),每组设3个平行孔。每天取3孔计数细胞,每孔计数3次,计算细胞数的均值,连续6 d,绘制EGCG抑制HepG2细胞的生长曲线。
1.4 平板克隆形成实验 取对数生长期HepG2细胞,按500个/孔接种于6孔板中,加入EGCG至50.0 mg·L-1(≈IC50值,PBS为阴性对照组),每组设3个平行孔。培养2周后取出培养皿,甲醇固定后,0.4%结晶紫染色,计数细胞克隆数,按公式计算EGCG抑制HepG2细胞的抑制率IR:抑制率IR(%)=[1-(克隆数/接种细胞数)]×100%。
1.5 软琼脂集落实验 用含10%小牛血清的RPMI 1640培养基、0.6%琼脂糖配制底层琼脂,取2 mL铺于6孔板内,然后用HepG2细胞(密度为2×104个细胞/孔)、50.0 mg·L-1EGCG 培养液(≈IC50值)、0.3%琼脂糖配制顶层琼脂,每组设3个平行孔,37℃,5%CO2温箱内培养2周后,计数集落数和抑制率IR值:抑制率IR(%)=[1-(处理组集落均数/阴性对照组集落均数)]×100%。
1.6 Western blot检测蛋白表达 取对数生长期HepG2 细胞,加入 EGCG 至 50.0 mg·L-1(≈IC50值,PBS为阴性对照组)培养48 h,收集细胞,裂解,提取细胞总蛋白,测定蛋白浓度,以各泳道30 μg的总蛋白量进行10%SDS不连续聚丙烯酰胺凝胶电泳2 h,转膜、封闭,一抗(1∶1000)室温孵育滤膜1 h,PBS洗膜,HRP标记的二抗(1∶1000)室温孵育滤膜1 h,洗膜后进行ECL化学发光、X光片曝光并显影、定影,分析结果。
1.7 统计学处理 用SPSS 13.0统计软件处理所有的数据,数据用表示,所有的数据均采用χ2和T-test法进行分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 EGCG抑制HepG2细胞增殖的生长曲线 每天计数细胞数,观察EGCG抑制HepG2细胞增殖的情况。结果发现,与阴性对照组比较,EGCG处理HepG2细胞后,细胞生长减慢(n=3,P<0.05),说明 EGCG可有效抑制HepG2细胞的增殖,随着作用时间的延长,HepG2细胞增殖抑制作用更显著(见图1)。
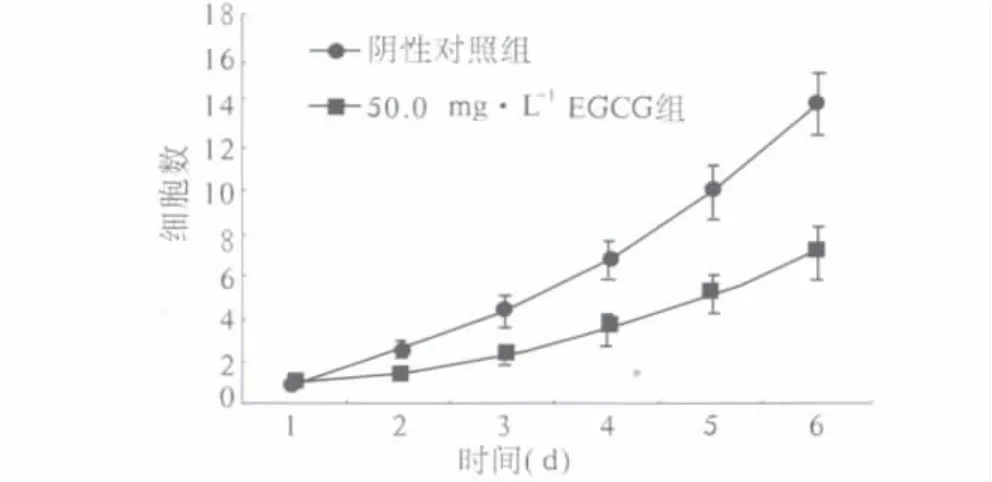
图1 EGCG抑制HepG2细胞增殖的生长曲线 (与对阴性照组比较,#P <0.05)Fig 1 Growth curve of EGCG inhibited the proliferation of HepG2 cells
2.2 EGCG对HepG2细胞平皿克隆形成的抑制作用 结果显示,与阴性对照组比较,EGCG处理组细胞克隆体积小,数目少,说明EGCG可有效抑制HepG2细胞的增殖(见图2、表1)。

表1 EGCG处理后HepG2细胞的平皿克隆数统计Tab 1 Clonal number of HepG2 cells dealt with EGCG
2.3 EGCG对HepG2细胞集落形成的抑制作用取对数生长期HepG2细胞,通过软琼脂集落形成实验观察EGCG处理HepG2细胞后的集落形成情况。结果显示,与阴性对照组比较,EGCG处理组的细胞集落体积小,数目少,说明EGCG对HepG2细胞集落形成具有抑制作用(见图3、表2)。


表2 EGCG处理后HepG2细胞的集落形成数统计()Tab 2 Statistics of EGCG inhibited cell colony forming number of HepG2 cell

表2 EGCG处理后HepG2细胞的集落形成数统计()Tab 2 Statistics of EGCG inhibited cell colony forming number of HepG2 cell
与阴性对照组比较,#P<0.05
分组 软琼脂集落形成数()抑制率(%)阴性对照组926 ±146 4.63 EGCG处理组 624±112#3.12
2.4 EGCG 处理后 HepG2细胞中 NF-кB P65蛋白的表达 结果显示,与阴性对照组比较,EGCG处理后NF-кB P65蛋白表达降低(见图4),提示EGCG可能通过抑制NF-кB P65蛋白表达而发挥抑制HepG2细胞的增殖。
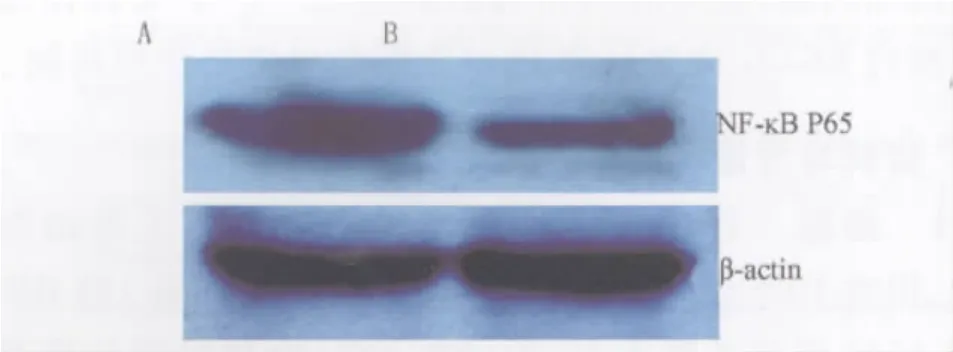
图4 Western blot检测EGCG处理后HepG2细胞中NF-кB P65蛋白的表达 A:阴性对照组;B:50.0 mg·L-1EGCG处理组Fig 4 Detection of the expression of NF-кB P65 protein in HepG2 cells inhibited by EGCG with Western blot A:negative control;B:50.0 mg·L-1EGCG group
3 讨论
众所周知,大多数天然植物具有低毒性的特点,从天然植物中分离和筛选抗肿瘤的有效成分,并探讨其抗肿瘤作用机制,为当前肿瘤药物学的研究热点之一。近年来,从不少天然植物中筛选的有效成分能有效抑制肿瘤细胞的增殖,这为临床防治肿瘤提供了新的思路,如从喜树中筛选的羟基喜树碱[4],三尖杉中分离的三尖杉酯碱[5]等能有效抑制多种肿瘤细胞的增殖。
茶作为广泛流行和人们喜好的三大饮料之一,可有效预防和治疗多种肿瘤。茶作为天然植物的抗肿瘤作用,是目前肿瘤防治领域中的热点之一,尤其是绿茶的研究最多。绿茶的多种成分具有多种生物活性和有效的抗肿瘤作用,其中表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate,EGCG]含量最高,生物活性最强,抗肿瘤作用也最明显[6-9]。我们首先通过MTT法检测了EGCG抑制HepG2细胞增殖的IC50值为50.24 mg·L-1(结果没有显示),在后续的实验研究中,选取50 mg·L-1EGCG作为近似的IC50值。
肿瘤细胞集落形成能力是肿瘤重要的恶性特征之一,其与肿瘤的发生、发展及转移能力密切相关,是体外筛选抗肿瘤药物的重要方法。我们通过细胞生长曲线、平皿克隆和软琼脂集落形成实验检测了EGCG抑制HepG2细胞的增殖作用,研究结果显示EGCG能有效抑制HepG2细胞的增殖,这与以往许多报道EGCG的抑瘤作用基本相似相似[7-9]。
核因子-κB(Nuclear factor-κB,NF-κB)是一个高度保守的重要转录因子家族,1986年由Sen和Bakimore首次报道,因参与B细胞κ轻链的表达调控而得名。NF-κB形成同源或异源性二聚体发挥转录功能,p65和p50是其最重要的两个亚基[10]。调控NF-κB激活的信号通路有两种:一种是IκB依赖性经典途径;另一种是非经典途径。在经典途径中,NF-κB抑制蛋白(inhibitor of NF-κB,IκB)在外源性刺激下被磷酸化和泛素化,从p50/p65异二聚体/IκBα复合物中解离下来,p50/p65异二聚体便通过核膜转位进入细胞核,与靶基因启动子区域的9~11个核苷酸构成的κB结合位点结合诱导靶基因的转录[11]。为进一步了解EGCG抑制HepG2细胞增殖的具体机制,采用Western blot检测了EGCG处理前后HepG2细胞中NF-кB P65蛋白的表达情况。结果显示,EGCG处理后HepG2细胞中NF-кB P65蛋白的表达降低。结合EGCG能有效抑制HepG2细胞的增殖作用,我们推测EGCG抑制NF-кB P65蛋白表达可能是其发挥抑制HepG2细胞增殖的机制之一,其中可能涉及NF-кB P65蛋白调控的复杂信号网路,仍有待我们进一步深入研究。
[1]Chen JG,Zhang SW.Liver cancer epidemic in China:past,present and future[J].Semin Cancer Biol,2011,21(1):59-69.
[2]Pan H,Fu X,Huang W.Molecular mechanism of liver cancer[J].Anticancer Agents Med Chem,2011,11(6):493-499.
[3]Fischer K,Gedroyc W,Jolesz FA.Focused ultrasound as a local therapy for liver cancer[J].Cancer J,2010,16(2):118-124.
[4]Tallman MN,Miles KK,Kessler FK,et al.The contribution of intestinal UDP-glucuronosyltransferases in modulating 7-ethyl-10-hydroxycamptothecin(SN-38)-induced gastrointestinal toxicity in rats[J].J Pharmacol Exp Ther,2007,320(1):29-37.
[5]Quintás-Cardama A,Cortes J.Homoharringtonine for the treatment of chronic myelogenous leukemia[J].Expert Opin Pharmacother,2008,9(6):1029-1037.
[6]Chen D,Wan SB,Yang H,et al.EGCG,green tea polyphenols and their synthetic analogs and prodrugs for human cancer prevention and treatment[J].Adv Clin Chem,2011,53:155-177.
[7]Tachibana H.Molecular basis for cancer chemoprevention by green tea polyphenol EGCG [J].Forum Nutr,2009,61:156-169.
[8]Patra SK,Rizzi F,Silva A,et al.Molecular targets of(-)-epigallocatechin-3-gallate(EGCG):specificity and interaction with membrane lipid rafts[J].J Physiol Pharmacol,2008,59 Suppl 9:217-235.
[9]Mandel SA,Amit T,Kalfon L,et al.Cell signaling pathways and iron chelation in the neurorestorative activity of green tea polyphenols:special reference to epigallocatechin gallate(EGCG)[J].J Alzheimers Dis,2008,15(2):211-222.
[10]Gupta SC,Kim JH,Kannappan R,et al.Role of nuclear factor κB-mediated inflammatory pathways in cancer-related symptoms and their regulation by nutritional agents[J].Exp Biol Med(Maywood),2011,236(6):658-671.
[11]Chen F,Castranova V.Nuclear factor-kappaB an unappreciated tumor suppressor[J].Cancer Res,2007,67(23):11093-11098.
