实验性肝硬化大鼠肝组织中CSE和Ki-67的表达及其意义
2012-10-17阎继攀齐翠花宋丽秀陈卫刚
阎继攀,郑 勇,刘 浩,李 睿,张 宁,齐翠花,宋丽秀,陈卫刚
1.石河子大学医学院,新疆 石河子 832000;2.石河子大学医学院第一附属医院消化内科
内源性硫化氢(H2S)是继NO和CO之后发现的可以导致血管舒张的第3种气体信号分子[1]。内源性H2S产生依靠的两个关键性酶是CBS和CSE,CBS和CSE在不同种属不同组织中的分布不同,据报道在哺乳动物的肝脏中以CBS为主[2],本课题组前期研究提示H2S/CSE体系对门静脉高压的形成起抑制作用[3],对肝硬化起保护作用。Ki-67抗原是一种很好的增殖标物[4]。本实验应用免疫组织化学方法分别检测实验性肝硬化大鼠CSE及Ki-67在肝脏细胞的表达,并用免疫荧光双染法在同一张病理切片上检测CSE和Ki-67的表达,并探讨其表达的意义。
1 资料与方法
1.1 实验对象和分组 雌性SD大鼠48只,均购自新疆维吾尔自治区医学实验动物研究中心,随机分为6组(每组8只):NF组(正常对照组)、SF组(正常H2S增加组)、PF组(正常H2S减少组)、HF组(肝硬化对照组)、SHF组(肝硬化H2S增加组),PHF组(肝硬化H2S减少组)。
1.2 主要试剂及仪器 实验所用CSE小鼠抗大鼠多克隆一抗购自abcam公司,Ki-67兔抗大鼠多克隆一抗购自北京博奥森生物有限公司,相关二抗及免疫荧光酶标记抗体购自北京中山生物公司。离子计(PXS-270)、敏感硫电极(Pag/S1)购自上海雷磁公司;紫外分光光度仪:SHIMAD ZU公司生产UV2401-PC型;恒冷切片机:德国HM560型。
1.3 方法
1.3.1 模型制备:根据本课题组以往的经验,采用四氯化碳(CCl4)复合因素法制备肝硬化门静脉高压大鼠模型。即肝硬化组大鼠(皮下注射40%CCl4;以棉子油稀释),0.3 mL/100 g质量 (首次剂量 mL/100 g),每隔4天1次,给予高脂高胆固醇饲料,即前2周饲以高脂饲料,第3周开始饲以高胆固醇饲料,同时给予15%乙醇作为饮用水;正常对照组只给予相同剂量的棉子油,采用标准饲养法,即饲以复合饲料,饮用自来水。肝硬化大鼠造模成功后H2S增加组分别给予H2S 供体硫氢化钠(NaHS)56 μmol·kg-1·d-1腹腔注射;H2S减少组给予同等剂量H2S代谢酶抑制剂炔丙基甘氨酸(PPG)30 mg·kg-1·d-1腹腔注射,其他组给予0.9%氯化钠注射液l mL腹腔注射。共注射7 d。
1.3.2 门静脉压力的测定及标本的留取:干预剂给予1周后测定各组实验大鼠门静脉压力及留取标本。门静脉导管法测量门静脉压力,应用10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉大鼠,固定在操作台上。在剑突下行腹部正中切口,将小肠左下拉下暴露门静脉主干,用5.5号头皮针进行门静脉穿刺固定,连接压力换能器,应用十二道生理记录仪测量门静脉压力(PVP)。PVP>12 mmHg为肝硬化造模成功。取门静脉血,低温高速离心机离心分离获得血浆,置于-80℃冰箱保存;取大鼠门静脉及部分肝组织于10%甲醛溶液中固定,送病理科作石腊包埋,超薄切片机切片,厚度为4 mm。其余肝组织置于-80℃冰箱保存。
1.3.3 标本留取及门静脉血浆硫化氢的测定:门静脉血浆中H2S含量测定采用敏感硫电极法。取新鲜血浆0.5 mL,加入等体积抗氧化液混匀后,采用PXS-270型离子计测定硫离子含量,根据S2标准曲线计算H2S的含量。
1.3.4 免疫组化方法:石蜡标本4 μm厚连续切片,免疫组化采用SP法,石蜡切片置0.01 mmol/L柠檬酸缓冲液微波修复抗原,DAB显色,苏木素复染,脱水、透明、封片、显微镜下观察。已知阳性片作阳性对照,PBS替代一抗作阴性对照。显微镜下观察。
1.3.5 免疫荧光方法:使用进口优化的切片连续切片厚度为8 μm。采用丙酮同定15 min,PBS冲洗3次,5 min/次;滴加1 mL山羊血清,常温放置20 min后;滴加一抗(Ki-67及CSE)4℃孵育过夜;次日PBS冲洗3次,5 min/次;滴加荧光二抗室温放置2 h,PBS冲洗3次,5 min/次,50%甘油封片。荧光显微镜观察结果。
1.3.6 CSE表达水平的评判方法:每张切片在高倍镜下随机选择5个视野,棕黄色为阳性,每个视野记数200个细胞,共计1000个细胞,计算阳性细胞数。切片的观察和计数均由资深病理科医生完成,以二者结果的均数为表达的阳性数。Ki-67细胞核呈棕色颗粒为阳性,先在低倍镜下观察Ki-67染色情况,寻找染色较密者,分布均匀区域,随机取5个高倍镜视野(10×40),计数500个细胞中Ki-67阳性细胞核数,平均每100个细胞中的阳性细胞核数为Ki-67标记指数,即:Ki-67 LI=[Ki-67(+)细胞核/500个细胞核]×100%。
1.4 统计学处理 实验数据均以均数±标准差表示,数据处理以SPSS 17.0统计软件完成。组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 实验大鼠的肝组织病理学观察 肉眼观,可见NF组大鼠肝组织表面光滑,质软,色泽暗红,边缘锐,体积形态正常;HF组肝组织体积缩小,体质量减轻,质地变硬,颜色变浅,边缘变钝,表面有大小不等的结节。显微镜下见:NF组大鼠肝细胞结构排列整齐;HF组大鼠见正常肝小叶结构破坏,纤维结缔组织增生,假小叶形成。
2.2 各组肝硬化大鼠门静脉压力 HF组、PHF组、SHF组的门静脉压力均高于NF组(P<0.01),与HF组相比,PHF、SHF门静脉压力均降低(P<0.01);表明给予抑制剂或H2S供体对正常对照组压力无显著影响,能使肝硬化大鼠门静脉压力降低(见表1)。
2.3 门静脉血浆H2S含量测定 HF组H2S含量明显低于NF组(P<0.01),在正常对照组或肝硬化模型组中,给予H2S供体均能使H2S含量升高(P<0.01),给予H2S供体使H2S含量进一步升高(P<0.01,见表1)。
2.4 免疫组化结果 免疫组化法CSE和Ki-67的表达:CSE定位在细胞浆,阳性细胞可见细胞核染色为棕褐色或棕黄色,与被苏木素衬染成蓝色的阴性胞核区别明显。Ki-67阳性细胞散在纤维间隔内或其周围,呈单个或散在不规则分布,阳性物质位于核内,呈棕黄色免疫组化染色结果(见图1、图2)。
表1 各组大鼠门静脉压力(PVP)及H2S含量变化()Tab 1 Changes of PVP and H2S in every group()
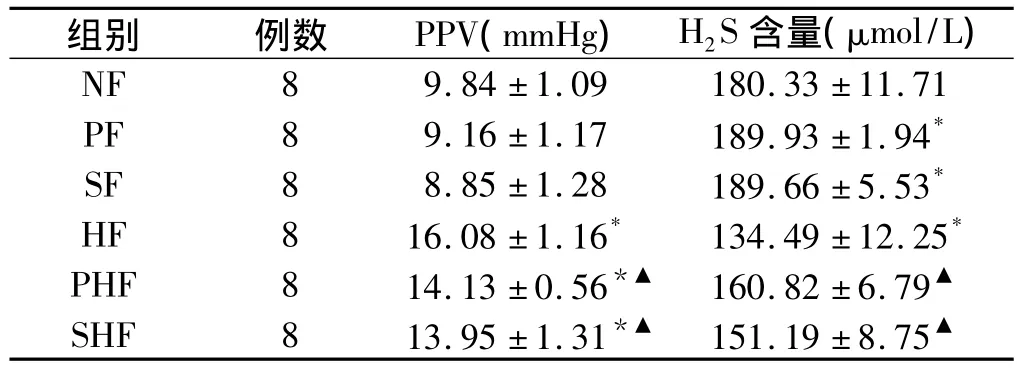
表1 各组大鼠门静脉压力(PVP)及H2S含量变化()Tab 1 Changes of PVP and H2S in every group()
注:与 NF组相比,*P <0.01;与 HF组相比,▲P<0.01
组别 例数 PPV(mmHg) H2S含量(μmol/L)NF 8 9.84 ±1.09 180.33 ±11.71 PF 8 9.16 ±1.17 189.93 ±1.94*SF 8 8.85 ±1.28 189.66 ±5.53*HF 8 16.08 ±1.16* 134.49 ±12.25*PHF 8 14.13 ±0.56*▲ 160.82 ±6.79▲SHF 8 13.95 ±1.31*▲ 151.19 ±8.75▲
HF组CSE表达明显低于NF组(P<0.01),PHF组硫化氢表达较SHF组均减少(P<0.01)。HF组Ki-67表达明显高于NF组(P<0.01),PHF组硫化氢表达较SHF组增加(P<0.01)。Ki-67表达在正常大鼠无明显作用(见表2)。
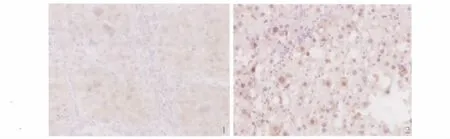
图1 PHF组肝组织CSE(DAB 200×);图2 SF组肝组织Ki-67(DAB 200×)Fig 1 CSE of liver tissue in PHF group(DAB 200×);Fig 2 Ki-67 of liver tissue in SF group(DAB 200×)
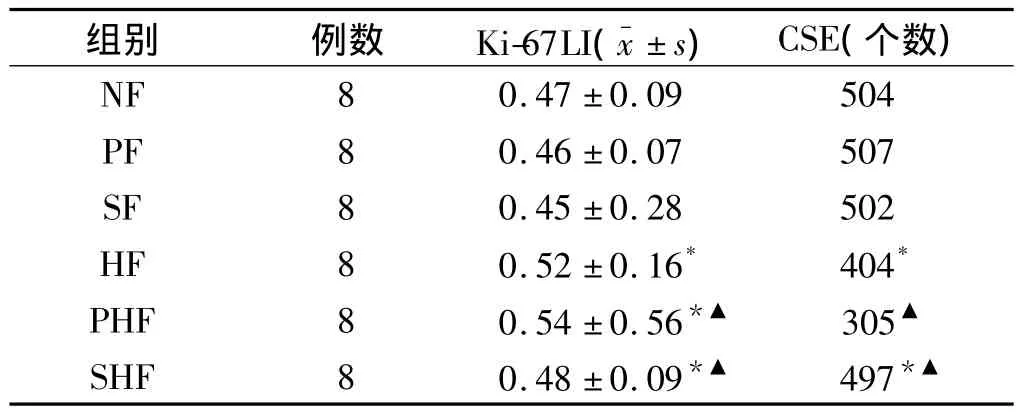
表2 各组大鼠CSE及Ki-67的表达Tab 2 Expression of CSE and Ki-67 in every group
2.5 免疫荧光 图3A为CSE单染图片,为绿色胞浆着色。图3B为Ki-67单染图片,为红色胞核着色,图3C为Ki-67和CSE双染结果。
3 讨论
H2S作为重要的新型气体信号分子参与调节平滑肌的舒张功能,已经证明了内源性H2S水平的降低在自发性高血压的形成、心血管系统功能与结构的调节上起了重要的作用[6];能降低肝硬化门静脉压力。
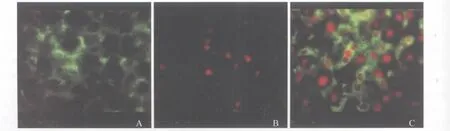
图3 SHF组免疫荧光(400×)A:CSE;B:Ki-67;C:CSE/Ki-67Fig 3 Immunofluorescence in SHF group(400×)A:CSE;B:Ki-67;C:CSE/Ki-67
Ki-67是一类新的与细胞周期相关的细胞核非组织蛋白[6-9],因此,Ki-67可作为标记细胞增殖状态的抗原,阳性说明细胞增殖活跃。本研究显示,在正常大鼠肝脏中CSE的表达与Ki-67的表达各组间无统计学差异。在肝硬化大鼠中CSE的表达与Ki-67的表达呈负相关,既增加硫化氢的供体,CSE的表达增加;Ki-67的表达减少;给予大鼠硫化氢抑制剂,CSE的表达减少;Ki-67的表达增加。CSE与Ki-67免疫荧光双染提示两个指标之间存在一定的关系,根据免疫组化和免疫荧光双染结果提示H2S能够抑制实验性肝硬化大鼠细胞的增殖。
肝硬化的机制非常复杂,肝细胞的炎症、坏死、免疫反应、肝星状细胞(hepatic stellate cell,HSC)的活化,脂质过氧化物的大量外溢,TGF-β、PDGF等多种细胞因子,均参与了这一过程[10-11]。Fiorucci等[12]近期又发现CSE在肝细胞和星状细胞内表达,而窦细胞则不表达,星状细胞活化时,CSE mRNA表达下调,CSE含量降低,H2S的合成减少,由于H2S能够抑制Ⅰ、Ⅲ型前胶原的合成,因此星状细胞H2S的减少对Ⅰ、Ⅲ型胶原的抑制也降低,这在肝硬化和门脉高压的形成中具有重要意义。肝星状细胞HSC的增生激活是肝纤维化发生的中心环节。由此,结合本次实验病理切片形态学观察我们推测H2S可能抑制肝星状细胞的增殖,从而对肝硬化起到一定的保护和修复受损肝脏的作用。
本课题组前期研究H2S能降低不同时期肝硬化门静脉压力[13]。H2S通过舒张血管平滑肌,降低体动脉压[14];有研究推测[15]H2S 可抑制平滑肌细胞增殖,可以在分子水平直接调节血管平滑肌张力,降低血压。本研究中,在免疫组化病理切片中我们可以发现在PHF组肝脏门静脉汇管区血管Ki-67表达增高;而SHF组肝脏门静脉汇管区血管Ki-67表达明显降低,由此我们推测H2S可以直接抑制肝脏门静脉的血管平滑肌细胞的增殖从而降低门静脉压力,对肝硬化起到保护性作用。
综上所述,本组资料提示H2S能够抑制实验性肝硬化大鼠肝脏组织内细胞的增殖。结合病理切片形态学观察我们推测,硫化氢抑制的大鼠增殖细胞可能是肝星状细胞和肝脏门静脉汇管区血管平滑肌细胞。但是证实是否是这两种细胞增殖及通过何种机制起到抑制增殖的作用,还需进行进一步研究证实。本实验表明在肝硬化中随着H2S的增加细胞增殖能力明显加强。说明H2S能够在一定范围内抑制肝细胞的增殖,减少肝细胞损伤,提高肝细胞的生存能力,对肝硬化具有一定的保护作用,也为H2S在临床上用于肝硬化的治疗提供了理论和实验依据,为继续研究其抗肝硬化作用打下了理论基础。
[1]Campillo B,Bories PN,Benvenuti C,et al.Serum and urinary nitrate levels in liver cirrhosis:endotoxemia,renal function and hyperdynamic circulation [J].J Hepatol,1996,25(5):707-714.
[2]Dorman DC,Moulin FJ,McManus BE,et al.Cytochrome oxidase inhibition with tissue sulfide concentrations in the rat brain,liver,lung,and nasal epithetlium[J].Toxicol Sci,2002,65(1):18-25.
[3]Chen WG,Zheng Y,Song LX,et al.Endogenous H2S to rat experimental cirrhosis portal hypertension influence[J].World Chin J Digestol,2011,19(5):467-471.陈卫刚,郑勇,宋丽秀,等.内源性H2S对大鼠实验性肝硬化门脉高压的影响[J].世界华人消化杂志,2011,19(5):467-471.
[4]Nolte M,Werner M,Nasarek A,et al.Expression of proliferation associated antigens and detection of numerical chromosome aberrations in primary human liver tumors:relevance to tumor characteristics and prognosis[J].J Clin Pathol,1998,51(1):47-51.
[5]Bauer I,Wanner GA,Rensing H,et al.Expression pattern of heme oxygenase isoenzymes 1 and 2 in normal and stress exposed rat liver[J].Hepatology,1998,27(3):829-838.
[6]Des J,Scwab U,Lemke H,et al.Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation[J].Int J Cancer,1983,31(1):13-20.
[7]Ter C,Duchrow M,Wohelenburg C,et al.The cell proliferation-associated antigen of antibody Ki-67:a very large,ubiquitous unclear protein with numerous repeated elements,representing a new kind of cell cycle-maintaining proteins[J].J Cell Biol,1993,123(6):513-522.
[8]Oretti G,Becker M,Key G,et al.Monoclonal antibodies against recombinant parts of the Ki-67 antigen(MIB1 and MIB3)detect proliferating cells in microwave-processed formalin-fixed paraffin sections[J].J Pathol,1992,168(4):357-363.
[9]L,Path MRC,Na JIA,et al.Ki-67 antigen expression in hepatocellular carcinoma using monoclonal antibody MIBI,a comparison with proliferating cell nuclear antigen[J].Am J Clin Pathol,1995,104(3):313-318.
[10]Rockey DC,Shah V.Nitric oxide biology and the liver:report of an AASLD researchworkshop[J].Hepatology,2004,39(1):250-257.
[11]Chi XJ,Hei ZQ,Pang HZ,et al.Portal vein and the inferior vena cava block and open the back door portal hypertension model dog lung tissue and lung disease characteristics of dynamic[J].Journal of Sun Yat-Sen University(Medical Sciences),2008,29(2):144-148.池信锦,黑子清,庞红字,等.门静脉和下腔静脉阻断与开放后门脉高压模型犬肺组织和肺动的病变特征[J].中山大学学报 (医学科学版),2008,29(2):144-148.
[12]Fiorucci S,Antonelli E,Mencarelli A,et al.The third gas:H2S regulates perfusion pressure in both the isolated and perfuse normal rat liver and in cirrhosis[J].Hepatology,2005,42(3):539-548.
[13]Zhang N,Zheng Y,Wang YL,et al.Endogenous hydrogen sulfide in different period the role of rat liver cirrhosis[J].World Chin J Digestol,2009,17(3):307-311.张宁,郑勇,王于理,等.内源性硫化氢在不同时期大鼠肝硬化中的作用[J].世界华人消化杂志,2009,17(3):307-311.
[14]Du JB,Chen XB,Geng B,et al.hybird summer-autumn cultivation bin,etc.Hydrogen sulphide as a cardiovascular signal molecules research[J].Journal of Peking University(Medical Sciences),2002,34(2):187.杜军保,陈晓波,耿彬,等.硫化氢作为心血管信号分子的研究[J].北京大学学报 (医学版),2002,34(2):187.
[15]Geng B,Yan H,Zhong GZ,et al.Hydrogen sulphide-cardiovascular function of the new gas signal molecular regulation[J].Journal of Peking University(Medical Sciences),2004,36(1):106.耿彬,闫辉,钟光珍,等.硫化氢-心血管功能调节的新型气体信号分子[J].北京大学学报(医学版),2004,36(1):106.
