不同转移潜能肝癌细胞株中CD标志物的表达差异及意义
2012-10-17夏羽佳田德安
夏羽佳,余 帆,晏 维,刘 梅,田德安
1.华中科技大学同济医学院附属同济医院消化内科,湖北 武汉 430030;2.华中科技大学同济医学院附属协和医院呼吸内科
原发性肝癌是世界上最常见的恶性肿瘤之一,其发病率位于全部恶性肿瘤的第五位,中国是世界上肝癌死亡率最高的国家,占世界肝癌总死亡人数的53%。肝癌患者的预后极差,术后的复发与转移是影响肝癌远期疗效的重要因素[1]。肿瘤干细胞学说认为肿瘤组织中并非所有肿瘤细胞都具有恶性特征,即存在极少量肿瘤细胞,具有自我更新和分化潜能,具有迁移、侵袭、成瘤特性,是肿瘤增殖生长、转移和复发的根源[2]。由于多数器官缺乏特异的表面标记,肿瘤干细胞研究的首要问题就是分离鉴定。
目前,已有CD分子标志物被确定为固体肿瘤干细胞的标记物。CD133是一种造血干细胞表面抗原,最近被确定为脑瘤、结肠癌等实体瘤潜在的肿瘤干细胞标记物[3-4]。CD90(Thy-1)是一种分子量为25~37 KDa的GPI锚定蛋白,其主要由白细胞表达,参与细胞间及细胞基质间的相互作用,它也在骨髓间充质干细胞及肝脏干细胞中表达[5]。CD44,也被称为归巢细胞黏附分子,是淋巴细胞、单核细胞和粒细胞表达的细胞表面糖蛋白,这已被确定为乳腺癌和头颈部癌的干细胞标记物[6-7]。CD24是一种单链唾液酸糖蛋白,分子量为42 KDa,而CD34是一种分子量约110 KDa的单核细胞表面抗原,其选择性地在人类造血祖细胞中表达[8]。本研究拟对不同转移潜能肝癌细胞株中CD133、CD90、CD44、CD34、CD24 这5 种 CD 标记物的表达情况进行分析。
1 材料与方法
1.1 材料 HepG2、MHCC-97H、SK-HEP-1细胞株由华中科技大学同济医学院附属同济医院肝病研究所保存。PE-CD133、FITC-90、APC-CD44、PE-CD24、PECD34流式抗体购自美国eBioscience公司,DMEM培养基及胎牛血清购自Gibco公司。FACS Aria流式细胞仪及分析软件为美国BD公司产品。
1.2 方法
1.2.1 细胞培养及样品制备:高、低转移肝癌细胞株SK-HEP-1、MHCC-97H、HepG2培养于含10%胎牛血清的高糖DMEM(购自美国Gibco公司)培养基中(培养基中含青霉素100 U/mL,链霉素100 μg/mL),置于37℃恒温,维持5%CO2饱和湿度培养箱内。细胞长至对数生长期时,PBS洗3次,胰酶+EDTA消化,细胞计数分别收集约1×106个细胞,用预冷的PBS洗3次,1000 r/min离心 10 min,弃上清。
1.2.2 流式抗体染色:在制备好的细胞样品内加入5 μL流式抗体及50 μL PBS缓冲液,混匀悬浮细胞,4℃避光孵育30 min,PBS洗涤3次,1000 r/min离心10 min,留沉淀弃上清,加入400 μL PBS缓冲液悬浮细胞,转移至流式管内用流式细胞仪分析。
1.3 统计学分析 应用SPSS 12.0统计软件进行统计学处理,数据以均数±标准差表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
细胞经流式抗体染色标记后分析CD标志物的表达情况,结果显示:① 在高转移潜能的MHCC-97H、SK-HEP-1细胞株及低转移潜能的HepG2细胞株中均无CD133+CD90+和 CD34的表达(见图 1、图 2);②CD133在低转移潜能的 HepG2细胞中阳性率仅0.1%,在高转移潜能的MHCC-97H和SK-HEP-1细胞中表达水平也较低,分别为0.4%和0.1%(见图1);③CD90在高低转移潜能的细胞株中表达有明显差异,在低转移潜能HepG2细胞中CD90的阳性率仅0.05%,而在高转移潜能的 MHCC-97H和SK-HEP-1细胞中其阳性率分别为0.2%和72.0%(P﹤0.05)(见图3);④ HepG2、MHCC-97H及SK-HEP-1细胞株中CD44阳性率逐渐增加,分别为0.1%、98.2%和99.7%,而 HepG2、MHCC-97H 及 SK-HEP-1细胞株中CD90+CD44+细胞比率分别为0.05%、0.2%和72.0%(见图3);⑤ 在低转移潜能细胞株HepG2中CD44+CD24+占0.05%,低于高转移潜能细胞株MHCC-97H中的10.3%和 SK-HEP-1细胞中的 0.3%(P <0.05)(见图4)。
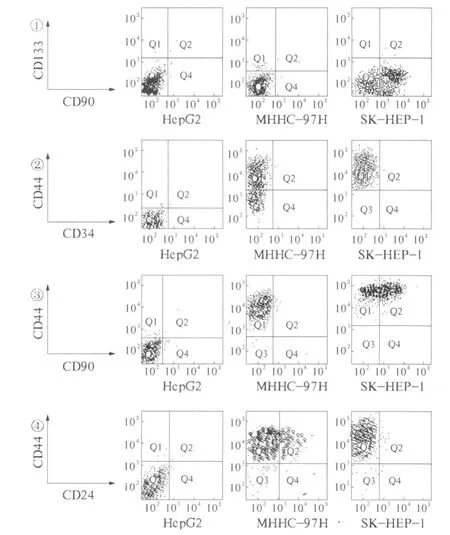
图1 流式细胞仪检测CD133、CD90在不同转移潜能的肝癌细胞株的表达;图2 流式细胞仪检测CD44、CD34在不同转移潜能的肝癌细胞株的表达;图3 流式细胞仪检测CD44、CD90在不同转移潜能的肝癌细胞株的表达;图4 流式细胞仪检测CD44、CD24在不同转移潜能的肝癌细胞株的表达Fig 1 Expression of CD133/CD90 in HCC cell lines detected by flow cytometry;Fig 2 Expression of CD44/CD34 in HCC cell lines detected by flow cytometry;Fig 3 Expression of CD44/CD90 in HCC cell lines detected by flow cytometry;Fig 4 Expression of CD44/CD24 in HCC cell lines detected by flow cytometry
3 讨论
肿瘤干细胞是一类特殊的干细胞,由于其具有自我更新和分化潜能,以及高致瘤性和耐药性的特点,被认为是肿瘤形成及不断生长的根源[2]。肿瘤干细胞通常以干细胞标记物为其特征,特异性分子标志物可用于肿瘤干细胞的鉴定和分选,是研究肿瘤干细胞必不可少的工具,但目前已确定的特异性标志物仍较少。
以往研究表明,CD133抗原是造血干细胞和神经元干细胞的标志,并发现CD133在人胎肝及肝组织的修复过程中有表达。本研究证实高转移潜能的MHCC-97H肝癌细胞中CD133的表达高于低转移潜能的HepG2细胞。Suetsugu等对CD133+肝癌细胞与CD133-细胞的体外增殖能力及成熟肝细胞标记(谷氨酰胺合成酶、细胞色素酶P450)表达情况进行了比较,结果发现CD133+肝癌细胞表现出很强的体外增殖能力并低表达成熟肝细胞标记物[9]。Yin等使用分离的CD133+SMMC-7721细胞株所进行的成瘤实验表明,CD133+细胞与CD133-细胞相比具有高致瘤性和高集落成瘤能力[10]。但是在人类多种肿瘤标本中均可分离出CD133+细胞,目前CD133被认为是脑肿瘤干细胞、直肠癌干细胞、结肠癌干细胞等通用的表型标志物[3-4],由于其并不具有组织特异性,因此,不是一个特异性较高的肝脏恶性肿瘤干细胞标志物。此外,CD34是一种与新生小血管相关的抗原,主要在血管源性肿瘤及多种肿瘤间质的小血管中表达[8],但因为本研究所使用的是肝癌细胞株,无新生小血管存在,所以在三种细胞株中均未见CD34阳性表达。
CD90是一种主要在白细胞中表达的糖蛋白,目前发现其在骨髓来源的间充质干细胞及肝脏干细胞上也有表达。CD44作为一种与肿瘤密切相关的跨膜糖蛋白,其过量表达与恶性肿瘤的发生发展、侵袭、转移密切相关[7]。我们的研究表明:CD90和CD44在不同转移潜能的肝癌细胞株中的表达有显著差异,随着转移潜能的增加,两者的表达呈递增趋势;CD90+CD44+细胞比率分别为 HepG20.05%、MHCC-97H 0.2%和SK-Hep-172.0%;并且CD44+CD24+在高转移潜能的MHCC-97H和SK-HEP-1肝癌细胞中表达也高于低转移潜能的HepG2细胞,这表明CD90+CD44+、CD44+CD24+的表达与肿瘤细胞的转移潜能有一定的相关性。新近研究发现来源于肝癌细胞株的CD90+细胞具有致瘤能力;来源于肝癌患者的所有肿瘤组织标本及91.6%的血液样本都具有CD45-CD90+细胞群,这群细胞能在免疫缺陷小鼠身上生成肿瘤结节。此外,CD90+CD44+细胞比CD90+CD44-细胞表现出更具侵袭性的表型,并且前者能在免疫缺陷小鼠的肺部形成侵袭性病灶。同时,CD44的敲除能阻止CD90+细胞形成局部或转移性肿瘤结节[11]。这提示CD90和CD44是潜在的原发性肝癌的干细胞标记物,其可提示肿瘤干细胞的存在。但CD90+CD44+细胞是否具有自我更新及分化潜能,CD24/CD90/CD44的联合标记是否有助于提高肝癌干细胞筛选的特异性,有待进一步研究证实。
[1]Farazi PA,DePinho RA.Hepatocellular carcinoma pathogenesis:from genes to environment[J].Nat Rev Cancer,2006,6(9):674-687.
[2]O’Brien CA,Pollett A,Gallinger S,et al.A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J].Nature,2007,445(7123):106-110.
[3]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432(7015):396-401.
[4]Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445(7123):111-115.
[5]La'zaro CA,Croager EJ,Mitchell C,et al.Establishment,characterization,and long-term maintenance of cultures of human fetal hepatocytes[J].Hepatology,2003,38(5):1095-1106.
[6]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci U S A,2003,100(7):3983-3988.
[7]Prince ME,Sivanandan R,Kaczorowski A,et al.Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma[J].Proc Natl Acad Sci U S A,2007,104(3):973-978.
[8]Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030-1037.
[9]Suetsugu A,Nagaki M,Aoki H,et al.Characterization of CD133+hepatocellular carcinoma cells as cancer stem/progenitor cells[J].Biochem Biophys Res Commun,2006,351(4):820-824.
[10]Yin S,Li J,Hu C,et al.CD133 positive hepatocellular carcinoma cells possess high capacity for tumorigenicity [J].Int J Cancer,2007,120(7):1444-1450.
[11]Yang ZF,Ho DW,Ng MN,et al.Significance of CD90+cancer stem cells in human liver cancer[J].Cancer Cell,2008,13(2):153-166.
