茉莉酸甲酯诱导柿树挥发物对红点唇瓢虫吸引力的持续效应
2012-09-28张艳峰薛皎亮谢映平
张艳峰, 薛皎亮, 巩 莎, 王 旭, 谢映平
(山西大学生命科学学院,太原 030006)
柿树(Diospyros kaki Linn.f.)是中国北方一种重要的经济果树,常年受到多种蚧虫的为害,尤以日本龟蜡蚧(Ceroplastes japonicus Green)为甚,果实减产常达70%[1]。日本龟蜡蚧能够分泌蜡质形成厚蜡壳覆盖在虫体背面,难以防治[1]。研究发现,当植食性昆虫侵害寄主植物时,能够诱导其改变挥发性气味,天敌昆虫可以利用这些气味作为定位害虫的化学信息[2-3]。近年来,茉莉酸(JA)和茉莉酸甲酯(MeJA)作为外源信号物质,也被用来诱导植物挥发物吸引害虫的捕食性和寄生性天敌[4-5]。
本文作者近年来的研究发现,日本龟蜡蚧的为害可以诱导柿树改变其挥发性组分。一年当中,在5月份雌成虫产卵期,其为害不足以诱导柿树对红点唇瓢虫具有吸引力;而7月份若虫为害诱导也不能显著提升柿树对红点唇瓢虫的吸引;只有9月份雌成虫严重为害时,受害枝叶才会对红点唇瓢虫具有招引效应[6]。这与程家安、王海波等人认为植物的诱导程度的“开关”式效应一致,即植物的虫害程度在一定范围内时,植物所表现的诱导抗性反应的强度变化不大,只有当这种虫害的程度超过了一定的范围时,这种抗性反应才能明显表现出来[7-8]。而在若虫为害期使用茉莉酸甲酯(MeJA)处理柿树后,其诱导挥发物对瓢虫具有引诱作用[9]。但不同剂量的MeJA诱导效应随时间变化的规律尚不清楚。因此本文选择日本龟蜡蚧的主要捕食性天敌-红点唇瓢虫(Chilocorus kuwanae Silvestri)为供试天敌,研究柿树用MeJA处理后对瓢虫吸引作用的持续性。以期掌握外源信号分子MeJA的持续作用时间和施用剂量,增强柿树诱导防御蚧虫的作用,开辟高效的蚧虫生物防治新途径。
1 材料和方法
1.1 试验地点
位于山西省临猗县的柿树林地,经度111°27′E,纬度35°40′N,海拔700m。选用两年生的柿树,高1.5m,冠幅1.0m,品种为‘橘蜜柿’。
1.2 供试瓢虫
红点唇瓢虫采自当地林地,采回后喂食新鲜的日本龟蜡蚧,暂时饲养在干净的玻璃管中。从中挑选雌虫在试验前禁食12h,用于嗅觉行为反应的测试。
1.3 MeJA的配制和施用
采用喷雾法,先将3个剂量(20、100μL和200μL)的 MeJA(95%,Sigma)溶于2mL的95%乙醇中,再加水稀释,配制成100mL浓度为0.05%、0.1%和0.25%的水溶液,然后喷施到样枝的树叶上。
不同剂量的MeJA处理对柿树挥发物成分变化的影响:在上午10:00用3种剂量的MeJA溶液各处理5株健康的柿树,每株样树选取一个样枝喷施100mL溶液。下午13:00即MeJA处理后3h收集挥发性气体。采气时间为1h。
MeJA处理后诱导柿树挥发物成分变化的持续效应:同上,在上午10:00用3个剂量的MeJA溶液处理柿树,处理后1、3、5d收集柿树挥发性气体。挥发物收集在下午13:00进行。采气历时1h。
1.4 嗅觉行为反应
本试验采用“Y”型嗅觉仪法(参照陈华才等[10]的方法并略有改进)。处理方法同1.3,嗅觉行为试验在13:00-14:00之间进行,在试验开始前采集新鲜叶片做味源。味源瓶中放入15g叶片,处理组为不同剂量MeJA处理的柿树枝叶,对照均为未处理的健康柿树枝叶。
试验装置由“Y”型嗅觉仪(直管20cm,两臂13cm,夹角60°,内径2.5cm)、蒸馏水瓶、活性炭过滤器、通气泵(QC-1型大气采样仪)连接而成。气流进入味源瓶前先经过活性炭过滤器和蒸馏水瓶,以净化空气和增加湿度,气体流量200mL/min。试验时,在“Y”型嗅觉仪上方20cm处安置一个30W日光灯以平衡照明,减少自然光的变化对趋性试验的影响。室内温度保持在25~28℃。
试验时先行通气10min。瓢虫由直管入口逐头引入,观察其在10min内对味源的行为反应。当瓢虫向某一味源方向爬行到达或超过某臂的1/3处,并持续1min以上或一直到达出口的,记作对该气味源有趋性反应。15头瓢虫为一组,设6组重复。每组测定完毕后,清洗整个装置,吹干,以消除味源残留,同时将嗅觉仪左右调换方位,以消除昆虫趋光性可能对试验结果的影响。每组重复都更换新的味源和瓢虫。
1.5 挥发性气体的收集与分析
1.5.1 挥发性气体的收集
根据上述试验安排,在晴朗、无风的天气进行,在试验林MeJA处理的样树上确定标准枝条,使用实时动态顶空收集法采集其挥发物。采样装置:由透明塑料袋(长120cm,宽80cm,此袋自身挥发物释放量很小,可忽略)、通气泵(QC-1型)、干燥塔(250mL)、采样管(15cm×5mm)、装活性炭的玻璃管(12cm×5mm),乳胶管(d=5mm)连接而成。采样时用塑料袋将标准样枝套住(不脱离树体),把装活性炭的玻璃管从接口处通入袋内扎紧;再经过干燥塔连接大气采样仪出气口;塑料袋底部开口插入采样管,扎紧后连接大气采样仪进气口,以形成循环。气体流量为100mL/min。
采样完毕,立即用锡纸把采样管两端口密封,带入实验室放在玻璃干燥塔内室温(25±2℃)保存,随后进行分析。
1.5.2 挥发性气体的组分分析
采用热脱附GC/MS(TCT-GC/MS)分析,采样管为Sigma采样管,内装吸附剂为Tenax-GR(60~80目)。仪器:TCT-GC/MS联用仪,TCT为Chrompack公司生产,型号为 CPG-4010PTI/TCT,系统压力20kPa;GC型号为CE Instrument公司生产的TraceTM2000GC,色谱柱:CP-Sil 8Low Bleed/MS柱(60m×0.32mm(id),0.5μm),MS型号为 Voy ager MS(Finnigan Thermo-Quest):EI源,70eV;接口温度250℃,源温200℃,灯丝发射电流150μA。GC/MS分析:进样口温度250℃,冷阱温度-120℃(3min),热脱附温度250℃(10min);冷阱进样时温度260℃。程序升温:40℃保持3min后,以6℃/min的速率升至270℃,保持3min;然后升温至280℃,保持5min;保留时间5~46min。对每一挥发物组分的质谱峰与标准化合物的质谱峰进行联机数据库(Nist Library)检索,对照确定相应的化合物名称、分子式、分子量和分子结构式;用挥发物各组分的GC峰面积与总峰面积的比值计算出各组分的相对含量。
1.6 数据分析
挥发物定量采用峰面积归一化法表示各成分的相对百分含量。采用卡方检验分析红点唇瓢虫对不同剂量MeJA处理的柿树挥发物的嗅觉行为反应。用SPSS V13.0对挥发物成分进行数据分析(One-Way ANOVA),并做Tukey检验。
2 结果与分析
2.1 不同剂量MeJA处理柿树后3~5d红点唇瓢虫的嗅觉行为反应
用20、100μL和200μL MeJA处理健康柿树,研究其在5d之内对瓢虫吸引力的持续效应(表1),结果如下:应用不同剂量的 MeJA处理柿树后,在3h到1d范围内都可以诱导其产生对瓢虫的吸引力。其中最大引诱效应出现在200μL MeJA处理后3h时,瓢虫的趋向率达到78.21%,与对照21.79%相比差异极显著(p<0.01)。而在 MeJA处理后3d和5d,结果显示柿叶对瓢虫的吸引力已经明显减弱,与对照相比差异不显著(p>0.05)。因此,应用 MeJA诱导柿树产生对红点唇瓢虫的吸引效应可持续一天左右,从第3天后吸引力显著下降。
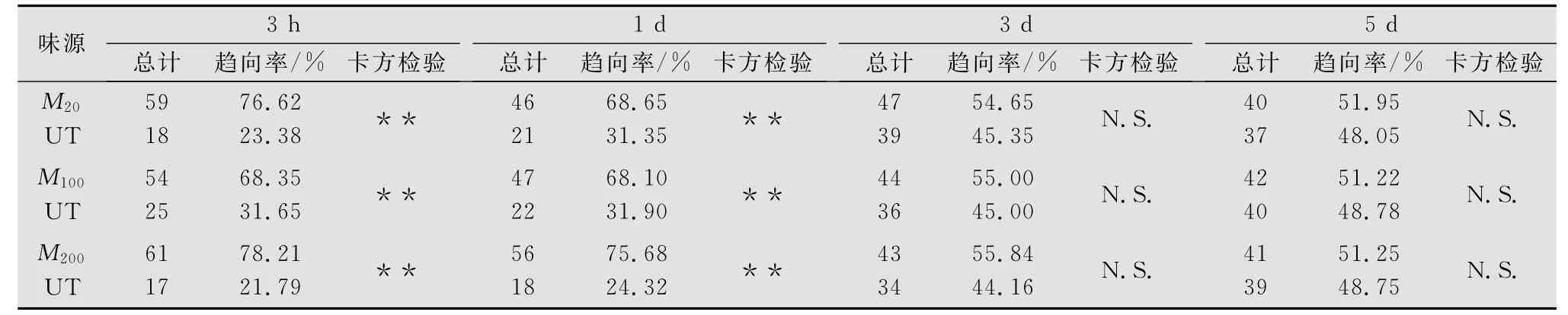
表1 红点唇瓢虫对3种剂量MeJA处理和未处理柿树的趋性反应比较1)
2.2 不同剂量MeJA诱导柿树挥发物成分的变化
对收集到的柿树挥发物进行GC/MS检测,共检出5类组分,分别是萜烯类、醇类、酯类、烷烃类、醛类化合物,由于对天敌昆虫起招引作用的主要是前3种,因此烷烃类、醛类化合物未在文中列出。从表2可知,与对照相比,使用MeJA处理柿树后挥发物成分有很大的不同,后者新增了5种萜烯类、1种醇类以及1种酯类化合物。而不同剂量MeJA处理的树体挥发物的成分存在着差别,随着MeJA用量的增加,能够诱导更多的具有吸引天敌昆虫作用的萜烯类物质产生。健康柿树挥发物中,只有顺-罗勒烯存在,占22.61%;比较MeJA处理组的挥发物组分中,α-蒎烯均为最多的萜烯类化合物,高剂量Me-JA处理后单一组分α-蒎烯含量可达到34.05%,同时挥发物中的萜烯类组分增加到6种共占49.27%。与对照组中2-乙基己醇不同,MeJA处理柿树后仅有一种醇类物质,即3-己烯醇,且只在100μL处理组中,仅占0.42%。酯类1种,仅存在于处理组中,且低剂量处理组中总含量最多,占11.13%。
与高含量的萜烯类挥发物相应的是,瓢虫的趋性反应结果也是对200μL MeJA处理的柿树趋向率最高(表1),与α-蒎烯的高含量相吻合。而瓢虫对100μL MeJA处理的柿树趋向率最低,其挥发物中萜烯类物质种类最少,含量也最低。
2.3 MeJA诱导柿树挥发物成分不同时间的变化
在MeJA处理后1、3d和5d,通过分析比较柿树挥发物的化学成分来研究其中主要起招引作用的萜烯类、醇类和酯类化合物的变化规律。从表3可知:3种剂量的MeJA处理柿树挥发物的持续变化相一致,即2种萜烯类,α-蒎烯和顺-罗勒烯以及1种酯类物质乙酸己烯酯差异显著,其余物质变化不明显。用MeJA处理后1d,α-蒎烯都是含量最多的萜烯类物质,到处理后3d和5d含量逐渐减少;与之形成鲜明对比的是,在处理后1d的柿树挥发物中仅有极少量的顺-罗勒烯存在,到了处理后3d,含量就达到25%以上,在处理后5d,增长进一步加剧,达到45%左右;与α-蒎烯变化规律一致的是乙酸己烯酯在处理后柿树的挥发物成分中随时间增加逐步递减。这2种化合物的变化与处理后柿树吸引力的变化呈正相关,在处理后1d的柿树挥发物中含量较高,对瓢虫有吸引效应,而在处理后3d和5d含量逐渐下降,柿树的招引效应也随之逐渐减弱。顺-罗勒烯的变化规律与之相反,在不具有招引效应的处理后3d和5d的挥发物中含量很高,由此可知其并不是对红点唇瓢虫具有吸引效应的萜烯类物质。
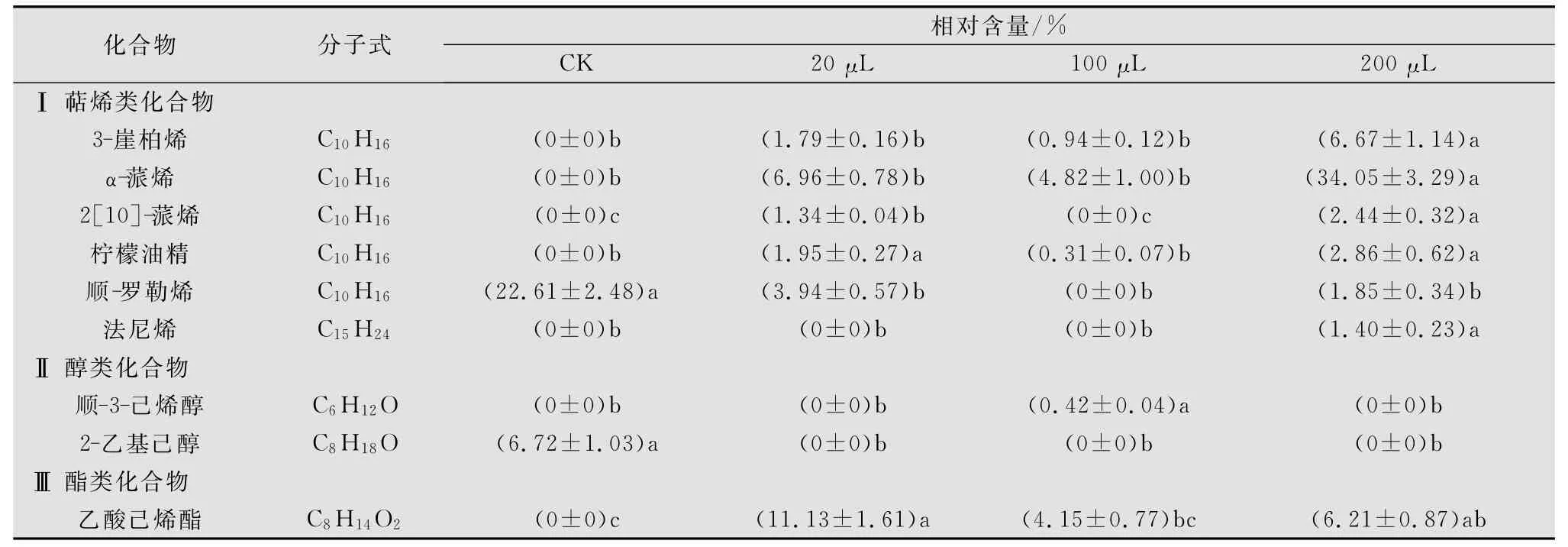
表2 不同剂量MeJA处理柿叶3h挥发物主要成分的相对含量1)
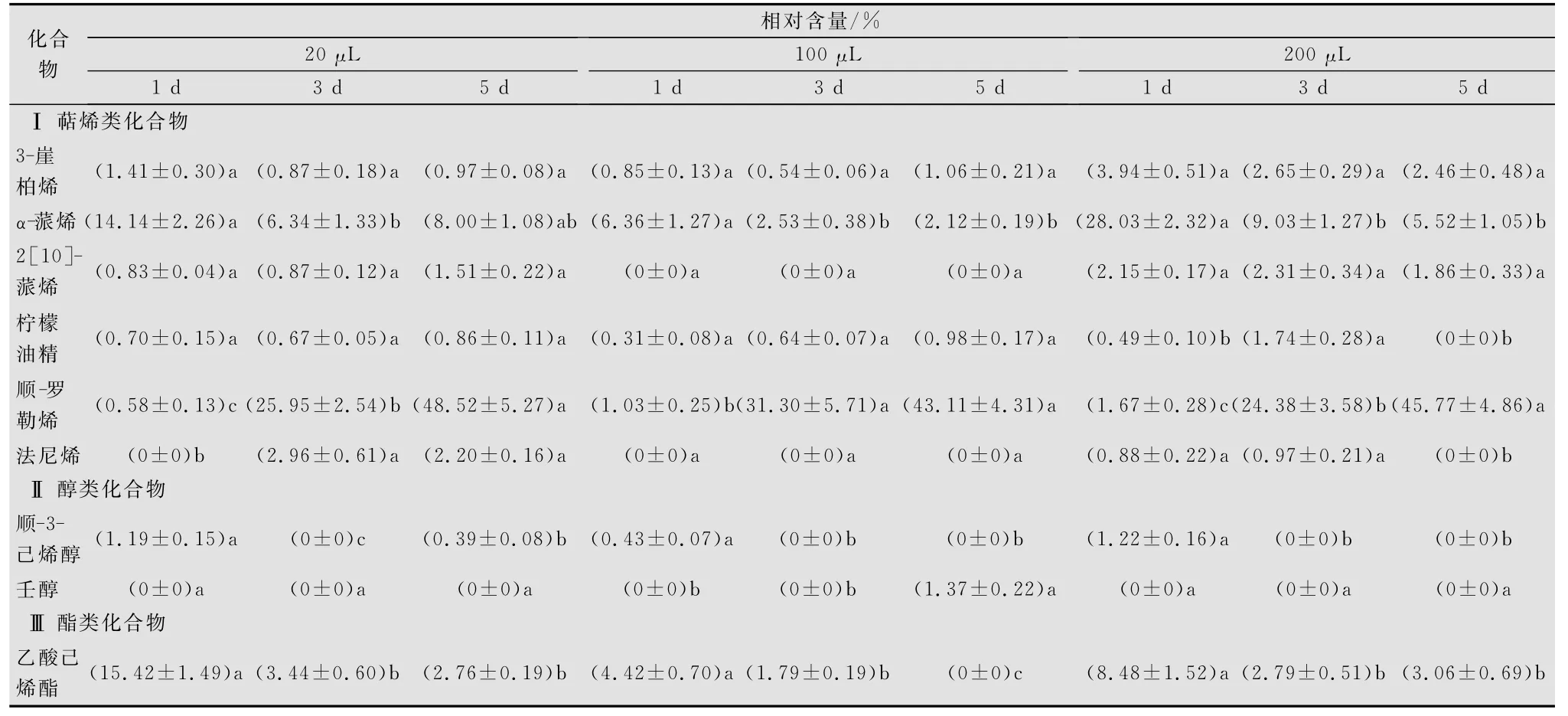
表3 三种剂量的MeJA处理柿叶1d,3d,5d挥发物主要成分的相对含量1)
3 结论与讨论
试验结果表明,柿树在受到外源信号物质Me-JA诱导后,挥发物种类和挥发量有所改变,从而改变了柿树挥发物的组成相,这是本次试验柿树挥发物组分中普遍具有的规律。柿树经诱导后促进了挥发物的释放,通过吸引天敌来保护自身,达到间接防御的目的。已有相关的研究报道了害虫的侵食和MeJA的应用能够诱导寄主植物释放出挥发性化学物质来吸引天敌昆虫控制害虫[11-14]。这些都进一步印证了植物-植食性昆虫-天敌三营养层次确实存在某种化学信息联系,充分体现了三者之间的协同进化。
在植物和昆虫的长期协同进化过程中,植食性昆虫对寄主植物的定位与识别包括一系列对来自寄主植物和非寄主植物刺激的行为反应[15],同样植物也可以产生复杂的化学反应来抵御植食性昆虫的危害,其主要方式是产生对昆虫有毒的次生代谢物质以及通过改变自身的挥发物来引诱植食性昆虫的天敌来捕食和寄生[14-16];天敌昆虫也能够利用植物和植食性昆虫所释放的信息化合物来寻找猎物[17]。目前认为对昆虫起定位作用的仅为一种或几种特异性的信息化合物。如Chenier等研究发现松树挥发物中的α-蒎烯对寄生针叶树的天牛科、象甲科、小蠹虫科、郭公甲科的昆虫具有引诱作用[18];顺-3-己烯醇是害虫取食后植物释放的一种常见物质,可以吸引捕食性天敌[19]。
本研究也证实了萜烯类、醇类、酯类化合物在MeJA诱导的柿树挥发物中含量增加,尤其是α-蒎烯的含量变化与瓢虫的趋性反应正相关,对红点唇瓢虫具有很强的吸引力。随着MeJA用量的增加,能够产生更多的α-蒎烯,对应于更多的瓢虫趋向于高剂量MeJA处理的柿树枝叶;在处理后随着时间的延长,其含量逐渐下降,相应的是对瓢虫的招引效应也随之减弱。利用α-蒎烯进行的单组分味源的趋性试验进一步验证了这种化合物在一定浓度下对瓢虫具有引诱效应[20]。
并不是所有的萜烯类、醇类物质对天敌昆虫都有引诱活性,本研究发现柿树挥发物中顺-罗勒烯的变化与对瓢虫的吸引效应呈负相关。柿树对瓢虫的吸引力随处理后时间的增加而减弱,顺-罗勒烯的含量却逐渐增加,尤其是处理后的5d其含量达到45%左右,此时的柿树对瓢虫不具备吸引力。与我们的结果不同的是,张凤娟等研究了3种槭树的挥发物成分中的罗勒烯对其蛀干害虫-光肩星天牛具有驱避效应[21]。
总而言之,MeJA是一个信号传导物质,能够诱导植物改变挥发物释放量和组分。因此在日本龟蜡蚧若虫为害期,林地里应用MeJA诱导柿树释放具有吸引力的挥发物招募瓢虫,这可为生物防治提供基础依据。但这些物质在3个营养层的作用是一个复杂的生物反应过程。目前的研究只是一个初步探索,因为挥发物的化学指纹图中各组分的特定比例对昆虫的定向和行为极为重要,昆虫利用植物挥发物寻找寄主和植物改变自身挥发物组成来引诱天敌的整个过程是较为复杂的,如何利用这些有效的信息化合物来实现害虫的可持续控制有待进一步的研究。
[1] 谢映平.山西林果蚧虫[M].北京:中国林业出版社,1998:22-38.
[2] Kessler A,Baldwin I T.Defensive function of herbivory-induced plant volatile emissions in nature[J].Science,2001,291:2141-2214.
[3] 谢映平,薛皎亮,唐晓燕.绵粉蚧危害的花椒树对异色瓢虫的招引作用[J].林业科学,2004,40(2):38-45.
[4] Thaler J S.Jasmonate-inducible plant defences cause increased parasitism of herbivores[J].Nature,1999,399:686-688.
[5] Dicke M,Gols R,Ludeking D,et al.Jasmonic acid and herbivory differentially induces carnivore-attracting plant volatiles in lima bean plants[J].Journal of Chemical Ecology,1999,25(8):1907-1922.
[6] Zhang Yanfeng,Xie Yingping,Xue Jiaoliang,et al.Response of a predatory insect,Chrysopa sinica,toward the volatiles of persimmon trees infested with the herbivore,Japanese wax scale[J/OL].International Journal of Ecology,Volume 2012,Article ID 653869,6pages.
[7] 程家安,唐振华.昆虫分子科学[M].北京:科学出版社,2001.
[8] 王海波,陶芸,金沙.蚕豆叶片几丁质酶活性的蚜虫诱导—植物生理应激反应的趋同性[J].应用生态学报,1994,5(1):68-71.
[9] Zhang Yanfeng,Xie Yingping,Xue Jiaoliang,et al.Attraction to the ladybeetle by the volatiles of persimmon trees induced with methyl jasmonate and Japanese wan scale attacking[J].Scientia Silvae Sinicae,2009,45:90-96.
[10] 陈华才,娄永根,程家安.二化螟绒茧蜂对二化螟及其寄主植物挥发物的趋性反应[J].昆虫学报,2002,45(5):617-622.
[11] Dick M,Baarlen P V,Wessels R,et al.Herbivory induces systemic production of plant volatiles that attract predators of the herbivore:extraction of endogenous elicitor[J].Journal of Chemical Ecology,1993,19:581-599.
[12] 苏建伟,高峰,刘玲,等.棉铃虫危害对转基因棉花挥发物成分和释放速率的影响[J].植物保护,2007,33(1):29-33.
[13] 吕要斌,刘树生.外源茉莉酸诱导植物反应对菜蛾绒茧蜂寄生选择行为的影响[J].昆虫学报,2004,47(2):206-212.
[14] 徐伟,严善春.茉莉酸在植物诱导防御中的作用[J].生态学报,2005,25(8):2074-2082.
[15] 康乐,Hopkins T L.黑蝗初孵蝗喃对植物气味和植物挥发性化合物的行为和嗅觉反应[J].科学通报,2004,49(1):81-85.
[16] 尹姣,陈巨莲,曹雅忠,等.茉莉酸诱导小麦抗病虫性初步研究[J].植物保护,2005,31(4):35-37.
[17] Turlings T C J,Tumlinson J H,Lewis W J.Exploitation of herbivore-induced plant odors by host seeking parasitic wasps[J].Science,1990,250:1251-1253.
[18] Chenier J V R,Philogene B J P.Field responses of certain forest Coleoplera to conifer monterpenes and athanol[J].Journal of Chemical Ecology,1989,15(6):1929-1945.
[19] Turlings T C J,Benrey B.Effect of plant metabolites on the behavior and development of parastic wasps[J].EcoScience,1998,5:321-333.
[20] Zhang Yanfeng,Xie Yingping,Xue Jiaoliang,et al.Effect of volatile emissions,especially a-pinene,from persimmon trees infested by japanese wax scales or treated with methyl jasmonate on recruitment of ladybeetle predators[J].Environmental Entomology,2009,38(5):1439-1445.
[21] 张风娟,金幼菊,陈华君,等.光肩星天牛对4种不同槭树科寄主植物的选择机制[J].生态学报,2006,26(3):870-877.
