转DsRed荧光蛋白的新月弯孢Curvularia lunata菌株构建
2012-09-28陈茂功韩志群林小虎王晓鸣周印富李洪杰
陈茂功, 韩志群, 林小虎, 王晓鸣*, 周印富*, 李洪杰
(1.河北科技师范学院生命科技学院,秦皇岛 066004;2.中国农业科学院作物科学研究所/农作物基因资源与基因改良国家重大科学工程,北京 100081)
在中国,玉米弯孢叶斑病是由新月弯孢[Curvularia lunata(Wakker)Boedijn]引起的一种叶部病害,目前几乎在各玉米种植地区都有发生,一度成为北方地区主要叶部病害之一,并在辽宁西部地区引起严重的生产损失[1]。目前对病菌的研究主要集中在致病性分化、变异与致病机制等方面[2],但对其在玉米叶片上的侵染及发育过程尚不十分清楚。
农杆菌介导的遗传转化(Agrobacteriumtume faciens-mediated transformation,ATMT)是近年来被广泛应用的一种真菌转化技术,其免除了聚二乙醇(polyethylene glycol,PEG)介导和限制性内切酶介导整合(restriction enzyme-mediated integration,REMI)等转化方法中原生质体制备的复杂过程,具有转化效率高、易获得稳定转化子和T-DNA在真菌基因组中以单拷贝插入为主等优点[3]。自1998年de Groot等首次将ATMT法应用于丝状真菌的遗传转化以来,已有大量的丝状真菌通过ATMT法成功实现了遗传转化[4]。目前,ATMT技术也被用于弯孢菌的遗传转化、基因定点突变和功能研究[5]。红色荧光蛋白(DsRed)来源于海葵体内的非常稳定的生物发光蛋白。DsRed和绿色荧光蛋白(GFP)具有相似的产生荧光机理,但DsRed的荧光信号能够在组织中更加充分地转换,其波长比GFP的长并具较高的噪音比,更易观察。DsRed作为新一代报告基因,已经被用于果蝇、细菌、真菌、黏菌的标记研究[6-15]。在我国,DsRed 基因也被用于鱼、酵母、病毒以及植物致病真菌等的研究中[16-20]。
本研究以hygB抗性基因为筛选标记,采用ATMT法将DsRed荧光蛋白基因整合入新月弯孢基因组中,实现新月弯孢的DsRed标记,并对TDNA插入突变体的主要表型特征进行鉴定,检测基因的插入位点,为进一步的新月弯孢研究进行技术准备。
1 材料和方法
1.1 供试菌株、质粒和植物材料
分离自玉米的新月弯孢(C.lunata)由中国农业科学院作物科学研究所保存;携带DsRed基因的质粒pCAMDsRed由 Marina Franceschetti(John Inner Center,UK)惠赠。DsRed基因受构巢曲霉3-磷酸甘油醛脱氢酶基因gpdA的启动子PgpdA调控,以潮霉素B抗性基因hyg作为选择标记基因[21];高感弯孢叶斑病的玉米自交系‘黄早四’用于病菌致病力检测。
1.2 农杆菌介导的遗传转化
通过对含潮霉素B浓度为0、30、50、75、100μg/mL和150μg/mL的PDA平板上新月弯孢生长状况的检测,确定野生型C.lunata对潮霉素B的耐受浓度为50μg/mL。
参照Mullins等的方法[22],进行农杆菌介导下DsRed基因导入C.lunata的操作。获得转化子菌落后,挑取阳性转化子至含抗生素(头孢霉素200μg/mL和潮霉素B 50μg/mL)的PDA平板上,待菌株长满全皿且产孢后,用无菌水洗下孢子,并稀释至1.0×102个/mL,取100μL孢子悬浮液均匀涂布到含潮霉素B 50μg/mL的PDA平板上,25℃培养2d后挑取单菌落,获得单孢纯化菌株。
1.3 转化子荧光观察及标记检测
在荧光显微镜(Olympus BX41,日本)下观察转化子的红色荧光表达。检测DsRed基因和hyg基因整合结果时,采用CTAB法提取菌株DNA,以DsRed 基因引物(DsRed-F:5′-ACTCCTCCGAGGACGTCATCAA-3′;DsRed-R:5′-ACGTAGTGTAGTAGCCGGGCAGCT-3′)和潮霉素B抗性hyg基 因 引 物 (Hyg-8F:5′-GCAGACAGGAACGAGGACAT-3′; Hyg-8R: 5′-GCTCCATACAAGCCAACCAC-3′)进行扩增,产物以0.8%琼脂糖凝胶电泳鉴定。潮霉素B抗性基因的Southern blotting分析根据试剂盒操作说明进行。
1.4 转化子致病性相关性状测定
将转化子和野生型菌株用直径4mm的打孔器打菌饼接于PDA平板上,25℃恒温黑暗培养5d,测定菌丝生长速率;产孢量测定参照贺春萍等人的方法[23]。将转化子及野生型菌株接种液体培养基(参照 Marcus等配制[24])中,25℃恒温培养15d,每天120r/min振荡1h。将培养液经双层纱布过滤,过滤液转入离心管,在4℃,10 000r/min高速离心,上清液即为酶提取液。纤维素酶系中的内切β-1,4-葡聚糖酶(Cx酶)活性测定参照 Lee等方法[25];果胶酶中的聚甲基半乳糖醛酸酶(polymethylgalacturonase,PMG)活性测定参照 Murata等方法[26];粗毒素的提取参照唐树戈等方法[27],毒素生物测定所用离体叶片针刺法参照康绍兰等[28],毒素致病性分析设3次重复,测定独立进行2次。
1.5 转化子的致病性测定
在自交系‘黄早四’4叶期时,采用毛笔涂抹法接种叶片,转化子接种悬浮液中分生孢子浓度为1.0×106个/mL,接种后黑暗保湿36h,然后放置温室(25℃)中正常管理。分别以无病菌接种液和野生型孢子接种液为阴性对照和阳性对照。接种5d后观察叶片发病率并计算病情指数,方法参照李金堂等[29]。玉米植株、营养土及所用仪器用完后进行灭菌处理。
1.6 转化子的初步应用
将Cl-DsRed 4转化子转接至含有50μg/mL潮霉素B的PDA平板,25℃培养7d,用无菌水洗下孢子镜检并将菌液稀释至1.0×106个/mL,取400μL置于凹形载玻片的凹槽中,25℃黑暗保湿培养12h后在荧光显微镜下观察孢子萌发的形态;将该孢子悬浮液接种‘黄早四’的叶片,黑暗保湿36h后放置温室正常管理,4d后取叶片病斑处观察菌丝侵染情况。
1.7 DsRed基因插入位点侧翼序列分析
突变体T-DNA插入位点侧翼序列的扩增采用TAIL-PCR,参照 Liu等[30]和徐荣旗等[31]的方法进行。胶回收PCR扩增产物,连接到pGM-T载体中转入大肠杆菌感受态,筛选阳性克隆子进行测序。引物合成(表1)和测序工作由上海生工生物工程有限公司完成。

表1 hiTAIL-PCR扩增T-DNA插入位点侧翼序列引物列表1)
2 结果与分析
2.1 新月弯孢的遗传转化与荧光表达特点
采用农杆菌介导法将DsRed基因整合至新月弯孢基因组中,获得红色荧光蛋白基因标记的菌株Cl-DsRed 1、Cl-DsRed 2、Cl-DsRed 3和 Cl-DsRed 4。利用DsRed和hyg基因特异性引物从4个转化子基因组DNA中均扩增获得579bp和800bp目的片段,质粒pCAMDsRed中也能扩增出相同片段,而野生型菌株中无扩增(图1a,b),表明DsRed基因已转入新月弯孢基因组中。Southern blotting检测发现,4个转化子分别出现位置不同的单一条带,表明转化子为T-DNA单拷贝插入,插入位点不同,无明显的位点插入偏好(图1c)。
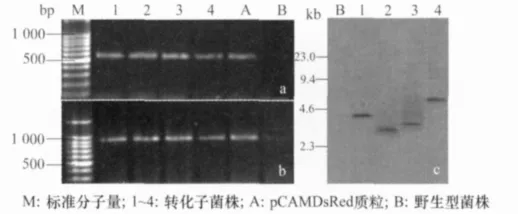
图1 转化子中DsRed基因(a)和hyg基因(b)的PCR检测与Southern杂交分析(c)
虽然转化子外观形态与野生型相同,但在荧光显微镜紫外光激发下,转化子菌丝、分生孢子梗和分生孢子能发出明亮的红色荧光(图2a,b),而野生型无荧光表达(图2c,d)。DsRed基因只在转化子分生孢子原生质中表达而在孢子壁和隔膜中无表达(图2e),分生孢子成熟后由于孢子壁加厚导致荧光减弱。对4个转化子在普通PDA培养基上继代培养5代后,重新转接至含潮霉素B的培养基上,转化子仍能够正常生长,PCR检测能够扩增出目的片段,表明DsRed基因在转化子中稳定遗传。
2.2 转化子致病相关性状的改变
差异显著性分析表明,转化子Cl-DsRed 2的生长速度极显著低于野生型菌株,其他转化子无显著差异;转化子Cl-DsRed 3产孢量极显著减少,Cl-DsRed 1的产孢量也受到一定程度的影响。各转化子Cx酶均略有下降,但差异不显著。而菌株间PMG 酶活性差异明显,转化子 Cl-DsRed 1、Cl-DsRed 2和Cl-DsRed 4的活性显著高于野生型菌株,而Cl-DsRed 3则表现为下降。转化子Cl-DsRed 3粗毒素的致病力极显著下降,其他转化子粗毒素的致病力也受到一定影响(表2)。

图2 转化子Cl-DsRed 4菌株的荧光表达

表2 转化子致病相关性状的比较分析1)
2.3 转化子对玉米的致病性
Cl-DsRed 1、Cl-DsRed 2和Cl-DsRed 4与野生型菌株一样,在感病自交系‘黄早四’的叶片上表现出较强的毒性和侵袭力,在接种后3d即可产生典型病斑;Cl-DsRed 3在接种5d后才出现典型病斑且病斑面积小,表明其侵袭力和致病力有所减弱。
2.4 转化子的初步应用
新月弯孢为半知菌亚门丝孢纲丝孢目暗色丝孢科弯孢属的真菌,分生孢子具3个隔横4细胞,中隔常位于中央偏下处,从茎部数第3个细胞膨大;在黑暗培养12h后,孢子萌发率达到95%以上,一般从两端颜色较淡的细胞长出芽管,少许孢子单端萌发;接种Cl-DsRed 4后5d,自交系‘黄早四’叶片上形成梭形褪绿透明的病斑(图2f)。在荧光显微镜下,能够看到红色荧光蛋白在病菌侵染玉米叶片菌丝中的表达(图2g)。
2.5 DsRed基因转化子插入位点分析
在7个简并引物中,AD5最适合弯孢菌的TAIL-PCR扩增,4个转化子中有3个获得特异性条带,致病力表现下降的Cl-DsRed 3未获得侧翼序列,其他简并引物未产生特异性扩增。将所获得的序列提交NCBI后采用blastn比对,未发现高度同源的基因序列。初步比对结果(表3)表明,在Cl-DsRed 1转化子中,DsRed蛋白编码基因插入在一个未知功能的假定蛋白(939bp)中,但有效比对区域仅为216bp,插入位点为该假定蛋白基因的575和576位碱基之间。Cl-DsRed 2转化子的DsRed蛋白编码基因插入在ATP核糖磷酸转移酶编码基因(1 252bp)中,有效比对区域为473~583bp大小,插入位点为该基因的227和228位碱基之间。Cl-DsRed 2转化子在菌丝生长速度和PMG酶活性方面表现出与野生型菌株的极显著差异,可能与ATP核糖磷酸转移酶活性受到干扰有关。Cl-DsRed 4转化子的侧翼序列未发现有登录的相似基因序列。

表3 侧翼序列基因的比对
3 讨论
作为生物学研究工具,DsRed已对许多真菌成功实现了标记,但对玉米弯孢叶斑病菌的遗传标记国内外尚未见报道。本研究采用根癌农杆菌介导的转化系统,将红色荧光蛋白标记基因插入新月弯孢基因组DNA中,获得了DsRed基因稳定遗传的转化子,为该病菌在寄主植物中的侵染循环和致病机制研究提供了重要的材料。
对转化子表型测定发现,转化子与野生型相比,在一些性状方面出现改变,可能是外源DNA片段的随机插入位点影响了相关基因的表达,产生的突变体可用以研究弯孢菌生长发育相关基因和致病基因。在获得的4个转化子中,Cl-DsRed 4与野生型在致病性和其他性状方面相近,适用于弯孢菌与玉米互作的研究。但由于玉米叶片自身红色荧光较强,直接在叶表观察弯孢菌丝的扩展、入侵等特征较为困难,只有在叶片横切面才能有效观察到发荧光菌丝。因此需要其他技术手段消除叶片自身荧光而不影响病菌荧光的观察,以便能够检测到弯孢菌对玉米叶片的完整侵染循环过程。
hiTAIL-PCR技术可以通过对插入位点侧翼序列的分析确定基因插入的位置,从而分析该基因功能与表型突变之间的关系[31]。本试验还对其他20个突变体的插入位点侧翼序列进行了扩增,获得了其中13个序列,从本文的侧翼序列比对结果中发现,具有相似性的登录基因序列均来自与新月弯孢相近分类学地位的子囊菌格孢腔菌科(Pleosporace-ae)真菌:偃麦草核腔菌[Pyrenophora tritici-repentis(Died.)Drechsler]、圆核腔菌(Pyrenophora teres f.teres)、颖枯暗球腔菌(Phaeosphaeria nodorum)(无性态:斑污小球腔菌Leptosphaeria maculans),表明格孢腔菌科真菌在基因组成方面具有相似性。
[1] 王晓鸣,石洁,晋齐鸣,等.玉米病虫害田间手册-病虫害鉴别与抗性鉴定[M].北京:中国农业科学技术出版,2010.
[2] Liu T,Liu L X,Hou J M,et al.Expression of green fluorescent protein in Curvularia lunata causing maize leaf spot[J].Canadian Journal of Plant Pathology,2010,32(2):225-228.
[3] Degefu Y,Hanif M.Agrobacterium tumefaciens-mediated transformation of Helminthos poriumturcicum,the maize leaf-blight fungus[J].Archives of Microbiology,2003,180:279-284.
[4] Mullins E D,Chen P X,Romaine P,et al.Agrobacterium transformation of Fusarium oxysporum:an efficient tool for insertional mutagenesis and gene transfer[J].Phytopathology,2001,58:2043-2052.
[5] Liu T,Liu L X,Jiang X,et al.Agrobacterium-mediated transformation as a useful tool for the molecular genetics study of the phytopathogen Curvularia lunata[J].European Journal of Plant Pathology,2010,126:363-371.
[6] Verkhusha V V,Otsuna H,Awasaki T,et al.An enhanced mutant of red fluorescent protein DsRed for double labeling and developmental timer of neural fiber bundle formation[J].The Journal of Biological Chemistry,2001,276:29621-29624.
[7] Nancharaiah Y V,Wattiau P,Wuertz S,et al.Dual labeling of Pseudomonas putida with fluorescent proteins for in situ monitoring of conjugal transfer of the TOL plasmid[J].Applied and Environmental Microbiology,2003,69(8):4846-4852.
[8] Mikkelsen L,Sarrocco S,Lübeck M,et al.Expression of the red fluorescent protein DsRed-Express in filamentous ascomycete fungi[J].FEMS Microbiology Letters,2003,223(1):135-139.
[9] Eckert M,Maguire K,Urban M,et al.Agrobacterium tumefaciens-mediated transformation of Leptosphaeriaspp.and Oculimaculaspp.with the reef coral gene DsRedand the jellyfish gene gfp[J].FEMS Microbiology Letters,2005,252:67-74.
[10] Fischera M,Haasea I,Wiesnerb S,et al.Visualizing cytoskeleton dynamics in mammalian cells using a humanized variant of monomeric red fluorescent protein[J].FEBS Letters,2006,580:2495-2502.
[11] Janus D,Hoff B,Hofmann E,et al.An efficient fungal RNA-silencing system using the DsRed reporter gene[J].Applied and Environmental Microbiology,2007,73(3):962-970.
[12] Elleuche S,Pöggeler S.Visualization of peroxisomes via SKL-tagged DsRed protein in Sordaria macrospora[J].Fungal Genetics Reports,2008,55:9-12.
[13] Helber N,Requena N.Expression of the fluorescence markers DsRed and GFP fused to a nuclear localization signal in the arbuscular mycorrhizal fungus Glomus intraradices[J].New Phytologist,2008,177(2):537-548.
[14] Nizam S,Singh K,Verma P K.Expression of the fluorescent proteins DsRed and EGFP to visualize early events of colonization of the chickpea blight fungus Ascochyta rabiei[J].Current Genetics,2010,56(4):391-399.
[15] Monteiro R A,Schmidt M A,de Baura V A,et al.Early colonization pattern of maize roots by Herbaspirillum seropedicae[J].Genetics and Molecular Biology,2008,31:932-937.
[16] 姜鹏,陈敏,白俊杰,等.外源性红色荧光蛋白基因(RFP)在转基因唐鱼中的整合分析[J].农业生物技术学报,2010,18(5):968-974.
[17] 杨坤宇,刘如石,林鉴,等.红色荧光蛋白在毕赤酵母中的高效表达[J].厦门大学学报(自然科学版),2005,44(3):410-415.
[18] 罗园媛,李慧娟,李东野,等.红色荧光蛋白标记蛋白激酶B的慢病毒构建和表达[J].中华实验外科杂志,2011,28(5):765-767.
[19] 杨峰,施李鸣,范素华,等.板栗疫病菌绿色荧光与红色荧光蛋白共定位载体的构建[J].基因组学与应用生物学,2011,30(3):308-315.
[20] 吴磊,王晓鸣,徐荣旗,等.利用红色荧光蛋白标记的轮枝镰孢研究病原菌对与玉米根系的系统侵染和定殖[J].作物学报,2011,37(5):793-802.
[21] Eckert M,Maguire K,Urban M,et al.Agrobacterium tumefaciens-mediated transformation of the Leptosphaeriaspp.and Oculimaculaspp.with the reef coral gene DsRedand the jellyfish gene gfp[J].FEMS Microbiology Letters,2005,252:67-74.
[22] Mullins E D,Chen X,Romaine P,et al.Agrobacterium-mediated transformation of Fusarium oxysporum:an efficient tool for insertional mutagenesis and gene transfer[J].Phytopathology,2000,91:173-180.
[23] 贺春萍,邱世文.稻瘟菌T-DNA插入突变体的培养基筛选试验[J].热带农业科学,2005,25(6):24-27.
[24] Marcus L,Schejter A.Single step chromatographic purification and characterization of the endopolygalacturonases and pectinesterases of the fungus,Botrytis cinerea Pers.[J].Physiological Plant Pathology,1983,23(1):1-13.
[25] Lee B H,Blackburn T H.Cellulase production by a thermophilic Clostridiumspecies[J].Applied and Environmental Microbiology,1975,30(3):346-353.
[26] Murata H,Chatterjee A,Liu Y,et al.Regulation of the production of extra cellular pectinase,cellulose,and protease in the soft rot bacterium Erwinia carotovora subsp.carotovora[J].Applied and Environmental Microbiology,1994,60(9):3150-3159.
[27] 唐树戈,郑其格,牟林,等.玉米弯孢叶斑病菌粗毒素的制备[J].西北农业学报,2010,19(1):57-59.
[28] 康绍兰,张浩,黄悟芳.诱发玉米抗小斑病突变体的研究Ⅲ:影响玉米小斑病菌致病毒素作用的因素和生物测定[J].河北农业大学学报,1986,9(3):7-16.
[29] 李金堂,傅俊范.玉米弯孢菌叶斑病发病率与严重度的关系[J].植物保护学报,2009,36(6):569-570.
[30] Liu Y G,Chen Y.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].Biotechniques,2007,43:649-656.
[31] 徐荣旗,汪佳妮,陈捷胤,等.棉花黄萎病菌T-DNA插入突变体表型特征和侧翼序列分析[J].中国农业科学,2010,43(3):489-496.
