非整比磷酸铁锂LixM0.01FePO4的合成与电化学性能研究
2012-09-25王石泉王升富冯传启
李 华,汤 晶,王石泉,王升富, 冯传启
(湖北大学化学化工学院,湖北武汉430062)
锂离子电池相比于一般电池,具有比能量高、循环寿命长、自放电率低、无记忆效应等优点,因而广泛运用于各种便携式电子产品和通讯工具中,并逐步被发展成电动车的动力电源。而锂离子电池的关键部分之一是正极材料,正极材料一般采用的是含锂的化合物,像LiCoO2、LiNiO2、LiMn2O4等,其中LiCoO2已实现了商品化,LiNiO2制备较困难,LiMn2O4正极材料高温循环性能差,两者有待改进,而作为新型锂离子电池正极材料的正交晶系橄榄石型LiFePO4兼有上述各种材料的优点。
自从1997年Goodenough研究小组首次合成LiFePO4,并把它作为锂离子电池的正极材料后,由于它有很高的理论比容量(170 mAh/g),同时与LiCoO2、LiMn2O4等其它正极材料相比,具有结构稳定,工作电位适中(3.45 Vvs.Li/Li+),价格低廉、对环境友好等优点,更是引起了人们的极大关注。但是,LiFePO4材料也存在一些缺点,如电导率低、锂离子扩散速率小、充放电的电流密度小的问题。因此,如何去提高LiFePO4的导电性能和锂离子扩散速率成为现今实现LiFePO4的商品化而亟需解决的问题。目前对该材料的改性研究也主要集中在两个方面:一是进行碳的分散与包覆;二是金属离子的掺杂改性[1]。
此外,合成方法和合成原料对材料的性能也有影响,如溶胶凝胶法和成的材料,其性能比固相法合成的好些;对于合成LiFePO4的铁源不同,性能有差异,文献报道有A.Yamada以Fe(CH3COO)2为铁源在400~800℃之间进行煅烧制备LiFePO4[2];Yang S等以FeSO4为铁源利用水热法合成了LiFe-PO4[3];Pier Paolo Prosini等以 Fe(NH4)2(SO4)2·6 H2O 的水溶液为原料利用共沉淀法合成LiFePO4[4];李于华等以FeC2O4·2 H2O为铁源利用微波法制备了锂离子电池正极材料磷酸亚铁锂[5];F.Croce等人以Fe(NO3)3为铁源采用溶胶-凝胶法制备 LiFePO4[6];J.Baker等人以 Fe2O3、LiH2PO4、碳黑为原料,采用碳热还原法制备了LiFePO4[7],以上不同铁源合成的材料,在性能上有不同程度上的差异。本文将报道采用廉价的FePO4为原料通过流变相法制备出掺杂改性的非整比化合物LixM0.01Fe-PO4正极材料,并对其电化学性质进行研究,为开发该正极材料在动力锂离子电池中的应用提供实验基础和理论依据。
1 实验
1.1 LixM0.01FePO4(M=Y、Mo)的流变相法合成
按Li∶Fe∶Y=1∶1∶0.01的化学计量比分别称取一定量的 LiAc·2 H2O(A.R.)、FePO4·4 H2O(A.R.)、Y2O3(A.R.),混合均匀后,再加入少量的PEG(分子量为3400),室温下充分研磨均匀,再加入无水乙醇调成流变态,于100℃下烘干后,再将其在管式炉中在通Ar气的条件下700℃加热12 h,得到黑色的粉末LixY0.01FePO4,记为A。把原料中的Y2O3换成(NH4)6-Mo7O24·4 H2O(A.R.)后,以相同的化学计量比 Li∶Fe∶Mo=1∶1∶0.01称取原料,用同样的合成方法再合成LixMo0.01FePO4,记为B。
1.2 LixM0.01FePO4样品的表征
用Rigaku D/max-ra X射线衍射仪对样品进行结构分析,工作参数:真空度0.0707 MPa,以Cu靶的Kα为辐射源(λ=0.15406 nm),在衍射束侧放置单色器。采用步进扫描,扫描速度为2(°)/min,管流50 mA,管压40 kV,扫描范围为10°~50°。用扫描电子显微镜观察样品的粒径及形貌(SEM,JEOL JSM 6460A)。采用上海辰华CHI660电化学工作站对样品为正极材料组装的扣式电池进行交流阻抗测量。
将LixM0.01FePO4样品、乙炔黑、聚四氟乙烯(PVDF)按75∶20∶5的质量比混合,加入异丙醇溶剂,在玛瑙研钵进行研细,调和均匀,得到粘状混合物,然后在压膜机上压成膜,将压好的电极膜在真空干燥箱中125℃,干燥24 h,取出后,切割成面积约为1 cm2的正极膜,压在镍网上,作电池的正极。然后在充满氩气的手套箱中装配扣式电池 (CR 2016),电解液为1 mol/L LiPF6/EC+DEC(体积比为1∶1),隔膜为Celgard 2400微孔聚丙烯膜,负极为金属锂片。然后在电压范围为2.5~4.2 V,以不同的电流密度条件下,在新崴(Neware)电池综合测试系统上进行充、放电测试实验。
2 结果与讨论
2.1 对LixM0.01FePO4(M=Y、Mo)的结构分析

将流变相方法制备得到的LixY0.01FePO4和LixMo0.01FePO4分别进行X射线粉末衍射测试,得到的XRD图如图1所示,LixY0.01FePO4和LixMo0.01FePO4的XRD图谱中,在15°~45°范围,衍射峰位均能很好的与标准图谱(JCPDS卡40-1499)相吻合,峰形尖锐,结晶性能良好,也没有发现类似Fe3P[8]等杂峰。由XRD数据计算得到的晶胞参数分别为:LixY0.01FePO4(a=6.0041,b=10.326,c=4.6906);LixMo0.01FePO4(a=6.0016,b=10.3214,c=4.6899),与 LiFePO4的晶胞参数(a=6.019,b=10.347,c=4.704)相比,掺杂Y和Mo后的晶胞参数和晶胞体积都有所缩小,这可能与Y-O键和Mo-O键的键能较大有关,说明非整比掺杂离子进入了晶格,掺杂的Y和Mo既可能占据LiFePO4中的M1(Li)的位置,也可能占据M2(Fe)的位置[9],根据Chang提出的离子掺杂机理[10],Li+和Fe2+的离子半径分别为 0.068、0.074 nm;Y3+和 Mo6+的离子半径为 0.088、0.062 nm,根据离子半径相近进行取代的原则:推测Y3+优先占据M2的位置,即替代Fe的位置;将部分M2的位置的Fe2+驱赶到M1的位置,即替代Li的位置,而部分被铁取代的锂离子则在灼烧中损失。而Mo6+优先占据M1的位置,即锂的位置,部分被Mo6+占据的M1位置的锂离子在灼烧中损失,两者情况都形成非整比化合物,而且非等价离子的取代都可造成LiFe-PO4晶格中的Fe和Li位上的离子缺位,从而有利于Li+在固相中的扩散。同时XRD图谱中次强峰的强度I111与主强峰强度I131的比值 (I111/I131)也发生了变化,其中LixY0.01FePO4中I111/I131=0.9039,LixMo0.01FePO4中 I111/I131=0.8997,与 LiFePO4中I111/I131=0.8553相比,都有所增大。经过人们研究发现[9],LiFe-PO4的电化学性能与XRD图谱中I111/I131的值相关,该值越大,电化学性能越好。经过Y和Mo掺杂后的LiFePO4,I111/I131值的增大均伴随电化学性能的提高,其中Y3+掺杂后的非整比化合物LixY0.01FePO4的I111/I131值最大,其电化学性能也最优,这在后面的电化学性能研究中得到了证实。
图2为样品的SEM图,我们看到样品由小颗粒团聚而成,小颗粒为球形且大小均一,它们的平均粒径为0.5~1 μm,这说明PEG在这里不仅作为还原剂和碳源,还起到控制LiFe-PO4的颗粒生长的作用。而且LixY0.01FePO4的平均颗粒要稍小一些。
2.2 电化学性能

图3为LixY0.01FePO4和LixMo0.01FePO4在0.05C下的首次充放电曲线及循环曲线。从图中我们可以看到:在0.05C(1C相当于170 mAh/g)倍率下,LixY0.01FePO4的首次充、放电的比容量分别为136、135 mAh/g,而LixMo0.01FePO4的首次充放电的比容量则分别为131、130 mAh/g。LixY0.01FePO4的充、放电比容量明显地要比LixMo0.01FePO4的高,这可能与锂离子的扩散情况和晶体颗粒粒径的大小和材料的电导率有关。粒径越小,锂离子在脱出和嵌入过程中,经过的路程越短,越有利于锂离子的扩散,则实际比容量就越大[11]。 这从SEM图可以看出,LixY0.01FePO4的颗粒要比LixMo0.01FePO4小一些。另外,随着电流密度的增大,LixY0.01FePO4和LixMo0.01FePO4的首次放电容量都有所下降。这是因为LiFePO4的充放电反应是在LiFePO4和FePO4两相之间进行,是一个两相过程,而Li+在LiFePO4/Fe-PO4界面间的扩散是正极材料脱、嵌锂离子反应的控制步骤[12]。当进行大电流放电时,通过此界面的锂离子不足以维持电流,导致了大电流时电极极化现象加剧,使容量损失。根据Andersson等的理论,Li+在正极材料中嵌入和脱嵌时,对于粒径较大的颗粒,锂离子扩散的路程就更长,会在颗粒的中心附近产生难以利用的区域,因而降低了活性物质的利用率,最终导致了放电比容量的衰减[13]。
实验发现,当充放电倍率提高到0.5C,经过100次循环后,LixY0.01FePO4的放电比容量由108 mAh/g降到104 mAh/g,比容量衰减率为3.7%,而LixMo0.01FePO4的放电比容量由106 mAh/g降到101 mAh/g,比容量衰减率为4.7%。在充放电的过程中,随着循环次数的逐渐增多,放电容量虽然有所衰减,但衰减的速度也逐渐减慢,这说明在少量的Y和Mo掺杂后,形成了非整比化合物后,对其电化学循环性能有所改善,这一结果与我们在XRD图谱中分析次强峰的强度I111与主强峰强度I131的比值的变化所得到的结论是相一致的。
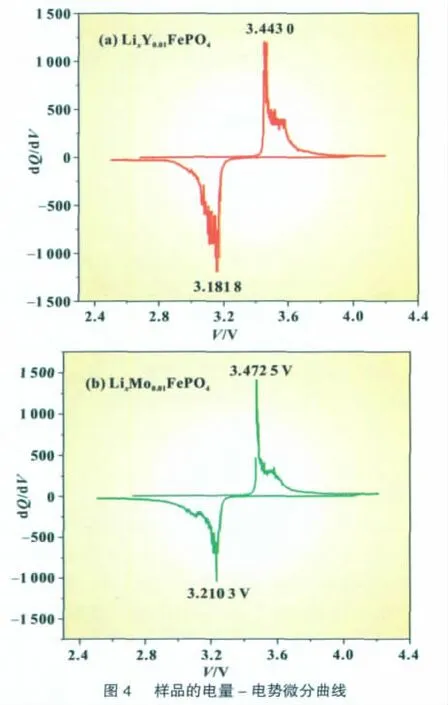
图4中a、b分别为样品 LixY0.01FePO4、LixMo0.01FePO4的首次循环的微分电量-电位曲线。LixY0.01FePO4和LixMo0.01FePO4分别在(3.443、3.1818 V)和(3.4725、3.2103 V)处有一对氧化还原峰,分别对应着LiFePO4脱嵌锂的过程,氧化峰与还原峰的差值分别为0.2612、0.2622 V,说明可逆性较好,比充、放电曲线更清楚地反映其脱、嵌锂离子的可逆情况,而且LixY0.01Fe-PO4比LixMo0.01FePO4的可逆性好些,从氧化峰与还原峰的差值可说明这一点。
为了进一步讨论非整比掺杂元素对LiFePO4正极材料性能的影响,我们对LixY0.01FePO4和LixMo0.01FePO4样品进行了交流阻抗测试。图5为样品的交流阻抗谱,测试频率范围为0.01 Hz~100 kHz。两条曲线均由高频区的半圆和低频区的直线组成,高频区的半圆是发生在电解质/电极界面的电荷迁移所引起的阻抗;低频区不同斜率的直线是由于锂离子在固相活性物质中扩散所引起的Warburg阻抗[14]。从图中可看出,样品LixY0.01FePO4的电荷迁移阻抗要比LixMo0.01FePO4的小些,而LixY0.01FePO4和LixMo0.01FePO4的电荷迁移阻抗比纯LiFe-PO4的电荷迁移阻抗小些,充、放电过程中电荷迁移阻抗的减小有利于克服该过程中的动力学控制,能够使LiFePO4活性颗粒的嵌锂深度得到提高,从而改善材料的电化学性能,导致LixY0.01FePO4比LixMo0.01FePO4具有较高的充、放电比容量及优良的电化学循环性能。

3 结论
用流变相反应法成功地合成了非整比掺杂正极材料LixY0.01FePO4和LixMo0.01FePO4,该两种掺杂的材料均具有完整的橄榄石结构,颗粒大小分布均匀。通过Y和Mo的非整比掺杂后,得到的非整比正极材料具有比较好的电化学性能。可见,通过不同金属离子的非整比掺杂可以不同程度地提高LiFePO4的电导率和锂离子扩散系数,降低电极在一定负载下的极化程度,改善其电化学性能,尤其是电池在大电流密度下工作的电化学性能。另外,由于金属离子的掺杂量很小,几乎对材料的密度没有任何影响。通过合成非整比化合物的方法来改性,方法简单、新颖、有效、可行,为开发LiFePO4正极材料在锂离子电池领域的应用提供了实验基础和理论依据。
[1]PARK K S,SON J T,CHUNG H T,et al.Surface modification by silver coating for improving electrochemical properties of LiFePO4[J].Solid State Communications,2004,129(5):311-314.
[2]YAMADA A,CHUNG S C,HINOKUMA K.Optimized LiFePO4for lithium battery cathodes[J].Electrochem Soc,2001,148(3):A 224-A 229.
[3]YANG S,SONG Y,PETER Y Z,et al.Reactivity,stability and electrochemical behavior of lithium iron phosphates[J].Electrochemistry Communications,2002,4(3):239-244.
[4]PROSINI P P,CAREWSKA M,SCACCIA S,et al.A new synthetic route for preparing LiFePO4with enhanced electrochemical performance[J].J Electrochem Soc,2002,149(7):886-890.
[5]李于华,金头男,杨丽娟,等.锂离子电池正极材料LiFePO4的微波合成及结构表征[J].分子科学学报,2005,21(5):14-18.
[6]CROCE F,EPIFANIO A D,HASSOUN J,et al.A novel concept for the synthesis of an improved LiFePO4lithium battery cathode[J].Electrochemistry and Solid State Lett,2002,5(3):47-50.
[7]BAKER J,SAIDI M Y,SWOYER J L.Lithium iron(Ⅱ)phosphoolivines prepared by a novel carbonthermal reduction method[J].Electrochem Solid-State Lett,2003,6(3):53-55.
[8]HERLE P S,ELLIS B,COOMBS N,et al.Nano-network electronic conduction in iron and nickel olivine phosphates nat[J].Master,2004,3(3):147-152.
[9]倪江峰,周恒辉,陈继涛,等.铬离子掺杂对LiFePO4电化学性能的影响[J].物理化学学报,2004,20(6):582-586
[10]CHUNG S Y,BLOKING J T,CHANG Y M.Electronically conductive phospho-olivines as lithium storage electrodes[J].Nature Materials,2002,1:123-128.
[11]杨蓉,宋晓平,姚秉华,等.正极材料磷酸亚铁锂的共沉淀合成和Mn2+的掺杂[J].西安理工大学学报,2006,22(1):82-84.
[12]徐云龙,马红彦,陶丽丽,等.共沉淀-微波法合成LiFePO4/C正极材料[J].化工新材料,2008,36(2):21-24.
[13]ANDERSSON A S,THOMAS J O.The source of first-cycle capacity loss in LiFePO4[J].J of Power Sources,2001,97-98:498-502.
[14]唐致远,阮艳莉.不同碳源对LiFePO4/C复合正极材料性能的影响[J].化学学报,2005,63(16):1500-1504.
