载脂蛋白E拟肽对EAE小鼠的髓鞘和轴突损伤的影响
2012-09-20韦俊杰郑明华梁培霄唐玉兰
韦俊杰, 郑明华, 梁培霄, 陶 敏, 唐玉兰
多发性硬化(multiple sclerosis,MS)是一种累及中枢神经系统(central nervous system,CNS)的以髓鞘脱失为主伴轴突损伤为病理特征的自身免疫性疾病。缺乏ApoE会加重MS动物模型实验性自身免疫性脑脊髓炎(EAE)的疾病进展和病理损伤[1]。ApoE拟肽是一种体外合成的小分子肽,保留了结合ApoE受体的主要结构域(133-149),通过外周给药能穿过血脑屏障,模拟ApoE发挥生物学作用[2]。而ApoE拟肽治疗对EAE的MBP和NF-L的影响,国内外未见相关报道。
本研究通过对EAE小鼠进行ApoE拟肽干预,观察其临床症状和病理变化,并用免疫组化法检测MBP和NF-L的表达,研究ApoE拟肽对EAE的作用效果,探索多发性硬化治疗的新方法。
1 材料和方法
1.1 动物和试剂 8~10w清洁级雌性的C57BL/6J小鼠40只,体重18~22g,购自北京华阜康生物科技股份有限公司[动物许可证号SCXK(京)2009-0004]。COG112(序列 acetyl-YRQIKIWFQNRRMKWKKCLRVRLASHLRKLRKRLL-amide)由美国 Cognosci公司提供,纯度 >95%。MOG35-55(序列MEVGWYRSPFSRVVHLYRNGK)由上海生工生物工程有限公司合成,纯度>95%。百日咳毒素购自美国sigma公司;完全弗氏佐剂(CFA)购自加拿大bio basic公司;卡介苗购自北京生物制品研究所;兔抗MBP多克隆一抗、兔抗NF-L多克隆一抗均购自北京博奥森生物技术有限公司;SP法免疫组化试剂盒、DAB显色盒均购自北京中杉金桥有限公司。
1.2 方法
1.2.1 制模及干预 用0.01mol/L PBS缓冲液将少突胶质细胞糖蛋白(MOG35-55)稀释成2mg/ml,与等量的含6mg/ml卡介苗的CFA充分混合,用全玻璃注射器抽打制成油包水乳剂抗原。随机将C57BL/6J小鼠分为正常组(n=10)、正常治疗组(n=10)、EAE 组(n=10)、EAE 治疗组(n=10)。EAE组、EAE治疗组于小鼠背部皮下多点注射MOG35-55乳剂抗原0.2ml/只。正常组、正常治疗组用生理盐水代替MOG35-55,余步骤和方法同前。免疫当天计为第0天,分别于第0、2天给每只小鼠腹腔注射百日咳毒素0.5μg/次。正常治疗组、EAE治疗组在免疫后第2天到第30天每隔两天按5mg/kg/day背部皮下注射COG112。正常组和EAE组除了用生理盐水替代COG112外,余给药方法相同。
1.2.2 症状及功能评分 免疫后第0~35天每日上午由同一个人观察小鼠症状并进行神经功能评分,同时测量体重并记录。神经功能评分采用15分评分法[3]。尾巴:0分为不发病;1分为尾巴张力减低;2分为尾巴全瘫。四肢按每个肢体单独评估:0分为无症状;1分为步态不稳;2分为肢体轻瘫;3分为肢体全瘫。将尾巴和每个肢体所得分数再累加得出总分,小鼠尾巴及四肢全瘫达到14分,出现死亡则评15分。
1.2.3 解剖及病理染色 免疫后第35天以10%的水合氯醛按体质量3m l/kg腹腔注射麻醉小鼠,先后经左心室灌注生理盐水和4%多聚甲醛,解剖分离大脑、脑干和脊髓,浸泡在4%多聚甲醛中4℃固定24h,然后逐级酒精脱水、石蜡包埋、切片、行HE染色。
1.2.4 免疫组化 将包埋好的石蜡组织块做4μm连续切片,余下按SP法免疫组化试剂盒说明书操作。阳性表达为细胞膜或细胞质染成黄色或棕黄色,阴性对照用PBS代替一抗,余步骤相同。每只小鼠的大脑、脑干和脊髓各取3张切片,每张切片在显微镜下选取互不重复的5个视野(×400倍),采用Image-proplus6.0软件对图像进行分析,测定每个视野的积分光密度值(IOD)和阳性面积(area),计算平均积分光密度(IOD/area)。
2 结果
2.1 发病情况 EAE组、EAE治疗组的小鼠全部发病,但各有1只小鼠发病后死亡。两组小鼠均在免疫第10天后开始陆续发病,症状随时间的延长而逐渐加重,高峰期后有一定的缓解。两组比较潜伏期、峰值评分均无统计学意义(P>0.05),而慢性期(第35天)评分、累积临床评分EAE治疗组均优于EAE组(P<0.05)(见表1)。
2.2 HE染色结果 EAE小鼠大脑、脑干和脊髓均有不同程度的炎性细胞浸润,部分小血管周围的炎性细胞浸润呈袖套样改变。EAE治疗组小鼠炎性细胞浸润明显轻于EAE组,浸润以脑干和脊髓为明显,大脑较少见。正常组和正常治疗组均未见异常(见图1)。
2.3 各组MBP的表达比较 通过免疫组化测定各组织MBP的平均积分光密度发现,正常组和正常治疗组相比无明显差异(P>0.05),EAE组的大脑、中脑和EAE治疗组的各部位均低于正常组和正常治疗组(P<0.05),EAE治疗组的中脑和脊髓均高于 EAE 组(P <0.05)(见表2、图2)。
2.4 各组NF-L的表达比较 通过免疫组化测定各组织NF-L的平均积分光密度发现,正常组和正常治疗组相比无明显差异(P>0.05),而EAE组的大脑、脊髓和EAE治疗组的各部位均低于正常组和正常治疗组(P<0.05),EAE治疗组的中脑和脊髓均高于EAE组(P<0.05)(见表3、图3)。
表1 临床症状观察(±s)
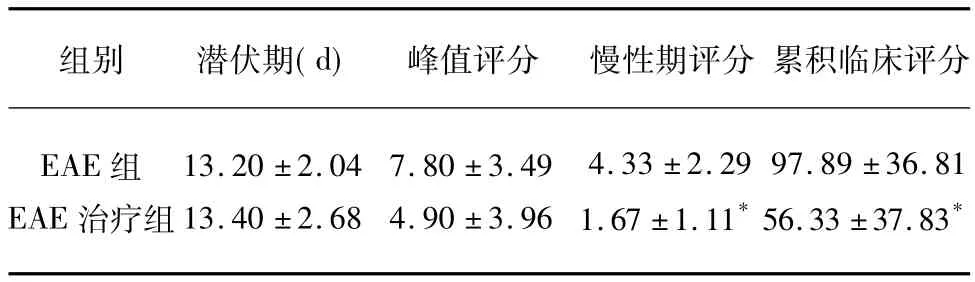
表1 临床症状观察(±s)
与EAE组比较*P<0.05
组别 潜伏期(d)峰值评分 慢性期评分 累积临床评分EAE组EAE治疗组13.20 ±2.04 13.40 ±2.68 7.80 ±3.49 4.90 ±3.96 4.33 ±2.29 1.67 ±1.11*97.89 ±36.81 56.33 ±37.83*
表2 MBP在实验小鼠CNS中的表达(±s)
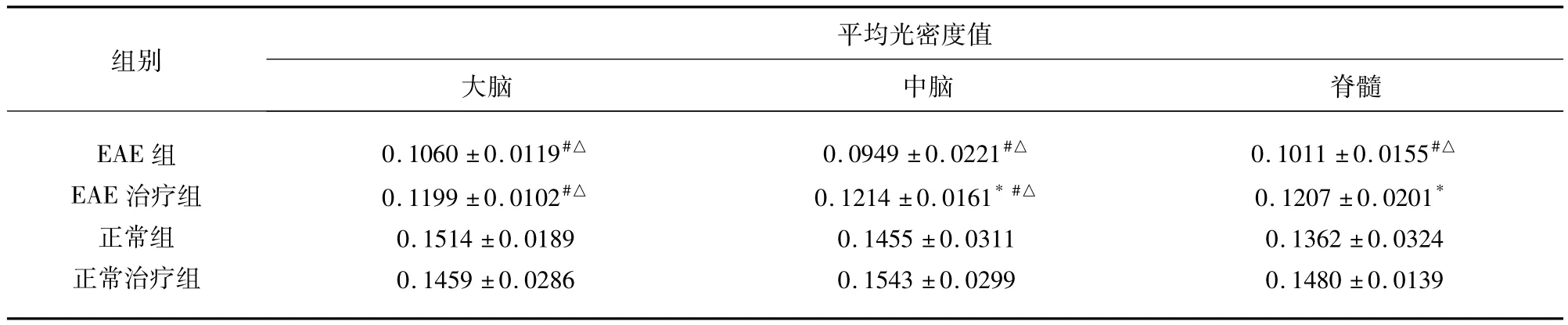
表2 MBP在实验小鼠CNS中的表达(±s)
与EAE组比较*P<0.05;与正常组比较#P<0.05;与正常治疗组比较△P<0.05
组别平均光密度值大脑 中脑 脊髓EAE组EAE治疗组正常组正常治疗组0.1060 ±0.0119#△0.1199 ±0.0102#△0.1514 ±0.0189 0.1459 ±0.0286 0.0949 ±0.0221#△0.1214 ±0.0161*#△0.1455 ±0.0311 0.1543 ±0.0299 0.1011 ±0.0155#△0.1207 ±0.0201*0.1362 ±0.0324 0.1480 ±0.0139
表3 NF-L在实验小鼠CNS中的表达(±s)
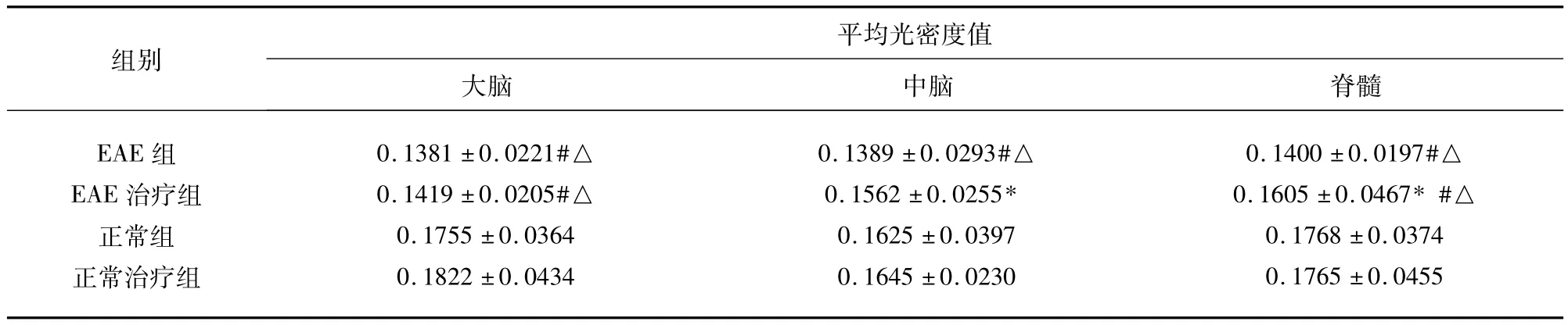
表3 NF-L在实验小鼠CNS中的表达(±s)
与EAE组比较*P<0.05;与正常组比较#P<0.05;与正常治疗组比较△P<0.05
组别平均光密度值大脑 中脑 脊髓EAE组EAE治疗组正常组正常治疗组0.1381 ±0.0221#△0.1419 ±0.0205#△0.1755 ±0.0364 0.1822 ±0.0434 0.1389 ±0.0293#△0.1562 ±0.0255*0.1625 ±0.0397 0.1645 ±0.0230 0.1400 ±0.0197#△0.1605 ±0.0467*#△0.1768 ±0.0374 0.1765 ±0.0455
3 讨论
在CNS内,神经轴突生长和髓鞘合成所必需的脂质主要依靠ApoE来转运。此外ApoE还能发挥清除代谢产物、维护血脑屏障、减少毒性损伤、调节免疫功能等作用。但完整的ApoE分子量大,正常状态下不能通过血脑屏障,限制了其作为外源性药物的应用。COG112作为一种近年来研制出的ApoE拟肽,在保留结合ApoE受体的主要结构域(133-149)的同时还融合了果蝇触角蛋白的转导区域,更容易通过血脑屏障发挥作用[4]。
本次实验发现,EAE组的慢性期评分、累积临床评分均高于EAE治疗组,说明 COG112的干预可减缓EAE病情进展。虽然EAE组的峰值评分高于EAE治疗组,但是P=0.099没有统计学意义,这可能是由于两组均有一只小鼠因死亡评了15分,计入该评分导致两组该统计学差距的缩短。如果两组峰值评分均不纳入死亡小鼠,则峰值评分差异(7.00±2.55 对3.78 ±1.86,P=0.007 <0.05) 有统计学意义。
本实验将MOG35-55制成乳化抗原免疫C57BL/6J小鼠成功诱发了EAE模型,该模型具有病程慢性进展、炎性反应轻、脱髓鞘和轴突损伤明显等特点[5],适用于研究药物对EAE髓鞘脱失和轴突损伤的影响。MBP作为CNS髓鞘的主要蛋白质,是反应髓鞘脱失情况的高特异性的指标。作为神经丝成分之一的NF-L被认为是MS患者脑脊液中特异性较高的轴突损伤指标[6]。EAE治疗组的 MBP和NF-L的表达比EAE组有所提高,说明COG112的干预能减轻EAE的髓鞘脱失和轴突损伤。在本实验中EAE治疗组的炎性细胞浸润较EAE组减少,与国际上报道COG112能改善EAE的病情并减少淋巴细胞浸润的研究结果[4]相符合,但该报道中未用到免疫组化检测MBP和NF-L来观察髓鞘脱失和轴突损伤情况,而本实验正好完善了该方面的研究。
目前认为COG112通过以下机制发挥对EAE的保护作用:一个方面,COG112能促进损伤的髓鞘和轴突的修复。COG112保留有ApoE的受体结合域,该结合域能结合低密度脂蛋白受体(LDLR)和LDLR相关蛋白1(LRP1)[7],结合少突胶质细胞的 LRP1能使鞘磷脂更容易被细胞摄取[8],结合神经元的LRP1能抑制神经元的凋亡[9]。另一个方面,COG112能减少损伤髓鞘和轴突的不利因素。首先,COG112的结合域能抑制小胶质细胞和巨噬细胞的激活,阻止其炎性信号的传导,并减少其TNF-α、IL-6的分泌[10,11]。其次,在动物体内试验发现 COG112能抑制CD4+T淋巴细胞的增殖,同时还降低巨噬细胞的TNF-α、IL-6、一氧化氮(NO)、NO 合成酶的表达[4]。再者,COG112结合域能部分性竞争结合N-甲基-D-天冬氨酸(NMDA)的受体[12],NMDA 受体是与神经毒性氨基酸如谷氨酸等结合的受体之一。而EAE中已激活的免疫细胞会释放大量的谷氨酸,高浓度的谷氨酸能直接对神经细胞产生兴奋毒性,导致细胞损伤和凋亡。COG112能通过竞争性结合NMDA受体从而发挥拮抗谷氨酸的神经毒性作用,在EAE的神经毒性损伤中起到神经保护作用。
本研究发现COG112能改善EAE模型的临床症状,减轻髓鞘和轴突的损伤,促进髓鞘修复和轴突的再生,对EAE起到了治疗作用,可能为MS临床治疗提供新的方法。但由于MS对髓鞘和轴突的损伤机制复杂,还需要与淋巴细胞和炎性因子的变化结合起来研究EAE模型中ApoE拟肽的作用机制,并根据研究成果来改进ApoE拟肽的用法,以期达到最优疗效。

图1 A:EAE组;B:EAE治疗组;C:正常组;D:正常治疗组(HE染色,×400)
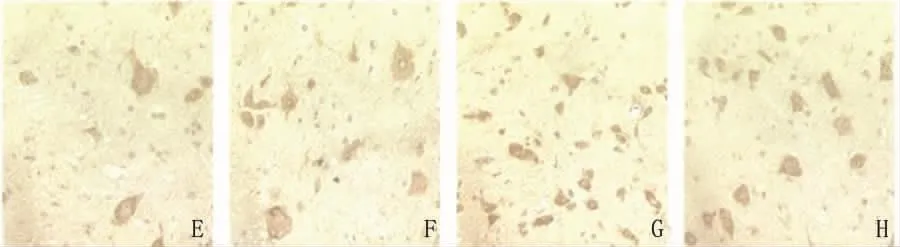
图2 E:EAE组;F:EAE治疗组;G:正常组;H:正常治疗组(MBP免疫组化染色,×400)
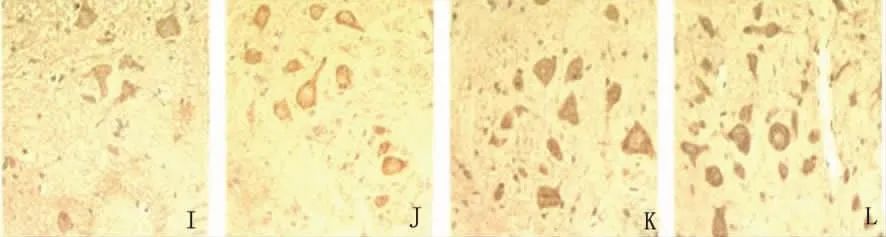
图3 I:EAE组;J:EAE治疗组;K:正常组;L:正常治疗组(NF-L免疫组化染色,×400)
[1]Karussis D,Michaelson DM,Grigoriadis N,etal.Lack of apolipoprotein-E exacerbates experimental allergic encephalomyelitis[J].Mult Scler,2003,9(5):476-480.
[2]Laskowitz DT,Fillit H,Yeung N,etal.Apolipoprotein E-derived peptides reduce CNS inflammation:implications for therapy of neurological disease[J].Acta Neurol Scand Suppl,2006,114(suppl 185):15-20.
[3]Weaver A,Goncalves Da Silva A,Nuttall RK,etal.An elevatedmatrix metalloproteinase(MMP)in an animalmodel ofmultiple sclerosis is protective by affecting Th1/Th2 polarization[J].FASEB J,2005,19(12):1668-1670.
[4]Li FQ,Sempowski GD,McKenna SE,etal.Apolipoprotein E-derived peptides ameliorate clinical disability and inflammatory infiltrates into the spinal cord in amurinemodel ofmultiple sclerosis[J].JPharmacol Exp Ther,2006,318(3):956-965.
[5]Gold R,Linington C,Lassmann H.Understanding pathogenesis and therapy ofmultiple sclerosis viaanimalmodels:70 yearsofmeritsand culprits in experimental autoimmune encephalomyelitis research[J].Brain,2006,129(8):1953-1971.
[6]Teunissen CE,Dijkstra C,Polman C.Biologicalmarkers in CSF and blood for axonal degeneration inmultiple sclerosis[J].Lancet Neurol,2005,4(1):32-41.
[7]Croy JE,Brandon T,Komives EA.Two apolipoprotein E mimetic peptides,ApoE(130-149)and ApoE(141-155)2,bind to LRP1[J].Biochemistry,2004,43(23):7328-7335.
[8]Gaultier A,Wu X,Le Moan N,etal.Low-density lipoprotein receptorrelated protein 1 is an essential receptor formyelin phagocytosis[J].J Cell Sci,2009,122(8):1155-1162.
[9]Hayashi H,Campenot RB,Vance DE,etal.Apolipoprotein E-containing lipoproteins protect neurons from apoptosis via a signaling pathway involving low-density lipoprotein receptor-related protein-1[J].J Neurosci,2007,27(8):1933-1941.
[10]Lynch JR,TangW,Wang H,etal.APOE genotype and an ApoE-mimetic peptidemodify the systemic and central nervous system inflammatory response[J].JBiol chem,2003,278(49):48529-48533.
[11]Christensen DJ,Ohkubo N,Oddo J,etal.Apolipoprotein E and peptidemimeticsmodulate inflammation by binding the SET protein and activating protein phosphatase 2A[J].J Immunol,2011,186(4):2535-2542.
[12]Sheng Z,Prorok M,Brown BE,etal.N-Methyl-D-aspartate receptor inhibition by an apolipoprotein E-derived peptide relies on low-density lipoprotein receptor-associated protein[J].Neuropharmacology,2008,55(2):204-214.
