卒中后抑郁大鼠小脑P38、BDNF改变的实验研究
2012-09-20刘欣跃王东玉隋汝波
刘欣跃, 王东玉, 隋汝波
卒中后抑郁(post-stoke depression,PSD)是卒中最常见的并发症之一,占卒中患者的20% ~50%[1],PSD是阻碍卒中患者神经功能和日常生活能力恢复的重要因素,并与卒中患者的社交回避和病死率增高密切相关[2]。最近15年的研究报道的PSD患病率在5% ~63%之间[3],总体发生率高达80%[4],显著增加了卒中患者的病死率[5]、致残率[6],降低了生存质量[7,8]。因此进一步深入研究PSD的发病机制从而制定经济有效的治疗措施是防治PSD的必要途径,具有非常重要的理论和现实意义。近年的大量研究发现精神分裂症、抑郁等精神紊乱均与小脑病变有关,而小脑急性和慢性病变皆可引起小脑认知情感障碍综合征[9,10]。而且小脑功能低下的程度与抑郁的严重程度呈正相关[11]。本文通过对卒中后抑郁大鼠小脑组织P38、BDNF的观察和比较,研究卒中后抑郁与小脑功能的关系,以进一步阐明小脑功能的改变在PSD发病中的作用机制。
1 材料与方法
1.1 实验动物 选用健康雄性SD(Sprague-Dawley,SD)大鼠72只,体重250~300g(辽宁医学院实验动物中心提供)。许可证号:SCXK(辽)。实验动物级别:普通级。
1.2 实验药品和试剂 P38、BDNF试剂盒购自北京博奥森生物技术有限公司。
1.3 实验仪器 连续变倍体视显微镜160x:桂林仪器厂;石英自动双重纯水整流器:江苏丹阳门石英玻璃厂;LEICA-RM-2135石蜡切片机:德国;烘片、烤片机:孝感市电子仪器厂;OLYMPUS万能显微镜:日本;电热干燥箱:余姚工业仪表二厂。
1.4 动物分组及实验方法 将实验大鼠适应饲养1w,自然昼夜节律光照,自由摄食进水,通风良好,(21±2)℃恒温。期间训练饮用蔗糖水消耗和旷野实验(open-field test,OFT)基线值。选择评分相近大鼠72只,随机分为4组,每组18只。对照组:给予假手术处理,除拴线不插入颈总动脉外,余同手术组;卒中组:行大脑中动脉闭塞(MCAO)术;单纯抑郁组:慢性不可预见的温和刺激(CUMS)结合孤养法;卒中后抑郁(PSD)组:MCAO术后第3天加以慢性不可预见的温和刺激(CUMS)结合孤养法。
1.5 动物模型的制备及处理
1.5.1 大鼠于局灶性脑缺血模型建立[12](middle cerebral artery occlusion,MCAO)手术前 12h禁食不禁水。选用标准大鼠麻醉剂量,以10%水合氯醛3m l/kg-1经腹腔麻醉,仰卧固定于手术台上,颈部正中切开皮肤及浅筋膜,钝性分离胸锁乳突肌与胸骨舌骨肌,暴露左侧颈总动脉(CCA)和迷走神经、颈外动脉(ECA)、颈内动脉(ICA)、ICA的颅外分支-翼腭动脉,在近心端结扎CCA,在颈总动脉分叉处结扎ECA,结扎翼腭动脉。将ICA远心端用动脉夹夹闭,距颈总动脉分叉处近心端0.5cm处将颈总动脉剪一小口,插入备好的碳素鱼线,去除动脉夹,沿着ICA轻轻向前推进,注意不要误入翼腭动脉,当到达指定长度(18cm左右)时结扎ICA并固定鱼线。假手术组动物,除手术过程中不插入钱栓以外,其他过程相同。以青霉素局部消毒后缝合皮肤。术后保持环境温度在25℃ ~30℃左右。尤其要注意动物头部的保温。模型成功的标志是大鼠即刻出现右侧Horner征。
1.5.2 建立大鼠卒中后抑郁模型CUMS 按Willner[13]和 Katz[14]方法:(1)禁食禁水 20h;(2)禁水17h;(3)倾斜鼠笼(45℃)17h;(4)持续光照17h;(5)湿笼(100g锯屑+200ml水)21h;(6)4℃游泳5min;(7)水平摇晃5min;(8)行为限制2h;(9)夹尾1min;共9种刺激每天随机采取一种。共18d。孤养:将PSD和抑郁组动物单笼饲养。
1.6 观察指标
1.6.1 行为学观察和测试 CUMS开始第7、14、21天,行旷野实验测试,每周行蔗糖水实验并测量体重,应激结束后行强迫游泳实验。(1)旷野实验:室内隔音,测定5min水平和垂直运动得分及中央格停留时间、修饰次数和粪便颗粒;(2)蔗糖水实验:20h禁食禁水后,测定1h糖水饮用比例(糖水消耗/总液消耗×100%);(3)强迫游泳实验:连续观察5min,累计大鼠在水中停止挣扎、成漂浮状态的时间。
1.6.2 标本制备 动物完成观察后,于相应时间点7d、14d、21d,在大鼠尽量安静的条件下迅速断头取脑,在冰盘上迅速分离出病灶侧的小脑组织,按以下不同方法进行各项指标的检测。
1.6.3 HE染色 大鼠以10%水合氯醛(0.3 ml/100mg)腹腔注射麻醉,打开颈部,暴露颈右总动脉,插管,先输注生理盐水约50ml,然后输注4%多聚甲醛约50ml,断头取脑。甲醛固定,冠状脑片制备,选择梗死中心(即最大层面),常规酒精脱水,石蜡包埋,制成4~6μm厚的切片,贴片,行苏木素-伊红(HE)染色,分别观察梗死中心区和梗死周边区小脑组织的神经细胞形态(每个观察区选择具有代表性指标的样本观察结果并记录)。
1.6.4 免疫组织化学检测小脑组织P38、BDNF的表达 石蜡切片脱蜡水化→微波修复10min→滴加3%H2O2室温孵育10min→PBS冲洗5min/次×3次→加封闭液,室温放置20min→加一抗4℃过夜→PBS冲洗5min/次×3次→加B液→水育箱37℃温育30min→PBS冲洗5min/次 ×3次→加C液,室温下孵育30min→PBS冲洗5min/次×3次→DAB染色→自来水冲洗5min→DW浸洗30s→苏木素复染→自来水冲洗5min→DW浸洗30s→分化液浸洗→自来水冲洗5min→DW浸洗30s→依次过梯度酒精→梯度二甲苯→封片。
2 结果
2.1 大鼠行为学观察和测试 与卒中组相比,单纯抑郁组大鼠体重和糖水消耗量下降,水平运动及垂直运动水平降低(P<0.01);PSD组大鼠体重和糖水消耗量下降更为明显,水平运动及垂直运动水平降低也最为明显(P<0.01)
2.2 小脑组织顶核区域的病理形态学 HE染色光学显微镜下观察(×400),每组均可见正常神经元和损伤神经元。正常神经元核圆形,边界及核仁清楚;损伤神经元胞核肿大,偏位,核仁消失,胞浆着色浅、苍白或核浓缩、深染,细胞呈三角形缺血性坏死变化。单纯抑郁组、卒中组、PSD组上述表现更为明显,并呈现出依次加重的趋势。
2.3 小脑组织的免疫组织化学 免疫组化结果显示,小脑组织的主要表达区域在其普肯耶纤维细胞层,小脑浦肯野细胞呈P38阳性反应,细胞单层排列,呈梨形或烧瓶形,细胞直径约25~30μm,阳性反应产物为黄色,主要位于细胞质,胞核淡染;
P38组间比较,对照组普肯耶纤维细胞表达正常,颜色着色最深,表达最为明显(见图1,放大倍数×400);单纯抑郁组大鼠普肯耶纤维细胞数量减少,颜色着色与PSD组比较略深,表达为中等强度(见图2,放大倍数×400)。卒中组大鼠普肯耶纤维细胞数量减少不明显,且颜色较深,表达为极强度(见图3,放大倍数×400);而PSD组大鼠普肯耶纤维细胞数量明显减少,且颜色着色极浅,表达为弱强度(见图4,放大倍数×400)。组内比较,在时间点7d、14d、21d,卒中组普肯耶纤维细胞表达稳定在一定程度,基本无加重趋势。单纯抑郁组与PSD组随时间的延长普肯耶纤维细胞表达数量逐渐减少,且颜色逐渐变浅。
BDNF在浦肯野细胞也呈阳性表达,位于细胞质,胞核淡染,阳性反应产物为黄色。对照组普肯耶纤维细胞表达正常,颜色着色最深,表达最为明显(见图5,放大倍数×400);卒中组大鼠普肯耶纤维细胞数量减少不明显,且颜色较深,表达为极强度(见图6,放大倍数×400);单纯抑郁组大鼠普肯耶纤维细胞数量减少,颜色着色与PSD组比较略深,表达为中等强度(见图7,放大倍数×400);而PSD组大鼠普肯耶纤维细胞数量明显减少,且颜色着色极浅,表达为弱强度(见图8,放大倍数×400)。在时间点7d、14d、21d,卒中组普肯耶纤维细胞表达稳定在一定程度,基本也无加重趋势。单纯抑郁组与PSD组随时间的延长普肯耶纤维细胞表达数量也逐渐减少,颜色也逐渐变浅。
3 讨论
本实验研究着眼于对PSD大鼠行为学的观察和测试、小脑组织普肯耶纤维细胞功能活性依赖蛋白突触素P38、BDNF的表达及小脑组织病理形态学的观察。与卒中组比较,单纯抑郁组大鼠行为学观察和测试、P38、BDNF的表达普遍减弱;与单纯抑郁组相比较,PSD组大鼠行为学观察和测试、小脑组织P38、BDNF的表达减弱的更为明显。与单纯卒中相比,PSD患者小脑功能可能发生了改变,或者可能小脑参与了PSD的发生,而且PSD患者认知功能和精神症状和本实验PSD大鼠的行为学表现相一致。卒中后任何部位的损害都可能通过该损害区与小脑间的双向突触联系影响小脑功能,小脑病变皆可引起小脑认知情感损害,而且小脑功能损害的程度与抑郁程度呈正相关,从而导致一种特殊的抑郁即PSD的发生。
突触素P38是一种与突触功能密切相关的膜蛋白,1985年Jahn[15]等首先在大鼠脑突触囊泡中发现。它广泛存在于机体所有神经终末,特异性地分布于突触前囊泡膜上,因其与神经生长、修复、再生和突触重塑密切相关。本实验中,PSD组大鼠的行为学表现和小脑组织P38表达明显下降,说明PSD大鼠小脑的功能受到损害,是何种机制导致PSD大鼠的小脑功能发生损害,目前国内外研究较少,特别是小脑在PSD发病机制中的基础研究国内外更未见报道。
本文另一个反映小脑功能的蛋白质为BDNF,它是一种具有强烈促生长能力和在其释放、结合受体活动中有复杂的相互作用的物质,对运动神经元有营养、修复和再生的作用。同样在本实验中,PSD组大鼠的行为学表现和小脑组织BDNF表达也明显下降,也同样说明PSD大鼠小脑的功能受到损害,其具体发生机制也尚不明确。
由此我们推测,小脑功能低下可能参与了PSD的发生,而且近年大量实验证实了一个现象,即“交叉性小脑神经功能联系不全”,即任何部位的脑损害(如目前公认的与抑郁发生密切相关的下丘脑、海马等边缘系统及额叶、基底节等区的卒中)都会通过该病变部位与小脑间的突触联系(如经典的“额叶-脑桥-小脑”环路)引起对侧远隔部位的小脑的血流和代谢下降,从而降低小脑功能[16]。而研究证实,小脑无论在解剖还是功能上都与大部分皮质(包括额叶)及皮质下结构如下丘脑、海马等边缘系统有着广泛的突触联系,这些区域正与情感密切相关[17],PSD作为一种特殊的抑郁,也应具有类似的表现。国内刘竟丽等[18]应用电刺激小脑顶核治疗PSD患者,结果显著改善了PSD患者的抑郁症状。这些研究进一步提示小脑与PSD发病密切相关[19]。因此,更加深入的研究小脑功能与PSD的关系,可能有助于阐明小脑功能的改变在PSD发病中的作用机制提供了思路,从而制定经济有效的治疗与预防措施,具有重要的理论和现实意义。

图1 对照组
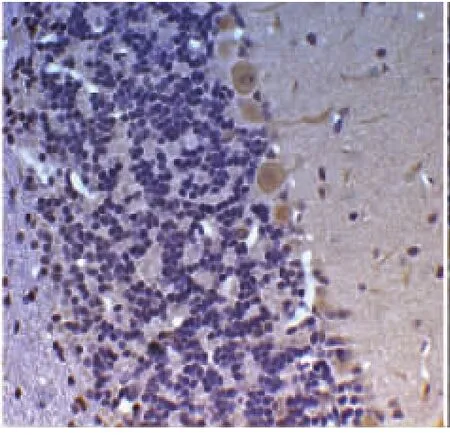
图2 单纯抑郁组(中等强度)
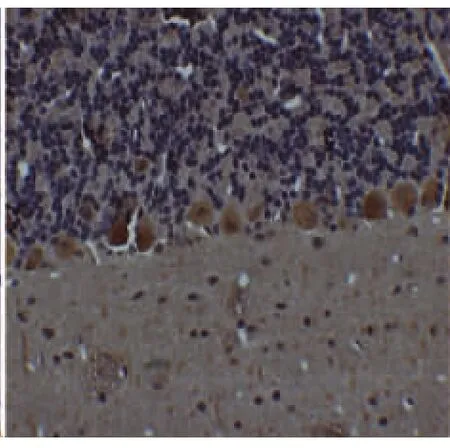
图3 卒中组(极强度)

图4 PSD组(弱强度)

图5 对照组
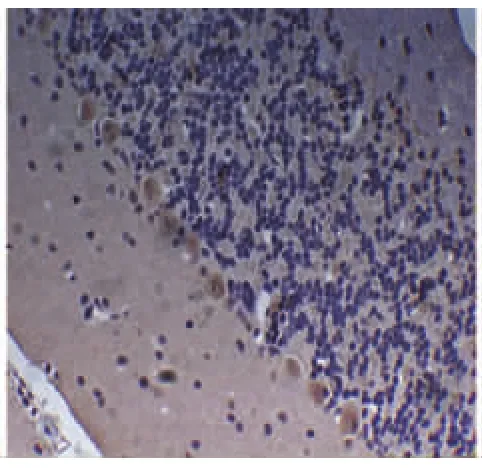
图6 卒中组(极强度)
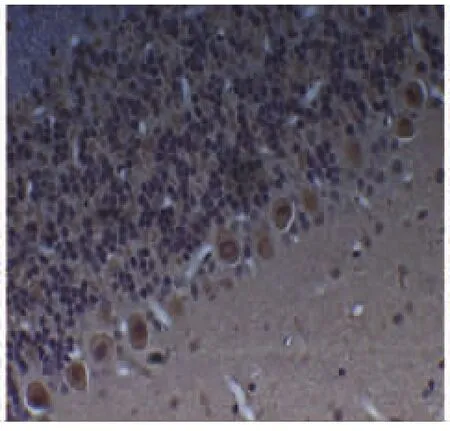
图7 单纯抑郁组(中等强度)
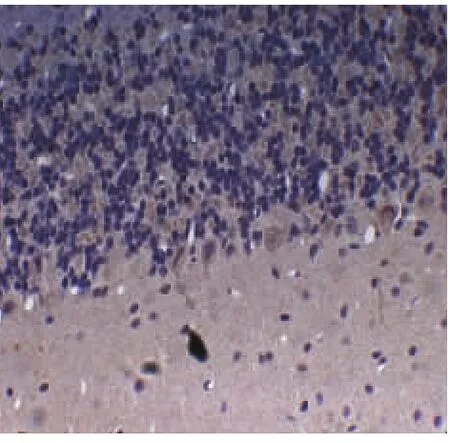
图8 PSD组(弱强度)
[1]Fruhwald S,Loffier H,Baumhackl U,etal.Depression after cerebrovascular injury:review and differentiation from other psychiatric complications[J].Fortschr Neurol Psychiatr,1999,67(4):155-162.
[2]Bhogal SK,Teaselt R,Foley N,etal.Lesion location and post stroke depression:systematic review of the methodological limitation in the literature[J].Stroke,2004,35:794-802.
[3]Johnson JL,Minaric PA,Nystrom KV,etal.Post stroke depression incidence and risk factors:an integrative literature review[J].JNeurosci Nurs,2006,38(Suppl 4):316-327.
[4]Paolucci S,Gandolfo C,Provinciali L,etal.The Italian multicenter observational study on post-stroke depression[J].JNeurol,2006,253(5):556-562.
[5]Schulz R,Beach S,Ives D,etal.Associaton between depression and mortality in older adults:the cardiovascular health study[J].Arch Intern Med,2000,160:1761-1768.
[6]Lenze EJ,Rogers JC,Martire LM,etal.Theassociation of late-life depression and anxiety with physical disability:a review of the literature and prospectus for future research[J].Am JGeriatr Psychiaty,2001,9:113-135.
[7]Parikh RM,Robinson RG,Lipsey JR,etal.The impact of post stroke depression on recovery in activities of daily living over a 2-year follow-up[J].Arch Neurol,1990,47:785-789.
[8]Herrmann N,Black SE,Lawrence J,etal.The sunnybrook stroke study:a prospective study of depressive symptoms and functional outcome[J].Stroke,1998,29:618-624.
[9]Schmahmann JD,Weilburg JB,Sherman JC.The neuropsychiatry of the cerebellum-insights from the clinic[J].Cerebellum(London,England),2007,6(3):254-267.
[10]Wolf U,RapoportMJ,Schweizer TA.Evaluating the affective component of the cerebellar cognitive affective syndrome[J].JNeuropsychiatry Clin Neurosci,2009,21(3):245-253.
[11]Sassi RB,Soares JC.Ressonanciamagnética estrutural nos transtornos afetivos[J].Rev Bras Psiquiatr,2001,23(1):11-14.
[12]陈佳俊,石岩殊,韩雪梅,等.线拴法大鼠局灶性缺血模型(PMCAO)的实验研究[J].吉林医学,2004,25(10):16-17.
[13]Willner P,Towell A,Sampson D,etal.Reduction of sucrose preference by chronicmild unpredictable stress and its restoration by a tricyclic antidepressant[J].Psychopharmacology,1987,93(3):358-364.
[14]Katz RJ,Roth KA,Carroll BJ.Acute and chronic stress effects on open field activit in the rats implications for a model of depression[J].Neurosci Biobehav Rev ,1981,5(2):247-251.
[15]Janh R,Schiebler W,Quimet C,etal.A-38000 Dalton membrane protein(p38)present in synaptic vesicle[J].Proc Natl Acad Sci USA ,1985,82(12):4137-4141.
[16]Komaba Y,Mishina M,Utsumi K,etal.Crossed cerebellar diaschisis in patients with cortical infarction:logistic regression analysis to control for confounding effects[J].Stroke,2004,35(2):472-476.
[17]Peng YP,Qiu YH,Chao BB,etal.Effect of lesions of cerebellar fastigial nuclei on lymphocyte functions of rats[J].Neurosci Res,2005,51(3):275-284.
[18]刘竞丽,李劲频,董为伟.电刺激小脑治疗脑卒中后抑郁的临床探讨[J].中国临床康复,2003,7(13):1926-1927.
[19]Rubo Sui R,Lei Zhang L,Lianqiu Min L,etal.Cerebellar dysfunction may play an important role in post-stroke depression[J].Med Hypotheses,2009,72(6):643-646.
