IVF-ET反复种植失败患者子宫内膜HOXA-10基因的表达
2012-09-18杨海燕倪吴花滕依丽孟绿荷
杨海燕 倪吴花 滕依丽 孟绿荷
IVF-ET反复种植失败患者子宫内膜HOXA-10基因的表达
杨海燕 倪吴花 滕依丽 孟绿荷
目的研究同源框基因-10(HOXA-10)在人子宫内膜组织中的表达,并探讨其与体外受精-胚胎移植(IVFET)反复种植失败的相关性。方法以40例IVF-ET治疗反复种植失败的患者为研究对象,以40例正常妇女及5例早孕人流患者作为对照,获取患者各时期子宫内膜及蜕膜组织,采用免疫组织化学法检测HOXA-10蛋白在各时期子宫内膜及蜕膜上的定位和表达,采用反转录-聚合酶链反应(RT-PCR)方法和蛋白印迹法(Western blotting)测定HOXA-10 mRNA在各时期子宫内膜及蜕膜上的表达及其蛋白水平。结果HOXA-10蛋白定位于子宫内膜腺上皮细胞和间质细胞,其mRNA和蛋白在各期子宫内膜及蜕膜组织中均有表达。在对照组中以分泌中期、晚期及蜕膜中的表达最强,明显高于月经期和增殖期(P<0.05);而在反复种植失败患者子宫内膜中的表达水平基本一致,无明显分泌中、晚期峰,并且分泌中、晚期的表达要显著低于对照组,差异有统计学意义(P<0.05)。结论HOXA-10基因在分泌中、晚期子宫内膜及早孕蜕膜组织中的高表达与胚胎种植及妊娠维持密切相关;其表达下降可能是导致IVF-ET反复种植失败的重要原因之一。
HOXA-10子宫内膜体外受精-胚胎移植种植
体外受精-胚胎移植(IVF-ET)技术发展至今,促排卵刺激方案及实验室技术得到了长足的进步,使移植胚胎的质量有了明显提高,但种植率及最终的妊娠率仍然不是很理想,临床上有很大一部分患者还存在反复种植失败的问题。目前认为种植失败中2/3是由子宫内膜容受性异常引起的。研究表明,同源框基因-10(HOXA-10)属于多基因家族的转录调节基因,是子宫内膜容受性建立和胚胎种植成功的必需调节因子,本研究首次通过检测HOXA-10基因在IVF-ET反复种植失败患者子宫内膜组织的表达以探讨其与反复种植失败的相关性。
材料与方法
1.研究对象:选取2009年3月~2010年8月在笔者医院生殖医学中心行体外受精-胚胎移植(IVF-ET)或单精子卵泡浆内注射(ICSI)治疗,3次以上新鲜周期胚胎移植(均为D2或D3胚胎,每次移植至少有1个优质胚胎)均失败的40例患者为研究对象;以同期因男性因素在本中心行ICSI治疗,至少有1次妊娠史的40例正常妇女及在笔者医院行人工流产的正常孕早期5例患者作为对照。研究组患者年龄30.7± 3.1岁,不育年限3.4±2.0年,对照组患者年龄30.9±3.0岁,不育年限3.0±1.7年,蜕膜取自孕45~60天患者。所有患者基础内分泌正常,月经周期正常(21~35天),既往无卵巢手术史,3个月内无激素治疗及宫腔操作史,无合并子宫内膜异位症、输卵管积水、生殖器畸形、子宫肌瘤、子宫腺肌瘤或多囊卵巢综合征及其他系统疾病,曾行宫腔镜检查或子宫输卵管碘油造影,排除异常宫腔,B超监测过程中未提示内膜异常,移植日内膜厚度均在7mm以上。所有患者均签署知情同意书,并获得本院伦理委员会批准。
2.方法:(1)标本的收集与处理:结合80例患者临床表现及定期的超声检查(必要时结合血液相关指标测定)确定子宫内膜时期并获取各时期子宫内膜组织共80份(80例患者各时期单点取材),同时获取在本院行人工流产的正常孕早期5例患者的蜕膜组织5份。其中研究组中包括月经期,增生早、中、晚期各5份,分泌早、中、晚期各5、10、5份;对照组中包括月经期,增生早、中、晚期各5份,分泌早、中、晚期各5、10、5份,蜕膜5份。所有子宫内膜组织均由专人获取,取自子宫底部,4%多聚甲醛固定,梯度乙醇脱水,二甲苯透明后石蜡包埋备用。(2)免疫组织化学检测:常规HE染色镜检,根据WHO标准进行组织学分期。采用链霉菌抗生物素蛋白-生物素复合物染色法(SABC法)检测子宫内膜HOXA-10蛋白的表达,操作方法按SABC试剂盒说明书进行。石蜡切片厚5μm,组织切片常规脱蜡、消化、封闭,滴加一抗(单克隆小鼠抗人HOXA-10)(武汉博士德生物工程有限公司),稀释浓度为1∶75,4℃孵育过夜,加入二抗,3-3'-二氨基联苯胺(DAB)显色(武汉博士德生物工程有限公司),苏木素复染、脱水、透明、中性树胶封片。以磷酸盐缓冲液(PBS)代替一抗作为空白对照。每份标本观察5张切片,每张切片观察5个视野,采用美国MediaCybernetics公司计算机图像信号采集与分析系统(image-pro plus6.0图像分析软件)测定阳性部位的平均吸光度(MOD)值。(3)RT-PCR检测:TRIzol试剂(BioFlux公司)提取子宫内膜组织中总RNA后,以Oligo(dT)18进行反转录(Fermentas公司),PCR扩增引物(引物由上海生工合成)。HOXA-10引物序列上游为5'-CTTACATTGCCTGACTAA-3',下游为5'-ACAACTTCACAAGATAGG-3'(基因编号:NM018951),扩增产物180bp。同时以β-actin作为内参照,其引物序列上游为5'-CCTGAGGCTTTTCCAGCC-3',下游为5'-TAGAGGTCTTTACGGATGTCAACGT-3'。PCR循环条件为:94℃预变性5min,94℃变性40 s,55℃退火40 s,72℃延伸50 s,40个循环;72℃再延伸10min。产物经1.5%琼脂糖凝胶电泳后,读胶仪读取扩增条带的光密度值并进行分析、照相,以HOXA-10和β-actin的比值表示HOXA-10 mRNA的相对表达水平。(4)Western blotting检测:从冻存组织中用细胞裂解液提取总蛋白,采用Bradford比色法测定蛋白质含量。每个样本取总蛋白75μg。标本经8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PA GE)分离蛋白质后,湿式法电转膜至硝酸纤维素膜,加一抗稀释液(羊抗人HOXA-10多克隆抗体浓度为1∶150,羊抗人β-actin单克隆抗体浓度为1∶500,Santa Cruz,美国)4℃孵育过夜,然后与辣根过氧化物酶标记的兔抗羊二抗(1∶2000稀释,Santa Cruz,美国)在室温下孵育2h,TBS-T洗膜10min(3次,ECL显色(Pierce,美国),Koda-X线胶片显影。采用GDS-8000型全自动凝胶成像分析系统(UVP,英国)测定条带积分光密度值(IOD)来表示HOXA-10蛋白的表达水平,并分析结果。
3.统计学方法:采用SPSS11.5统计分析软件进行数据分析,所得数据用均数±标准差±s)表示,各时期内膜MOD值比较采用单因素方差分析,反复种植失败患者和对照组间MOD值比较采用成组资料t检验,P<0.05为统计学上差异有显著性。
结果
1.两组患者各时期子宫内膜HOXA-10的免疫组化检测:免疫组化结果显示HOXA-10蛋白在子宫内膜腔上皮、腺上皮、血管上皮和间质细胞都有表达。对照组中各期子宫内膜及蜕膜组织中均有表达,其中分泌中、晚期及蜕膜中的表达要明显高于月经期,增殖期和分泌早期(P<0.05);研究组中各时期子宫内膜上也均有HOXA-10蛋白的表达,但各时期间比较差异无显著性(P>0.05)。对两组间分泌中期和晚期的表达进行比较则发现,研究组HOXA-10的表达强度要显著低于对照组(P<0.05,表1、图1~图3)。
表1 两组患者各月经周期内膜及蜕膜中HOXA-10的表达(MOD±s)

表1 两组患者各月经周期内膜及蜕膜中HOXA-10的表达(MOD±s)
与月经期、增生期及分泌早期相比,△P<0.05;与月经期、增生期及分泌各期相比,▲P<0.05;与研究组相比,*P<0.05
组别月经期增殖期分泌期早中晚早中晚蜕膜对照组0.17±1.14×10-20.15±8.94×10-30.16±1.00×10-20.16±7.07×10-30.16±8.37×10-30.32±1.62×10-2△*0.33±2.59×10-2△*0.36±1.87×10-2▲研究组0.16±1.14×10-20.16±1.00×10-20.16±8.94×10-30.16±7.07×10-30.16±1.17×10-20.17±1.30×10-20.17±1.30×10-2
2.两组患者各时期子宫内膜HOXA-10mRNA的RT-PCR检测:两组在180bp处均出现了特异性的HOXA-10基因条带。电泳带光密度扫描结果显示,HOXA-10mRNA在各期子宫内膜组织及蜕膜组织中均有表达。对照组中分泌中、晚期和蜕膜组织中表达最强,与其余各期相比差异有显著性(P< 0.05),而研究组中各时期子宫内膜上的表达强度无显著性变化(P>0.05),而且分泌中、晚期的表达要明显弱于对照组(P<0.05)(表2、图4)。
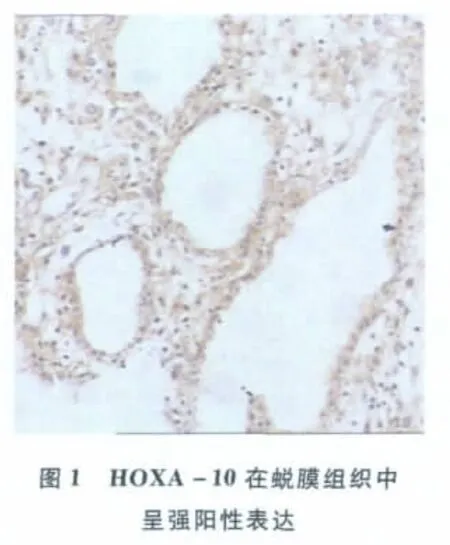



表2 两组患者各月经周期内膜及蜕膜中HOXA-10mRNA的相对表达水平(x±s)

图4 对照组子宫内膜组织及蜕膜中HOXA-10mRNA的表达
3.两组患者各时期子宫内膜HOXA-10蛋白的Western blotting检测:Western blotting分析结果显示,在40kDa的位置上出现了HOXA-10蛋白的杂交带。其在对照组中的表达量从月经期、增生期到分泌期和蜕膜组织逐渐增加,其中分泌中、晚期和蜕膜组织中表达量最高,与其余各期相比差异有显著性(P<0.05);而其在研究组各时期子宫内膜上的表达量则无显著性变化(P>0.05),其中分泌中、晚期的表达量要显著低于对照组(P<0.05) (表3、图5)。

表3 两组患者各月经周期内膜及蜕膜中HOXA-10蛋白的表达(IOD,x±s)
讨论
在着床过程中,囊胚的滋养细胞必须达到具有浸润状态,子宫内膜也要同时发育到接受状态才能启动着床。在IVF-ET中妊娠率低的原因之一即是着床失败,所以着床是生殖中的关键环节。胚胎着床过程受胚胎和母体器官一系列的调控,其中子宫内膜对胚胎容受性的建立是其中最关键的因素。而文献报道,组织学正常的子宫内膜,并不代表其功能正常或反应其容受性[1,2]。目前对子宫内膜容受性的探究已进行到了基因学的层次,其中HOXA-10是极其重要且被研究最多的一个基因。
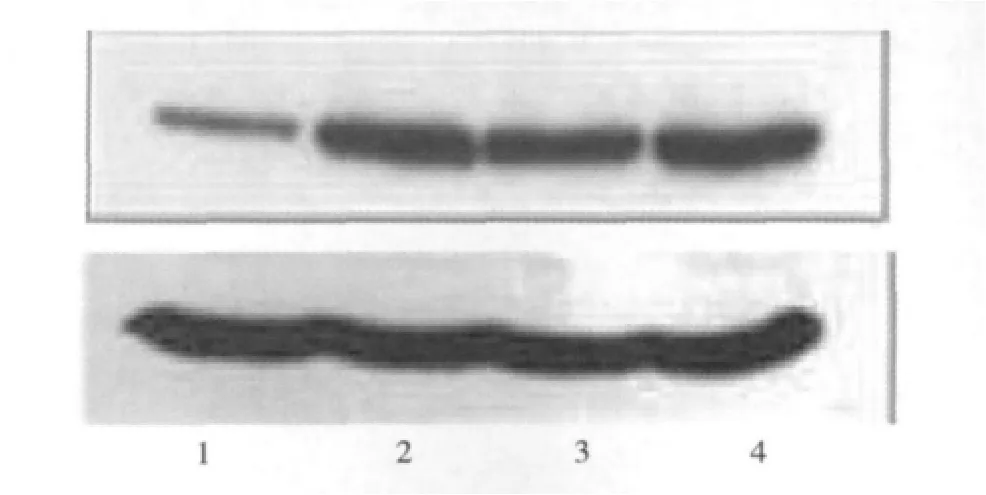
图5 对照组子宫内膜组织及蜕膜中HOXA-10蛋白的表达
1.HOXA-10在正常子宫内膜组织的表达: HOXA基因通过和DNA结合,激活或抑制目标基因,调节胚胎发育,决定细胞的定向分化和增殖。HOXA-10是该家族的重要成员,参与子宫内膜正常形态的维持、内膜的增殖与分化、容受性的建立、胚胎的定位和黏附,胞饮突的形成、蜕膜化和血管通透性的增加等[3,4]。其mRNA在人类子宫内膜上皮和基质中均有表达,而且随月经周期呈现周期性变化,在分泌中、晚期的表达明显高于增生期及分泌早期,峰值出现与子宫内膜接受窗口及血清孕酮值升高一致[5]。正常人类输卵管仅表达微量HOXA-10 mRNA,然而输卵管妊娠时其表达在输卵管妊娠的着床部位显著增加,水平接近正常妊娠时的内膜水平,表明其与着床密切相关[6]。周建生等[7]发现,早孕小鼠子宫内膜HOXA-10 mRNA的表达大于非妊娠的子宫内膜,且随着妊娠天数的增加呈逐渐上升趋势,与子宫内膜的容受性变化一致。同时发现其表达从孕5天开始下降,孕7天时接近未孕水平,与胚胎着床时子宫内膜的蜕膜化过程完全一致。他们还发现,用HOXA-10DNA质粒/脂质体转染孕2天小鼠子宫角后,小鼠的胚胎着床数明显增加;相反,用HOXA-10反义寡脱氧核糖核酸/脂质体转染后,着床数明显下降,因而认为其可能参与调节子宫内膜上皮细胞及间质细胞的周期性增殖与分化,最终使子宫内膜进入容受状态,并在蜕膜化过程中起重要作用。李雪梅等[8]通过研究证实雌、孕激素显著提高高分化子宫内膜癌Ishikawa细胞中HOXA-10基因的表达,推测HOXA-10基因增加是子宫内膜容受性增强的重要表现。
动物实验表明,母体丧失表达HOXA-10将导致生育能力下降,HOXA-10基因缺陷小鼠的子宫体积缩小,管径变细、内膜变薄,腺体数量显著减少,部分内膜变异为输卵管黏膜;HOXA-10点突变的小鼠不能着床而导致不孕,而把这些不孕小鼠的受精卵移植到有正常HOXA-10表达的野生鼠体内则能够着床并妊娠;不明原因不孕患者HOXA-10基因mRNA在月经周期不同时期子宫内膜腺体和间质中表达基本一致,无明显的分泌中、晚期峰,在腺体和间质的表达均低于正常生育妇女,均进一步说明了HOXA-10在子宫内膜发生和发育过程中起着重要的调控中的作用[9]。
本研究获取正常妇女各时期的子宫内膜及蜕膜组织进行分析,发现HOXA-10在月经期、增殖期及分泌期子宫内膜上均有表达,但分泌中期、晚期表达明显增加,蜕膜中表达最强,与既往研究结果相一致,进一步肯定了其在评价着床期子宫内膜容受性方面的特异性。
2.HOXA-10与IVF-ET反复种植失败的相关性:Cermik等[10]发现,因着床失败而导致的不孕(多囊卵巢综合征,子宫内膜异位症及输卵管积水)的患者子宫内膜中均存在的HOXA-10表达缺陷。输卵管积水的浓度越高,HOXA-10 mRNA表达越少,切除输卵管后,子宫内膜HOXA-10 mRNA表达明显升高[11,12]。7.23%的子宫内膜异位症患者有HOXA-10基因的突变,其在子宫腔上皮、腺上皮和内皮的表达正常,但在基质细胞中的表达明显下降,在分泌中期子宫内膜的表达水平远低于正常生育妇女,在黄体期的表达并不增加[13,14]。子宫肌瘤尤其是黏膜下子宫肌瘤也会影响HOXA-10基因在子宫内膜的表达,从而扰乱种植窗口期[15]。但到目前为止尚未见其在IVF-ET反复种植失败患者子宫内膜中变化的报道。本研究首次对这部分患者的子宫内膜进行相关研究,因考虑到上述常见不孕因素对结果的影响,所有患者排除了子宫内膜异位症、输卵管积水、生殖器畸形、子宫肌瘤、子宫腺肌瘤或多囊卵巢综合征等。结果发现,HOXA-10在反复种植失败患者子宫内膜中的表达周期性变化不明显,表达水平基本一致,无明显分泌中晚期峰,而且在种植窗期的表达要明显弱于对照组,认为是降低子宫内膜容受性,使胚胎与子宫内膜黏附下降,致使胚胎种植受阻的原因之一。
综上所述,HOXA-10在人类子宫内膜组织上的表达呈周期特征性,参与了子宫内膜容受性的建立。而在IVF-ET反复种植失败患者中,其在种植窗期内膜上的表达存在缺陷,从而影响了子宫内膜容受性,导致种植失败,成为这些患者不孕的内在机制。
1Palomino WA,Fuentes A,Gonzalez RR,et al.Differential expression of endometrial integrins and progesterone receptor during the window of implantation in normo-ovulatory women treated with clomiphene citrate[J].Fertil Steril,2005,83(3):587-593
2Bulletti C,Flamigni C,de Ziegler D.Implantation markers and endometriosis[J].Reprod Biomed Online,2005,11(4):464-468
3Daftary GS,Taylor HS.Pleiotropic effects of Hoxa10 on the functional development of peri-implantation endometrium[J].Mol Reprod DEV,2004,67(1):8-14
4Taylor HS.Transcriptional regulation of implantation by HOX gene[J].Rev Endocr Metab Disord,2002,3(2):127-132
5Kim JJ,Fazleabas AT.Uterine receptivity and implantation:The regulation and action of insulin2 like growth factor binding protein-1(IGFBP-10,HOXA10 and forkhead transcription factor-1(FOXO-1) in the baboon endometrium[J].Reprod Biol Endocrinol,2004,2 (6):34-40
6Salih SM,Taylor HS.HOXA10 gene expression in human fallopian tube and ectopic pregnancy[J].Am J Obstet Gynecol,2004,190 (5):1404-1406
7周建生,贾咏存,杨戎,等.HOXAa-10基因在小鼠胚胎着床过程中的作用[J].解剖学报,2008,39(2):248-251
8刘雪梅,朱桂金,钟刚.雌、孕激素及肝素结合生长因子对Ishikawa细胞HOXA10基因表达的调节[J].生殖医学杂志,2007,16 (1):39-43
9李红,陈士岭,邢福琪,HOXA10基因在子宫内膜组织中的表达与不孕的关系[J].中华妇产科杂志,2002,37(1):30-32
10Cermik D,Selam B,Taylor HS.Regulation of HOXA10expression by testosterone in vitro and in the endometrium of patients with polycystic ovary syndrome[J].J Clin Endocrinol Metab,2003,23(1):571-579
11Strandell A,Lindhard A.Hydrosalpinx fluid diminishes endometrial cell HoxA10 expression[J].Fertil Steril,2002,78(3):577-580
12Daftary GS,Kayisli U,Seli E,et al.Salpingectomy increases periimplantation endometrial HOXA10 expression in women with hydrosalpinx[J].Fertil Steril,2007,87(2):367-372
13Wei QX,St.Clair JB,Fu T,et al.Reduced expression of biomarkers associated with the implantation window in women with endometriosis[J].Fertil Steril,2009,91(5):1686-1691
14Wu Y,Strawn E,Basir Z,et al.Promoter hypermethylation of progesterone receptor isoform B(PR-B)in endometriosis[J].Epigenetics,2006,1(2):106-111
15Home AW,Critchley HO.The effect of uterine fibroids on embryo implantion[J].Semin Reprod Med,2007,25(6):483-489
(收稿:2011-10-10)
(修回:2012-02-28)
Expression of HOXA-10 in the Endometria of Patients with Recurrent Implantation Failure in IVF-ET.
Yang Haiyan,Ni Wuhua,Teng Yili,Meng Lvhe.Department of Reproductive Medicine,The First Affiliated Hospital of Wenzhou Medical College,Zhejiang 325000,China
ObjectiveTo investigate the expression of HOXA-10 in the endometria of patients with recurrent implantation failure in in vitro fertilization and embryo transfer(IVF-ET)and explore its correlation with recurrent implantation failure.Methods40 patients with recurrent implantation failure in IVF-ET treatment were analyzed as study group,and other 40 normal women and 5 normal pregnant patients as control group.The samples of endometrium throughout the menstrual cycle and deciduas were obtained in patients.Expression of HOXA-10 mRNA and protein was evaluated by using RT-PCR and Western blotting,and the location of HOXA-10 protein was evaluated by immunohistochemistry in all samples.ResultsHOXA-10 protein was located in both glandular epithelial cells and stromal cells of endometrium,and mRNA and protein was expressed in endometrium throughout the menstrual cycle.The levels of expression were obviously increased in mid,later secretory phase and was highest in deciduas in control group(P<0.05).But in study group,the levels of expression remained roughly constant and the expression in mid-and late-secretory phase was lower than that of control group(P<0.05).ConclusionThe higher expression of HOXA-10 protein in mid-,late-secretory endometria and deciduas is associated with implantation,decidualization and pregnancy.It,s defective expression may be one of the reason that cause implantation failure.
HOXA-10;Endometrium;IVF-ET;Implantation
