高血压增加循环中CXCR4+细胞而促进新生内膜形成☆
2012-09-17廖松洁龚琼陈健聪曾意萱余剑
廖松洁龚琼陈健聪 曾意萱余剑
颈动脉狭窄的手术治疗有助于降低缺血性卒中的发病风险性[1],但是内膜损伤所致术后再狭窄却严重影响了手术疗效[2]。高血压是再狭窄的一大危险因素,具体机制却尚不清楚。新生内膜是血管再狭窄的病理标志[3],以大量表型改变的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在局部堆积为特征[4],它们主要来源于骨髓血管平滑肌祖细胞和血管中膜VSMCs[5]。趋化因子调控着血管平滑肌祖细胞从骨髓向血管的募集过程,其中,CXC趋化因子即基质细胞衍生因子-1α(stromal cell-derived factor-1,SDF-1α) 及其受体 CXCR4 的作用尤为重要,直接介导新生内膜的形成[5-6]。我们利用易卒中型肾血管性高血压大鼠(stroke-prone renovascular hypertensive rats,RHRSP)制作颈总动脉内膜剥除模型,探讨高血压对新生内膜的影响和CXCR4在其中的可能作用。
1 资料与方法
1.1 动物与模型 采用体质量为80~100 g雄性Sprague-Dawley(SD)大鼠(广东省动物实验监测所,许可证号:SCXK粤2009-0011)作为实验动物。按双肾双夹法[7]复制 RHRSP,正常血压对照组暴露双侧肾动脉,但不夹肾动脉。采用鼠尾动脉测量法每周测量一次动物的收缩压。术后12~16周,选取收缩压稳定在180 mm Hg以上、无自发性卒中表现的RHRSP,行左侧颈总动脉内膜剥除术。正常情况下覆盖于血管内表面的完整内皮细胞能够抑制新生内膜形成,通过内膜剥除促使病理性新生内膜形成已成为一种公认的研究血管再狭窄的动物实验方法。按球囊扩张法复制颈总动脉内膜剥除模型[8],暴露和分离左侧颈总、颈外和颈内动脉后,结扎颈外动脉远端,暂时阻断颈内动脉和颈总动脉近端血流。在颈外动脉中段作一动脉切口,将球囊导管(Fogarty,2F,Edwards Lifesciences,USA)小心插入颈总动脉,注入生理盐水使球囊充满后,螺旋式反复旋出三次破坏动脉内膜。取出球囊导管,结扎颈外动脉近端。确定血流恢复并且颈总动脉搏动良好后,缝合切口。
1.2 动脉形态学及组织化学分析 分别于颈总动脉内膜剥除术后1、2周处死动物,以4%多聚甲醛经左心室灌注,取双侧颈总动脉,置于4%多聚甲醛浸泡固定8 h后于30%蔗糖溶液4℃脱水过夜。将血管平分为4段,包埋于OCT中,从远端向近端行冰冻切片,片厚 12 μm,间隔 100 μm。
1.2.1 新生内膜的形态学分析[9,11]从 2 周组的4段血管的远端各取一张切片行H&E(Vector Laboratories,Inc.)染色,显微镜下拍照后以 Image J软件进行形态学分析,计算内膜(管腔与内弹力膜之间)、中膜(内外弹力膜之间)面积和内膜/中膜面积比,取4张切片的平均值。以对侧非损伤动脉作为对照。
1.2.2 免疫组化分析 以1%小牛血清室温孵育1小时后加入小鼠抗大鼠 CD31一抗 (1∶40,BD Pharmigin)特异性标记内皮细胞、小鼠抗大鼠α-SMA 一抗(1∶100,Abcam)标记 VSMCs,4℃过夜,分别加入FITC或Cy3标记的抗小鼠二抗 (1∶100,Vector Laboratories)室温孵育30 min。于荧光显微镜下拍照后以Image J软件进行定量分析。再内皮化%=CD31阳性内膜长度/管腔周径×100%。
1.3 流式细胞学检测 分别于颈总动脉内膜剥除术后1、2周处死动物,取新鲜外周血。裂解红细胞后,混悬于含1%胎牛血清的PBS中,于冰上避光孵育兔抗大鼠 CXCR4 一抗(1∶100,Abcam)1 h。以上述PBS清洗2次后,加入FITC标记的抗兔二抗(1∶100,Abcam)冰上孵育 30 min。清洗后立即用于流式细胞仪检测单个核细胞群中CXCR4+细胞所占百分比。
2 结果
2.1 动物血压 除20只正常血压对照组外,共有40只大鼠进行了双肾双夹手术,其后存活并符合条件进入实验的RHRSP 25只,最后完成颈总动脉内膜剥除术的高血压动物20只(其中2只在手术过程中死亡,3只在取标本时发现损伤颈总动脉内血栓形成)。正常血压对照组的血压为 95.5±10.01 mm Hg,高血压组的血压为 203.36±17.31 mm Hg(P < 0.05,n=20)。
2.2 高血压促进新生内膜形成(图1) 颈总动脉内膜剥除后2周,新生内膜形成于损伤血管的管腔内面。与正常血压组相比,高血压组的新生内膜面积显著性增加(2.18±0.11 mm2;1.55±0.14 mm2,P=0.013,n=4)。
2.3 高血压不影响动脉再内皮化(图2) 高血压以及正常血压组损伤后1周,内皮细胞特异的CD31抗体标记显示约90%的颈动脉内膜区域已经得到形态上的修复 (89.49%±2.57%;92.19%±1.71%,P > 0.05,n=4)。
2.4 高血压时CXCR4的表达上调(图3) 在颈总动脉内膜剥除后,循环中的CXCR4+细胞百分比增高,高血压组在损伤后1周即达高峰,2周时略有回落,但均显著性高于未损伤组 (损伤1周45.64%±3.30%; 30.11%±1.27%,P=0.014;2 周43.30%±3.35%;30.11%±1.27%,P=0.024,n=3~5);正常血压组则逐渐增高,在损伤2周后才显著性高于未损伤组(32.11%±4.11%; 20.91%±2.06%,P=0.029,n=3)。在未损伤和损伤后 1 周时,高血压组的CXCR4+细胞百分比均较正常血压组显著性增高(未损伤:30.11%±1.27%;20.91%±2.06%,P=0.019;损伤1周:45.64%±3.30% ;28.28%±2.56%,P=0.003,n=3~5)。
2.5 VSMCs是新生内膜的主要组成成分(图4)高血压颈总动脉内膜剥除后14 d,以VSMC特异性的抗α-SMA抗体标记,可见VSMC广泛存在于动脉内膜和中膜,是新生内膜的主要组成成分。
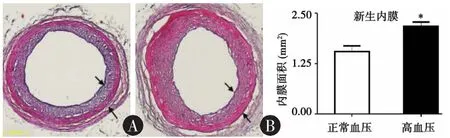
图1 颈总动脉形态学分析
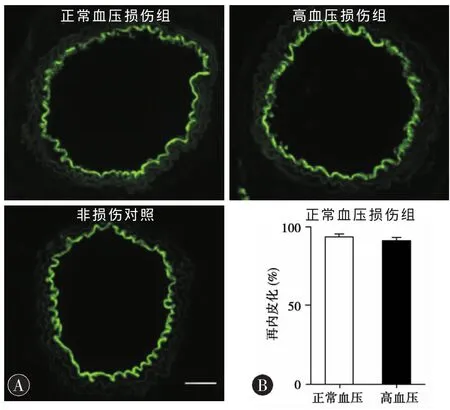
图2 动脉再内皮化(CD31抗体标记)。A.左侧颈总动脉损伤后即刻或1周后的CD31抗体荧光标记图像。100×,标尺=200 μm。B.再内皮化的定量分析。P>0.05,n=4
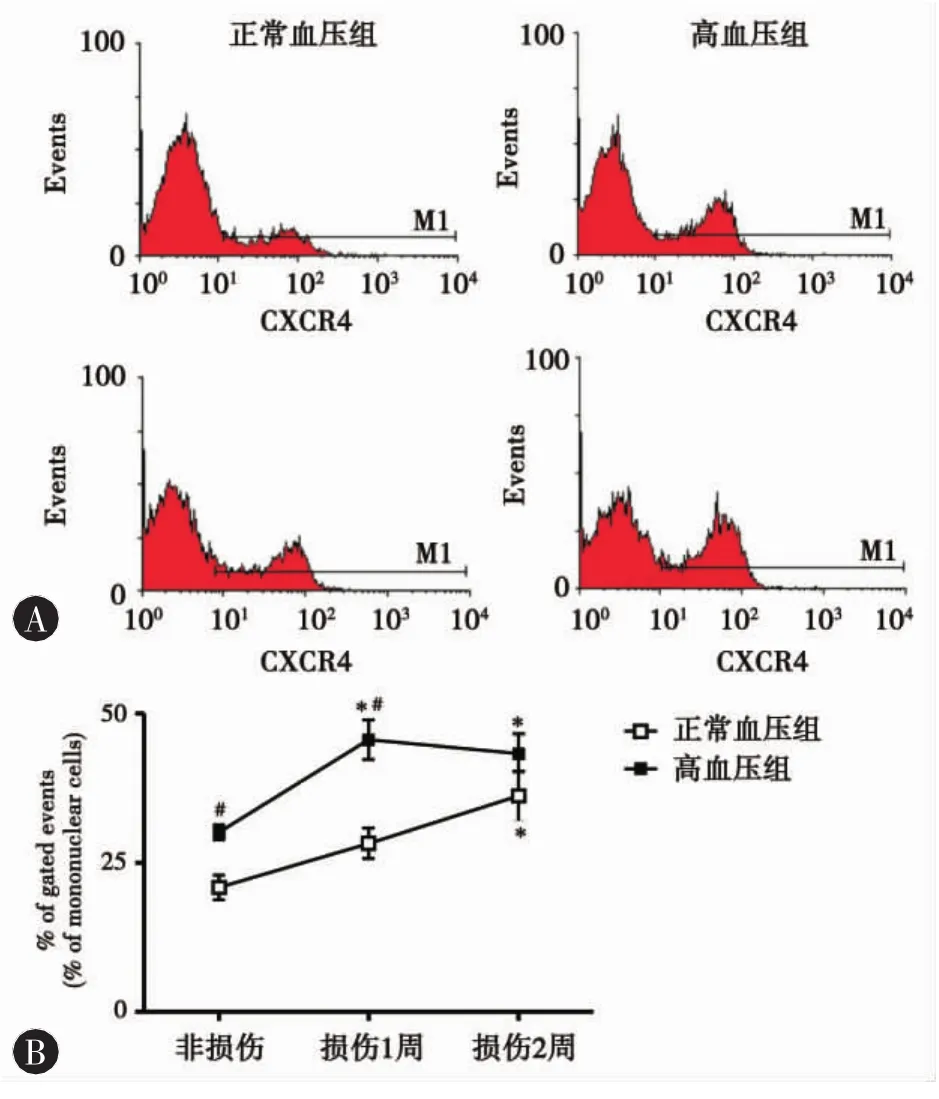
图3 血循环中CXCR4+细胞占总单核细胞的数目百分比。A.代表性图例,M1代表CXCR4+细胞区域。B.各组的定量分析结果。*与相应血压的未损伤组比较P<0.05,#与相应时点的正常血压组比较 P<0.05,n=3~5
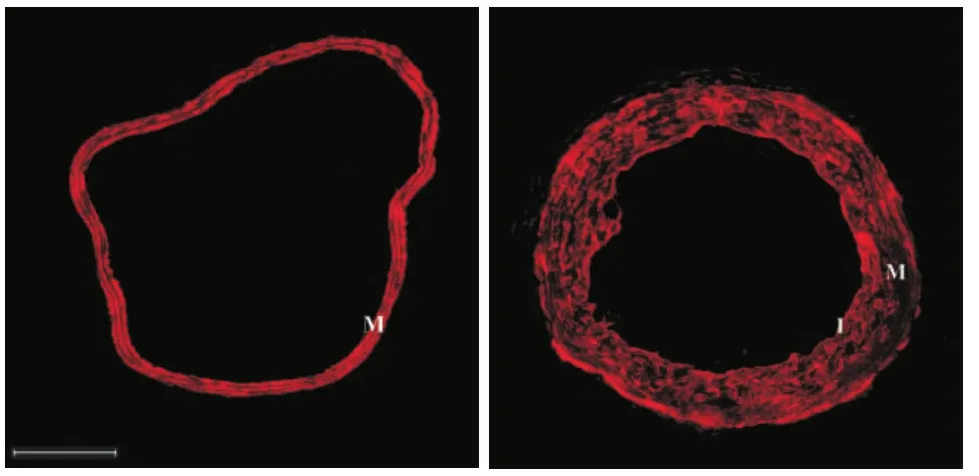
图4 标记α-SMA的动脉横切面图。红色荧光为α-SMA阳性信号,代表VSMCs。左图为高血压非损伤组,右图为高血压损伤2周组。I:内膜; M:中膜。100×,标尺=200 μm
3 讨论
本研究利用RHRSP制备左侧颈总动脉内膜剥除的动物模型,可更好地研究高血压基础上颈动脉再狭窄的发生和发展过程。结果发现高血压促进颈总动脉内膜剥除后新生内膜形成,并增加内膜剥除之前和之后早期循环中CXCR4+细胞;与此同时,与正常血压相比,高血压并不从形态上影响颈总动脉内膜剥除的内皮细胞再生,新生内膜的主要成分仍然是VSMCs。
颈动脉再狭窄在术后36个月内的发生率可高达7.9%~14%[2],对之进行再次外科手术所面临的二次再狭窄的风险性仍然高达6%~14%[2]。CREST临床研究显示超过80%的颈动脉狭窄患者伴发高血压[12],而高血压患者术后再狭窄的风险比无高血压者增高将近一倍[13],表明高血压与颈动脉再狭窄有密切关系。动脉再狭窄以新生内膜为病理性标志。我们的研究发现,高血压促进颈总动脉内膜剥除后新生内膜形成,以VSMCs为主要成分。虽然已有研究发现,活性氧(reactive oxygen species,ROS)过度生成、内皮祖细胞数目减少和功能受损、以及内皮化延迟等因素可能参与促进高血压时颈动脉新生内膜形成[14-15],但是目前却尚不清楚高血压如何促进新生内膜的主要成分——VSMCs的堆积。
正常血压时,VSMCs在新生内膜的堆积与SDF-1α/CXCR4密切相关。颈动脉内膜剥除后,早期VSMCs凋亡和缺氧诱导因子1α(hypoxia induced factor-1α,HIF-1α)的活化使 SDF-1α 在血循环中一过性表达增高,局部形成的浓度梯度可动员骨髓血管平滑肌祖细胞进入血循环;随后,SDF-1α在损伤动脉局部的表达持续增高,与循环中血管平滑肌祖细胞表面的CXCR4受体结合,促使这些细胞向损伤部位募集、并分化为VSMCs,从而参与新生内膜形成[5-6],可见,SDF-1α /CXCR4 直接介导新生内膜的形成。促进该通道的作用,如采用巨噬细胞集落刺激因子,能够促进新生内膜形成[16];而抑制该通道的作用,如采用CXCR4基因敲除的动物[5]、或给予 CXCR4 特异性拮抗剂AMD3100[16],则 能抑制新生内膜形成,同时不影响再内皮化。我们的研究显示,高血压组对照正常血压组,在颈总动脉内膜剥除之前和之后早期均见循环中CXCR4+细胞的增多。因颈总动脉内膜剥除后循环中增多的CXCR4+细胞主要来源于骨髓细胞的动员,能够募集到损伤动脉进而分化成为VSMCs,故推测早期血循环中CXCR4+细胞的增加可能是高血压促进新生内膜形成的机制之一。
高血压上调CXCR4可能与HIF-1α有关。CXCR4的配体,SDF-1α的启动子包含两个HIF-1α的结合位点,故在转录水平受HIF-1α的直接转录调控[17]。高血压促使动脉中膜增厚,氧弥散距离加大,易于形成中膜缺氧带而诱导 HIF-1α表达[18],而损伤局部过度生成的ROS通过抑制HIF-1α降解过程中的羟基化而增加 HIF-1α 表达水平[15,19]。因此,高血压具备上调HIF-1α的条件,可籍此调控SDF-1α的表达而促进动员CXCR4+细胞进入循环。
本研究初步探讨了高血压促进颈动脉新生内膜形成的可能机制,不足之处在于尚未能深入研究 SDF-1α的表达改变以及干预 SDF-1α/CXCR4通路对高血压新生内膜形成的影响。但是为进一步研究提供了可靠的基础。
[1]CAVATAS investigators.Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial[J].Lancet,2001,357(9270):1729-1737.
[2]Bettendorf MJ,Mansour MA,Davis AT,et al.Carotid angioplasty and stenting versus redo endarterectomy for recurrent stenosis[J].Am J Surg,2007,193(3):356-359.
[3]Orford JL,Selwyn AP,Ganz P,et al.The comparative pathobiology of atherosclerosis and restenosis[J].Am J Cardiol,2000,86(4B): 6H-11H.
[4]Schwartz SM.The intima : A new soil[J].Circ Res,1999,85(10):877-879.
[5]Zernecke A,Schober A,Bot I,et al.SDF-1alpha/CXCR4 axis is instrumental in neointimal hyperplasia and recruitment of smooth muscle progenitor cells[J].Circ Res,2005,96(7):784-791.
[6]Schober A,Knarren S,Lietz M,et al.Crucial role of stromal cell-derived factor-1alpha in neointima formation after vascular injury in apolipoprotein E-deficient mice[J].Circulation,2003,108(20):2491-2497.
[7]Zeng J,Zhang Y,Mo J,et al.Two-kidney,two clip renovascular hypertensive rats can be used as stroke-prone rats [J].Stroke,1998,29(8):1708-1713.
[8]Jagadeesha DK,Lindley TE,Deleon J,et al.Tempol therapy attenuates medial smooth muscle cell apoptosis and neointima formation after balloon catheter injury in carotid artery of diabetic rats[J].Am J Physiol Heart Circ Physiol,2005,289(3):H1047-1053.
[9]Schober A,Zernecke A,Liehn EA,et al.Crucial role of the CCL2/CCR2 axis in neointimal hyperplasia after arterial injury in hyperlipidemic mice involves early monocyte recruitment and CCL2 presentation on platelets[J].Circulation research,2004,95(11):1125-1133.
[10]Zernecke A,Liehn EA,Fraemohs L,et al.Importance of junctional adhesion molecule-A for neointimal lesion formation and infiltration in atherosclerosis-prone mice[J].Arteriosclerosis,thrombosis,and vascular biology,2006,26(2):e10-13.
[11]Liao SJ,Lin L,Zeng JS,et al.Endothelium-targeted transgenic GTP-cyclohydrolase I overexpression inhibits neointima formation in mouse carotid artery[J].Clin Exp Pharmacol Physiol,2007,34(12):1260-1266.
[12]Brott TG,Hobson RW,Howard G,et al.Stenting versus endarterectomy for treatment of carotid-artery stenosis[J].N Engl J Med,2010,363(1):11-23.
[13]Fluri F,Hatz F,Voss B,et al.Restenosis after carotid endarterectomy: significance of newly acquired risk factors[J].Eur J Neurol,2010,17(3):493-498.
[14]Imanishi T,Moriwaki C,Hano T,et al.Endothelial progenitor cell senescence is accelerated in both experimental hypertensive rats and patients with essential hypertension[J].J Hypertens,2005,23(10):1831-1837.
[15]Kido M,Ando K,Onozato ML,et al.Protective effect of dietary potassium against vascular injury in salt-sensitive hypertension[J].Hypertension,2008,51(2):225-231.
[16]Shiba Y,Takahashi M,Yoshioka T,et al.M-CSF accelerates neointimal formation in the early phase after vascular injury in mice: the critical role of the SDF-1-CXCR4 system[J].Arterioscler Thromb Vasc Biol,2007,27(2):283-289.
[17]Milovanova TN,Bhopale VM,Sorokina EM,et al.Lactate stimulates vasculogenic stem cells via the thioredoxin system and engages an autocrine activation loop involving hypoxia-inducible factor 1[J].Mol Cell Biol,2008,28(20):6248-6261.
[18]Kuwahara F,Kai H,Tokuda K,et al.Hypoxia-inducible factor-1alpha/vascular endothelial growth factor pathway for adventitial vasa vasorum formation in hypertensive rat aorta[J].Hypertension,2002,39(1):46-50.
[19]Pialoux V,Mounier R,Brown AD,et al.Relationship between oxidative stressand HIF-1 alpha mRNA duringsustained hypoxia in humans[J].Free Radic Biol Med,2009,46(2):321-326.
