新型大麻制剂O-1602和大麻二酚对LPS导致的啮齿动物小肠运动紊乱的影响*
2012-09-14林旭红李永渝冯雅静曹明华冯佳燕余良英
林旭红, 李永渝, 冯雅静, 曹明华, 徐 菁, 李 琨, 冯佳燕, 余良英
(同济大学医学院病理生理教研室,同济大学消化系统疾病研究所,上海200092)
大麻类物质包括植物大麻或其提取物,在治疗胃肠道疾病方面具有悠久的历史,但由于精神方面的副作用,限制了它们的应用。近10年来,随着实验研究的不断深入,大麻类物质药理效应的生物化学基础已逐渐得到认识,不少作用专一、副作用小的大麻类新制剂不断被研制出来。目前已报道的大麻制品有60多种,它们与内源性大麻素(cannabinoid,CB)一样,主要通过大麻素1型(cannabinoid-1,CB1)受体和大麻素2型(cannabinoid-2,CB2)受体介导,发挥对胃肠运动、免疫功能、食欲控制、上皮生长和再生的调控作用,其中CB受体在胃肠运动调节方面的作用已得到广泛认可[1-3],本实验室前期研究也发现,CB1受体参与生理及病理生理条件下大鼠、小鼠胃肠道运动功能的调节,CB2受体调控胃肠道运动仅限于胃肠道的某些区域或某些疾病状态[4]。
随着对大麻制剂研究的不断深入,最近在哺乳类发现一种与CB1和CB2受体具有同源序列[5-6]、并表达与CB配体结合的关键氨基酸的G蛋白偶联受体 55(G-protein-coupled receptor 55,GPR55),它能被一些 CB配体激活[7-8],因此认为 GPR55是一种新的CB受体。针对这种新的CB受体的配体大麻二酚(cannabidiol,CBD)和O-1602是2种典型的非精神性新型大麻制剂,它们的毒副作用小,具有一定的抗炎作用,但与胃肠运动的关系仍不清楚。本文通过在体与离体实验研究,探讨O-1602和CBD对脂多糖(lipopolysaccharide,LPS)诱导的大鼠、小鼠小肠运动功能紊乱的影响;在此基础上,用Western blotting检测GPR55蛋白表达情况,ELISA法测定血清肿瘤坏死因子(tumor necrosis factor α,TNF-α)及白细胞介素6(interleukin 6,IL-6)水平,采用传统的细胞内微电极技术观察O-1602和CBD对平滑肌细胞膜电位的影响,用定磷法测定平滑肌组织Ca2+-ATP酶(Ca2+-ATPase)的活性,旨在阐明其作用机制,为其可能的开发应用提供理论依据和实验依据。
材料和方法
1 在体实验
1.1 动物及分组 8~10周C57BL小鼠(18~20 g)36只,雌雄各半,购自第二军医大学动物中心。实验前禁食不禁水12 h,随机分为6组:对照组、感染性肠紊乱组、CBD组、O-1602组、CBD+LPS组和O-1602+LPS组。参照Li等[4]的方法制备感染性肠运动紊乱模型,即小鼠腹腔注射LPS组400 μg/kg。对照组以等体积生理盐水代替LPS,CBD+LPS组和O-1602+LPS组在造模前10 min腹腔分别注射1 mg/kg CBD和1 mg/kg O-1602。
1.2 小鼠上消化道转运功能测定 参照前期实验方法[4]检测不同处理组小鼠小肠的排推功能。即:单独注射药物30 min或合用LPS后,小鼠每10 g体重灌胃0.1 mL碳末悬液。灌胃后20min颈椎脱臼处死动物,马上移除幽门至盲肠段小肠,测量碳末移行的距离,计算碳末占整个小肠的百分比,结果表示为各组小肠排推率占对照组的百分比。同时心脏取血,离心取血清,留取回肠迅速投入-80℃冰箱备用。
1.3 Western blotting法测定小鼠小肠GPR55蛋白含量 取小鼠回肠组织加入蛋白裂解液[组成:HEPES 25 mmol/L(pH 7.5),EDTA 1 mmol/L,NaCl 150 mmol/L,MgCl210 mmol/L,PMSF 1 mmol/L,加入1%乙基苯基聚乙二醇(Nonidet P-40,NP-40),2%甘油(glycerol),10 mg/L抑肽酶(aprotinin)],匀浆,充分裂解后离心取上清液,检测样品蛋白浓度(BCA,上海申能博彩)。等浓度样品加入5×上样缓冲液(碧云天生物技术研究所),95℃煮沸10 min使蛋白变性。将样品(40 μg蛋白)在4%~10%Tris-SDS-PAGE胶中电泳1.5 h,转移到硝酸纤维素膜上,5%脱脂牛奶封闭1 h,滴加GPR55多克隆抗体(1∶500 稀释,Caymen Chemical),4 ℃孵育过夜,滴加羊抗兔IgG-HRP(1∶1 000稀释,艾比玛特生物医药上海有限公司),室温孵育 1 h,用 ImageQuant LAS4000 Mini化学发光成像分析仪检测蛋白条带,内参照用β-actin单克隆抗体(1∶1 000稀释,Sigma)检测。
1.4 血清TNF-α和IL-6水平检测 按ELISA试剂盒(R&D)说明书步骤操作。
2 离体实验
2.1 动物及分组 在自发性收缩实验(200~250 g雄性SD大鼠36只,购自中科院上海动物中心)、电刺激诱导的收缩实验(18~20 g C57BL小鼠36只,购自Charles River)、膜电位实验(18~20 g雄性ICR小鼠36只,购自中科院上海动物中心)和Ca2+-AT-Pase测定实验(18~20 g雄性ICR小鼠36只,购自中科院上海动物中心)中各随机分为6大组:对照组、感染性肠运动紊乱组、CBD组(10-9mol/L~10-7mol/L)、O-1602组(10-9mol/L~10-7mol/L)、CBD+LPS(10-9mol/L~10-7mol/L)组和O-1602+LPS组(10-9mol/L~10-7mol/L)。
2.2 器官浴槽记录大鼠回肠自发性收缩 大鼠禁食12 h,麻醉下颈椎脱臼处死,迅速取出近端回肠,参照Bashashati等[9]的方法制备回肠肌条。肌条在1 g的前负荷下收缩,标本至少稳定60 min(每隔15 min用新鲜37℃ Kreb’s液冲洗肌条)后开始实验。
待肌条自发收缩活动平稳后开始向浴槽内加药,包括单独加 LPS,再进行O-1602(10-9mol/L、10-8mol/L 和 10-7mol/L)或 CBD(10-9mol/L、10-8mol/L和10-7mol/L)分别与LPS(1.5 mg/L)共孵育的研究(非累积性给药),观察肌条收缩情况的变化。每种药物浓度观察20 min,再加入下一个浓度。实验结束时,加入10-4mol/L乙酰胆碱(acetylcholine,ACh)检测组织反应性,选择反应良好的肌条进行统计。用SMUP-E4生物电信号处理系统(上海嘉龙教学仪器厂)记录组织收缩情况,以加药前5 min作为对照反应,结果表示为加药后15~20 min内平滑肌收缩活动平均振幅的变化(g)。
2.3 小鼠电刺激诱导的收缩活性 回肠肌条制备同上,肌条的一端固定于肌槽底部与电极夹相连的挂钩上,另一端穿过2个相距0.6 cm的环形铂电极,以丝线连接张力换能器。标本平衡后开始进行电刺激,分别选 1 Hz、2 Hz、5 Hz、10 Hz、20 Hz 和 50 Hz,刺激参数为:每种频率连续2次用恒定电压脉冲40 V、0.5 ms刺激,每5 min一次,每次持续10 s。加药方法同前,平滑肌收缩变化用Hellige耦合器和放大器(Orbeco-Hellige)放大,用Spike软件记录。加药前连续3次电刺激诱导的收缩均值作为对照反应,结果表示为加药后15~20 min内平滑肌收缩活动平均振幅的变化(g)。
2.4 小鼠回肠平滑肌细胞膜电位及慢波的记录同上处死小鼠取出小肠,在碳酸氢盐缓冲液中沿肠系膜侧剪开小肠。在体视显微镜下去除粘膜层,制备空肠平滑肌组织(2 mm宽,5 mm长),将组织固定于硅胶板,置于组织浴槽底部,孵育在37℃ Kreb’s液,充以氧气和二氧化碳,以2 mL/min的速度持续灌流,稳定2 h。采用传统的细胞内微电极技术记录平滑肌细胞细胞内电反应[10]包括膜电位(membrane potential,Em)和慢波。具体方法如下:将尖端直流阻抗为50~80 MΩ,充满0.5 mol/L KCl的玻璃微电极[外直径1.5 mm,内直径0.84 mm,拉制参数:加热温度(heater)9.25,亚磁力(megnet)6,磁力(main megnet)9]固定在微电极操纵器上,调节操纵器,将电极尖端推进至标本表面,刺入细胞,记录电反应,所记录的慢波电位通过高输入阻抗放大器放大信号。在获得小鼠小肠平滑肌细胞基础膜电位活动后,在灌流液中加入不同浓度的O-1602、CBD或LPS,或LPS与以上大麻制剂同用,观测其对膜电位活动及慢波的影响。
2.5 小鼠回肠平滑肌组织Ca2+-ATPase测定 同上制备小鼠平滑肌肌条,精确称重组织,以0.9%生理盐水稀释制成10%匀浆,分别于250 μL回肠平滑肌组织匀浆液中加入各组药物,使CBD和O-1602终浓度分别为10-7mol/L、10-8mol/L和10-9mol/L,LPS终浓度为1.5 mg/L。反应2 min后,加入2.5%戊二醛100 μL,终止反应,根据预试结果,样本稀释10倍进行酶促反应,检测 Ca2+-ATPase(南京建成生物科技有限公司),具体操作按说明书进行。同时用BCA蛋白定量试剂盒(上海申能博彩)测定组织蛋白浓度。以每小时每毫克组织蛋白中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位[即 mmolPi·(g protein)-1·h-1],公式:ATPase 活力[103U·(g protein))-1]=[(测定管A值-对照管A值)/(标准管A值-空白管A值)]×标准管浓度(0.02 mmol·L-1)×6×10/蛋白浓度(g protein·L-1)。
3 统计学处理
应用SPSS 11.5统计软件分析,数据以均数±标准误(¯±sE)表示,先用Levene方法进行方差齐性检验,若样本所来自总体符合方差齐性要求,则对其进行单因素方差分析(ANOVA),随后再进行Dunnett’s检验分析;若样本所来自总体的方差不齐,采用非参数检验(Kruskal-Wallis检验)。以P<0.05为差异有统计学意义。
结 果
1 小鼠小肠排推功能的改变
对照组小鼠小肠推进率为100%,O-1602和CBD腹腔注射均不影响正常小鼠上消化道转运,而LPS非常显著减慢上消化道转运(74.2% ±3.6%,P<0.05),说明在感染状态下,胃肠传输功能明显下降,表现为传输速度较正常组显著减慢。CBD预处理明显逆转LPS导致的上消化道转运减慢(124.5%±9.4%,P<0.05),见表1,O-1602未发挥明显的拮抗效应。
表1 O-1602或CBD对小鼠上消化道转运功能的影响Table 1.Effect of O-1602 or CBD on upper gastrointestinal(GI)transit in mice(%.±sE.n=6)

表1 O-1602或CBD对小鼠上消化道转运功能的影响Table 1.Effect of O-1602 or CBD on upper gastrointestinal(GI)transit in mice(%.±sE.n=6)
*P<0.05 vs control group;#P<0.05 vs LPS group.
Treatment Upper GI transit Control 100.0±6.5 CBD 102.2±7.0 O-1602 106.2±4.5 LPS 66.6±3.6*CBD+LPS 116.7±9.4#O-1602+LPS 89.5±3.9
2 小鼠回肠组织中GPR55蛋白的表达
与未处理组比较,O-1602和CBD单独应用均不影响小鼠回肠GPR55蛋白表达,腹腔注射LPS后,回肠组织GPR55蛋白表达水平明显增高(P<0.01),CBD预处理显著降低LPS导致的GPR55表达的升高(P<0.01),O-1602对LPS的效应则无明显作用,见图1。
3 血清TNF-α和IL-6水平的变化
如图2所示,腹腔注射LPS后,小鼠血清TNF-α和IL-6水平明显升高(P<0.01),提示LPS处理后促炎机制被激活。同时,我们发现O-1602对2种细胞因子水平均无明显影响(P>0.05),CBD拮抗LPS导致的大鼠血清IL-6水平升高(P<0.01),但不影响TNF-α水平(P>0.05)。

Figure 1.Effect of O-1602 or CBD on the expression of GPR55 protein in mice ileum.±sE.n=6.**P<0.01 vs control;##P<0.01 vs LPS group.图1 O-1602或CBD对小鼠回肠GPR55蛋白表达的影响

Figure 2.Effect of CBD or O-1602 on the levels of TNF-α(A)and IL-6(B)in serum of mice.±sE.n=6.**P<0.01 vs control;##P<0.01 vs LPS.图2 CBD或O-1602对小鼠血清TNF-α和IL-6的影响
4 大鼠回肠自发性收缩活动的变化
10-9mol/L和10-8mol/L O-1602均不影响回肠收缩,而10-7mol/L O-1602明显抑制回肠自发性收缩,与对照组相比,下降至67.9% ±8.7%,P<0.05,见图3A,但对LPS抑制回肠收缩无明显作用。单独应用LPS抑制大鼠回肠自发性收缩,与对照组相比,下降至59.5%±7.4%,P<0.01,见图3B。
CBD对正常肌条自发性收缩无明显影响,但LPS造模前、后10 min应用CBD(剂量为10-9mol/L、10-8mol/L、10-7mol/L)可阻断 LPS对回肠自发性收缩的效应,即逆转LPS对回肠收缩的抑制,从LPS组59.5% ±7.4%分别升高至79.7% ±6.1%,P<0.05;99.1% ±3.7%,P<0.01;96.3% ±8.3%,P<0.01,见图3B。
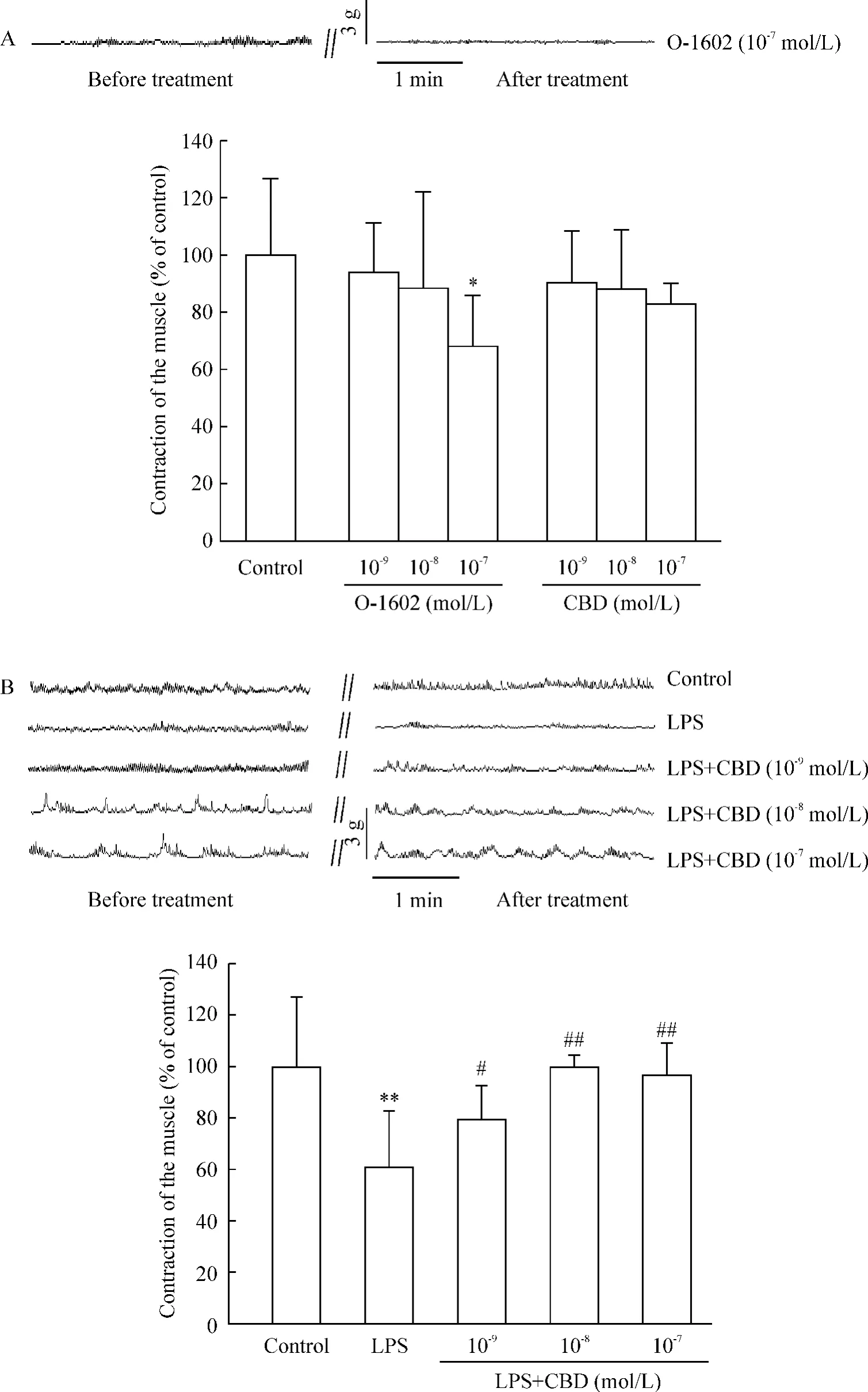
Figure 3.Effect of O-1602 on the spontaneous contraction of the isolated rat uleum(A)and effect of CBD on LPS-induced contraction disturbances in the isolated rat ileum(B).±sE.n=6.*P<0.05,**P<0.01 vs control,#P<0.05,##P<0.01 vs LPS.图3 O-1602对大鼠回肠自发性收缩的影响和CBD对LPS导致的大鼠回肠收缩紊乱的影响
5 电刺激诱导的小鼠回肠收缩的变化
电刺激引起小鼠回肠规律性的相位性收缩,随着刺激频率的增高,收缩振幅逐渐升高,10 Hz~20 Hz刺激时变化最明显,至50 Hz时达到最大收缩,见图4。我们选用10 Hz作为后续研究的基础。单独应用O-1602使收缩幅度分别降至86.6%±11.7%、82.2%±9.0%和76.9%±10.3%(P>0.05,P>0.05,P<0.05),但CBD不影响这种收缩活动,见图5。而模型组失去这种收缩模式,肠蠕动明显加速,见图6,LPS组在用药后5 min时收缩力即开始升高,而且收缩的改变随时间延长而明显,至30 min时与对照组比,升至179.0%±12.7%(P<0.01)。如图6所示,O-1602加入LPS预处理的回肠肌条孵育后,在有效浓度范围内呈浓度依赖性抑制LPS对肠段收缩的促进作用(167.9% ±18.1%,P<0.05;150.1%±16.7%,P<0.01;142.3%±15.5%,P<0.01);CBD对LPS导致的胃肠运动紊乱的影响与O-1602类似,其对肠段收缩的抑制程度分别为156.5%±13.2%(P<0.01)、156.3%±12.0%(P<0.01)和153.2% ±10.9%(P<0.01)。
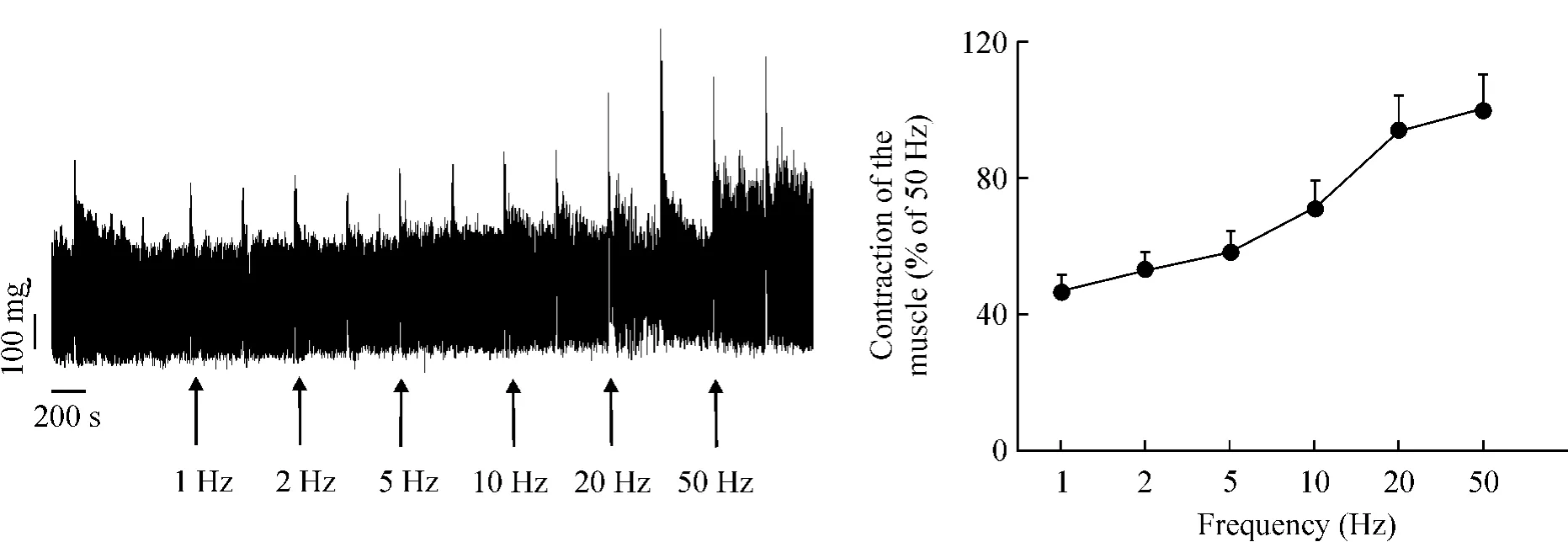
Figure 4.Electrically-evoked frequency-dependent contraction of mouse ileum.±sE.n=6.图4 电刺激诱导的小鼠回肠频率依赖性收缩
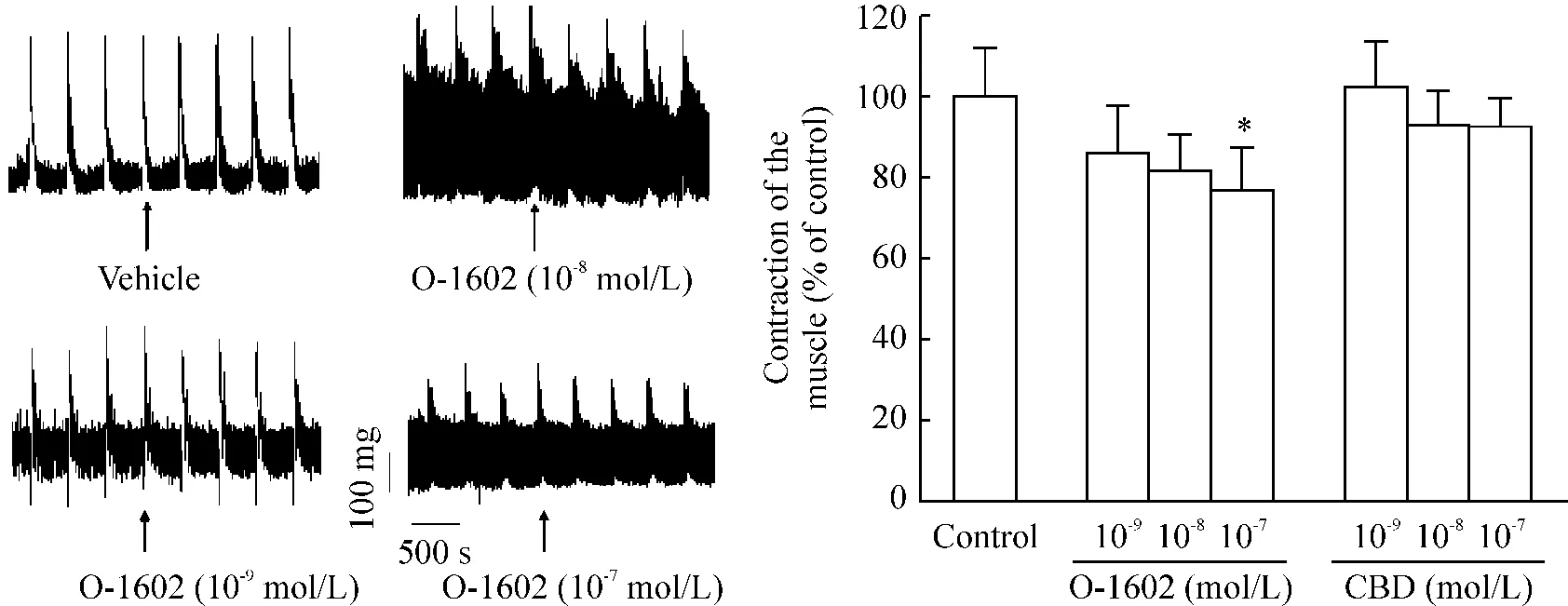
Figure 5.Effect of O-1602 or CBD on electrically-evoked(10 Hz)contraction of mouse ileum.±sE.n=6.*P<0.05 vs control.图5 O-1602或CBD对10 Hz电刺激诱导的小鼠回肠收缩的影响
6 小鼠回肠平滑肌细胞膜电位及慢波的变化
各浓度的O-1602和CBD对小鼠回肠平滑肌细胞膜电位无明显影响(P>0.05),慢波振幅也没有显著改变(P>0.05);在LPS处理的回肠组织,O-1602和CBD对降低的平滑肌细胞膜电位均无明显作用(P>0.05)。
7 小鼠回肠平滑肌组织Ca2+-ATPase活性的变化
如图7所示,正常小鼠平滑肌组织Ca2+-ATPase活性为(4.7±0.6)×103U· (g protein)-1,高浓度(10-7mol/L)O-1602明显增强平滑肌组织肌浆网Ca2+-ATPase活性[(17.6±1.4)×103U· (g protein)-1,P<0.01],而各浓度CBD 均不影响 Ca2+-ATPase活性;LPS处理后,其平滑肌组织 Ca2+-ATPase活性显著增强[(29.7±6.9)×103U·(g protein)-1,P<0.01],单独以各浓度CBD预处理后,10-8mol/L和10-7mol/L均可逆转LPS对平滑肌组织Ca2+-ATPase活性的升高效应,与LPS组相比,差异显著[分别为(16.4±5.9)×103U·(g protein)-1和(14.6±3.5)×103U·(g protein)-1,P <0.05]。O-1602对LPS升高平滑肌细胞Ca2+-ATPase活性的作用无明显影响(P>0.05)。

Figure 6.Effect of O-1602 or CBD on LPS-induced electrically-evoked contraction disorder of mouse ileum. ± sE.n=6.**P <0.01 vs control;#P <0.05,##P <0.01 vs LPS.图6 O-1602或CBD对LPS诱导的小鼠回肠电刺激收缩紊乱的影响
讨 论
胃肠道(gastrointestine,GI)运动紊乱发生于多种情况,是多种不同病因和发病机制所导致的一系列疾病的共同表现,尤其是炎症相关GI疾病引起的小肠运动紊乱,常导致GI内过度增殖的肠道病原菌释放肠毒素,由此加重GI运动紊乱。因此对其发病机制的探究及有效治疗药物的寻求一直是这一领域的热点课题。
在体LPS模型被经常用来作为大、小鼠感染性肠运动紊乱模型[11],我们在前期工作的基础上,采用400 μg/kg腹腔注射复制小肠运动紊乱模型,结果表明,小鼠小肠运动明显受损,表现为上消化道转运功能明显抑制。多项研究[12-14]表明,电刺激导致肌肉稳定的单相收缩,这种收缩反应是由胆碱能和神经介导的由乙酰胆碱从肠神经释放引起的,因为这种反应被阿托品和河豚毒素完全阻断,通过观察体外小鼠回肠与LPS共孵育时平滑肌收缩振幅的改变,我们发现在10 Hz刺激频率下,LPS明显促进小鼠回肠平滑肌收缩,这一效应发生快,并有明显的时间依赖性,至30min时达到高峰,这在 Duncan等[12]和Bashashati等[9]的研究中得到证实。而在自发性收缩的研究中,相同浓度的LPS明显抑制大鼠回肠平滑肌收缩,说明不同收缩方式对LPS显示不同的反应。较多研究认为,LPS导致肠运动紊乱的机制主要涉及促炎介质损伤肌肉收缩和/或降低肌层神经丛神经递质释放[15-17],LPS通过激活肠肌层及肠外肌层大量巨噬细胞,分泌众多细胞因子和炎症介质,进一步影响胃肠道运动,本实验中也见到LPS处理的小鼠血清TNF-α和IL-6水平明显升高。
研究表明,多种CB制剂可用来治疗胃肠道动力相关疾病,并主要通过CB1、CB2受体发挥作用,但由于其同时激活脑内CB1受体引起精神作用,限制了它们在临床的应用。在过去的几年中,大麻类物质对GPR55的药理作用已得到深入研究,然而还存在争议[18],并且没有充足证据证明位于肠道的GPR55的功能。本课题组前期研究发现,GPR55 mRNA在大鼠十二指肠、回肠和结肠均有表达,且回肠量最多,免疫组织化学结果显示GPR55主要存在于大鼠十二指肠、回肠和结肠肌层神经丛[19],本实验中也观察到,小鼠回肠也有GPR55表达,有趣的是,在小鼠炎症肠道,GPR55表达在蛋白水平明显上调,提示炎症时GPR55受体激活,可能参与病理状态下胃肠功能(包括运动功能)的调节,这一发现与经典CB受体相似[20]。CBD为植物大麻中研究得最透彻的非精神性生物活性成分,是GPR55受体拮抗剂,近年发现也有反向激动的作用;而O-1602是人工合成的CBD类似物,作为潜在的GPR55激动剂,在某些病理过程中均发挥重要作用。本研究发现,单独应用O-1602和CBD不影响GPR55表达,在LPS导致的炎症肠道,CBD明显降低GPR55蛋白表达,同时有效降低小鼠血清IL-6水平,这与我们课题组的另一项胰腺炎研究中得到的结果相吻合[21],提示CBD在体内通过抗炎机制改善小肠运动。
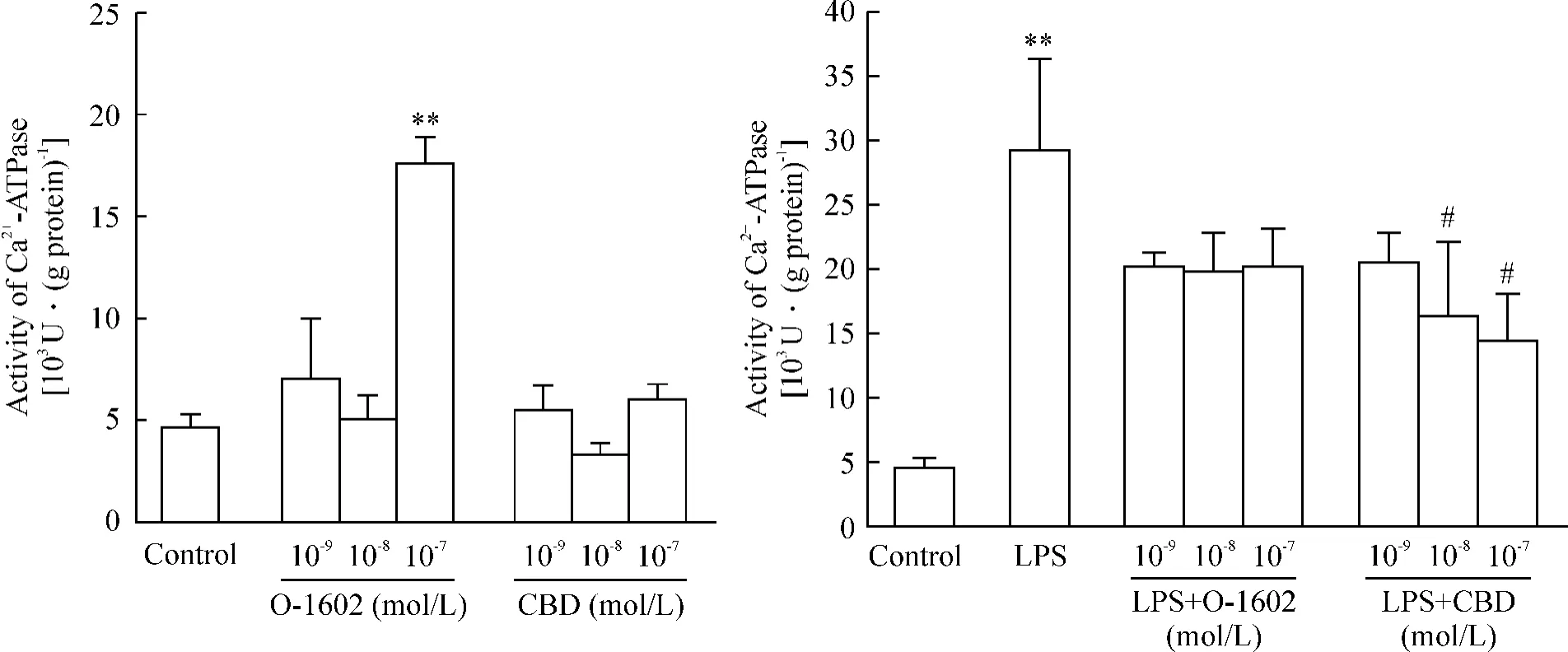
Figure 7.Effects of O-1602,CBD and LPS on the activity of Ca2+-ATPase in smooth muscle tissues.±sE.n=6.**P<0.01 vs control;#P<0.05 vs LPS.图7 O-1602、CBD和LPS对平滑肌组织Ca2+-ATPase活性的影响
胃肠道平滑肌是胃肠道动力的核心单位,各种因素最终都要通过胃肠道平滑肌来发挥调控胃肠道动力的作用,体外实验中我们发现,各浓度的CBD对10Hz电刺激诱导的收缩无明显影响,在LPS导致的10Hz电刺激收缩紊乱模型,CBD预处理可以逆转LPS的效应,这与文献报道的CBD抗痉挛作用一致[22]。而在自发性收缩的研究中,CBD对正常肌条自发性收缩无明显影响,在剂量为10-9mol/L、10-8mol/L和10-7mol/L时阻断LPS对回肠自发性收缩的效应,即逆转LPS对回肠收缩的抑制,提示CBD对病理肠道发挥双向调节作用,主要取决于病理肠道的状态。O-1602(10-7mol/L)抑制小鼠回肠平滑肌电刺激引起的收缩幅度,并在一定程度拮抗LPS引起的电刺激收缩的加强,但不影响病理状态下回肠自发性收缩。这表明,在正常大、小鼠,CBD不改变回肠收缩活性,也不改变胆碱能运动功能;病理状态下,CBD不仅改变平滑肌收缩活性,而且改变胆碱能运动功能。高浓度的O-1602可以改变正常小肠平滑肌的收缩活性,又可通过突触前GPR55抑制胆碱能运动功能;在病理状态下,O-1602可通过抑制胆碱能运动功能,减轻LPS导致的小肠运动紊乱。
胃肠道平滑肌细胞膜电位是影响平滑肌反应性,进而改变其舒缩活动的主要因素,前期实验中我们发现针对经典CB1和CB2受体的相关CB制剂对小肠运动功能的影响与平滑肌细胞膜电位之间有一定联系。为了进一步明确O-1602和CBD对小肠运动的作用机制,我们观察了二者对小肠平滑肌细胞膜电位和慢波的影响,结果发现,O-1602和CBD这两种新制剂在生理及病理生理状态下对平滑肌细胞内的电变化均无明显影响,说明它们与经典CB受体的配体作用机制有所不同,其胃肠动力效应可能不包括平滑肌细胞膜电位的改变,这一结论需要进一步测定电压依赖性钙通道(voltage-dependent calcium channel,VDCC)等离子通道电流加以确定。
对平滑肌收缩来说,需要有起细胞的兴奋、传导、电-机械偶联等多个环节。Ca2+浓度是平滑肌收缩反应中的关键因素。Ca2+-ATPase存在于细胞膜及内质网/肌浆网上,是肌浆网中含量最丰富的蛋白,对建立跨膜的离子梯度,维持细胞膜电位、正常细胞生理活动和代谢,具有重要作用,是调节钙稳态的最重要物质,平滑肌细胞舒张期胞浆内Ca2+浓度下降的70%~90%的钙离子是通过它回摄取的,因此,可以将肠道组织Ca2+-ATPase活力作为肠道能量代谢及功能损伤的重要指标。为了明确O-1602和CBD的作用途径,我们测定了平滑肌组织Ca2+-ATPase的活性,结果发现,LPS和高浓度的O-1602均能明显增强小鼠空肠平滑肌组织Ca2+-ATPase活性,从而增加Ca2+经细胞内向胞外的转运,达到减少胞内Ca2+、抑制平滑肌收缩的效应;而CBD单独应用对平滑肌组织Ca2+动员无明显影响,但可以拮抗LPS导致的Ca2+-ATPase活性的增强。以上结果与最近的一项CBD在神经系统通过调节钙稳态,介导神经保护的研究结果相似[23]。在本实验条件下,低剂量O-1602不动员胞内Ca2+,在高浓度时显示抑制Ca2+的效应,但对LPS导致的Ca2+-ATPase活性升高没有影响,这与其对回肠肌条自发性收缩的结果一致。以上结果表明,O-1602和CBD对Ca2+-ATPase活性的调节可能是影响回肠平滑肌自发性收缩的机制之一。
总之,我们的结果表明,在体内,CBD通过抗炎作用有效改善小肠运动;在体外,O-1602和CBD选择性拮抗LPS导致的小肠运动紊乱,其机制不是通过改变平滑肌细胞膜电位,而可能与其调节Ca2+-ATPase活性有关。
[1] Pinto L,Izzo AA,Cascio MG,et al.Endocannabinoids as physiological regulators of colonic propulsion in mice[J].Gastroenterology,2002,123(1):227-234.
[2] Hornby PJ,Prouty SM.Involvement of cannabinoid receptors in gut motility and visceral perception[J].Br J Pharmacol,2004,141(8):1335-1345.
[3] Pinto L,Capasso R,Di Carlo G,et al.Endocannabinoids and the gut[J].Prostaglandins Leukot Essent Fatty Acids,2002,66(2-3):333-341.
[4] Li YY,Li YN,Ni JB,et al.Involvement of cannabinoid-1 and cannabinoid-2 receptors in septic ileus[J].Neurogastroenterol Motil,2010,22(3):350-357,e88.
[5] Brown AJ,Wise A.Identication of modulators of GPR55 activity:USA,WO2001086305[P].2003-06-19.
[6] Drmota T,Greasley P,Groblewski T.Screening assays for cannabinoid-ligand type modulators of GPR55:USA,WO2004074844[P].2006-08-31.
[7] Brown AJ,Ueno S,Suen K,et al.Molecular identification of GPR55 as a third G protein-coupled receptor responsive to cannabinoid ligands[C]∥International Cannabinoid Research Society.Symposium on the Cannabinoids,Burlington,Vermont,USA,2005:16.
[8] Sjögren S,Ryberg E,Lindblom A,et al.A new receptor for cannabinoid ligands[C]∥International Cannabinoid Research Society.Symposium on the Cannabinoids,Burlington,Vermont,USA,2005:106.
[9] Bashashati M,Storr MA,Nikas SP,et al.Inhibiting fatty acid amide hydrolase normalizes endotoxin-induced enhanced gastrointestinal motility in mice[J].Br J Pharmacol,2012,165(5):1556-1571.
[10] Kim YC,Suzuki H,Xu WX,et al.Voltage-dependent Ca2+current identified in freshly isolated interstitial cells of Cajal(ICC)of guinea-pig stomach[J].Korean J Physiol Pharmacol,2008,12(6):323–330.
[11] Schwarz NT,Engel B,Eskandari MK,et al.Lipopolysaccharide preconditioning and cross-tolerance:the induction of protective mechanisms for rat intestinal ileus[J].Gastroenterology,2002,123(2):586-598.
[12] Duncan M,Mouihate A,Mackie K,et al.Cannabinoid CB2receptors in the enteric nervous system modulate gastrointestinal contractility in lipopolysaccharide-treated rats[J].Am J Physiol Gastrointest Liver Physiol,2008,295(1):G78-G87.
[13] Storr MA,Bashashati M,Hirota C,et al.Differential effects of CB1neutral antagonists and inverse agonists on gastrointestinal motility in mice[J].Neurogastroenterol Motil,2010,22(7):787-796,e223.
[14] Jamontt JM,Molleman A,Pertwee RG,et al.The effects of Δ9-tetrahydrocannabinol and cannabidiol alone and in combination on damage,inflammation and in vitro motility disturbances in rat colitis[J].Br J Pharmacol,2010,160(3):712-723.
[15] Collins SM.The immunomodulation of enteric neuromuscular function:implications for motility and inflammatory disorders[J].Gastroenterology,1996,111(6):1683-1699.
[16] Jacobson K,McHugh K,Collins SM.The mechanism of altered neural function in a rat model of acute colitis[J].Gastroenterology,1997,112(1):156-162.
[17] Kinoshita K,Hori M,Fujisawa M,et al.Role of TNF-α in muscularis inflammation and motility disorder in a TNBS-induced colitis model:clues from TNF-α-deficient mice[J].Neurogastroenterol Motil,2006,18(7):578-588.
[18] Pertwee RG.GPR55:a new member of the cannabinoid receptor clan?[J].Br J Pharmacol,2007,152(7):984-986.
[19] Lin XH,Yuece B,Li YY,et al.A novel CB receptor GPR55 and its ligands are involved in regulation of gut movement in rodents[J].Neurogastroenterol Motil,2011,23(9):862-870,e342.
[20] Di Marzo V,Izzo AA.Endocannabinoid overactivity and intestinal inflammation[J].Gut,2006,55(10):1373-1376.
[21] 冯佳燕,李 琨,林旭红,等.新型大麻制剂O-1602和CBD减轻小鼠实验性急性胰腺炎的机制研究[J].中国病理生理杂志,2011,27(3):539-544.
[22] Carlini EA,Cunha JM.Hypotonic and antiepileptic effects of cannabidiol[J].J Clin Pharmacol,1981,21(Suppl 8-9):417S-427S.
[23] Ryan D,Drysdale AJ,Lafourcade C,et al.Cannabidiol targets mitochondria to regulate intracellular Ca2+levels[J].J Neurosci,2009,29(7):2053-2063.
