陈皮饮片高效液相指纹图谱研究*
2012-09-14封宇飞张宏武邹忠梅孙春华
封宇飞,张宏武,邹忠梅,孙春华
(1.卫生部北京医院药学部,北京 100730;2.中国医学科学院·中国协和医科大学药用植物研究所,北京100094)
陈皮(Pericarpium Citri Reticulatae)为芸香科植物橘(Citrus reticulate Blanco)及其栽培变种的干燥的成熟果实,原名“橘皮”,性温,味苦、辛,有理气健脾、燥湿化痰等功效,临床上用于胸脘胀满、食少吐泻、咳嗽痰多等症。现代药理学研究表明,陈皮具有升压、抗肿瘤、抗炎、抗菌、降血脂、抗过敏和抗哮喘等作用[1-3]。2005年版《中国药典(一部)》中,采用性状鉴别的定性手段和单一指标成分橙皮苷的定量测定来控制陈皮的质量。另外,有文献报道对陈皮中的挥发油、生物碱(如辛弗林)及黄酮类化合物如橙皮苷和川陈皮素等进行含量测定[4-8]。虽然这些方法能够在一定程度上控制陈皮饮片的质量,但难于客观、有效的评价或控制药材的质量。而中药指纹图谱研究作为现代中药质量控制和鉴别的新兴技术,为质量评价问题的解决提供了新的思路和方法。目前,指纹图谱已成为国际上公认的控制中药或天然药物质量的最有效的手段。美国食品与药物管理局、英国草药典、印度草药、德国药用植物学会、加拿大药用植物学会均接受色谱指纹图谱的质控方法。其优点在于可全面反映中药复杂的化学成分及其相对比例,在大多数中药有效成分尚未阐明的现状下,仍可有效地表征中药质量[9-10]。笔者采用反相高效液相色谱法,建立可反映陈皮饮片全貌的指纹图谱,为陈皮的综合质量评价提供参考。
1 仪器与试药
Waters 2690型高效液相色谱仪(996PDA二极管阵列检测器,515泵,Empower pro工作站);梅特勒AT201型十万分之一电子天平;RT-02A小型高速粉碎机;Millipore超纯水机,Heidolph LABOROTA 4000旋转蒸发仪;中药色谱指纹图谱相似度评价系统软件(2004A,国家药典委员会)。橙皮苷对照品(中国药品生物制品检定所,含量98.3%);43批陈皮饮片采购于全国22个省市,中国医科院药用植物研究所林余霖副研究员鉴定确认,均为干燥生品(表1);乙腈为色谱纯(Fisher,美国),甲酸为分析纯,水为Milli-Q纯化系统制备的超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Symmetry C18柱(250 mm ×4.6 mm,5 μm);流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~20 min,A为 90%;20~35 min,A 为 75% ~90%;35~50 min,A 为 30% ~75%;50~60 min,A为 30% ~90%);检测波长:300 nm;流速:1.0 mL/min;柱温:25 ℃;自动进样器温度:4 ℃,进样量:10 μL。
2.2 溶液制备
精密量取橙皮苷对照品10.0 mg,置100 mL容量瓶中,加甲醇溶解,稀释并定容,作为橙皮苷对照品贮备液。精密量取对照品贮备液1 mL,置10 mL容量瓶中,加水定容至刻度,摇匀,0.22 μm微孔滤膜过滤后,作为对照品溶液。称取陈皮饮片约50.0 g,用粉碎机粉碎,过筛,精密称取10.0 g(24~65目),置250 mL平底烧瓶中,加100 mL水,水浴加热(60℃)回流提取1 h,放冷,真空过滤,药渣加入100 mL水同样操作提取2次,每次1 h,过滤,合并过滤液,减压浓缩,移至100 mL容量瓶,加水定容,为样品原液。精密量取原液1 mL,置100 mL量瓶中,加水定容至刻度,摇匀,0.22 μm微孔滤膜过滤后,作为供试品溶液。
2.3 检测方法
分别精密吸取对照品溶液和供试品溶液各10 mL,注入液相色谱仪,记录100 min内色谱图。结果表明,65 min后无有意义峰出现,故确定图谱记录时间为65 min。对照品和样品色谱图分别见图1。根据参照峰的保留时间和峰面积计算其他共有峰的相对保留时间和相对峰面积值。
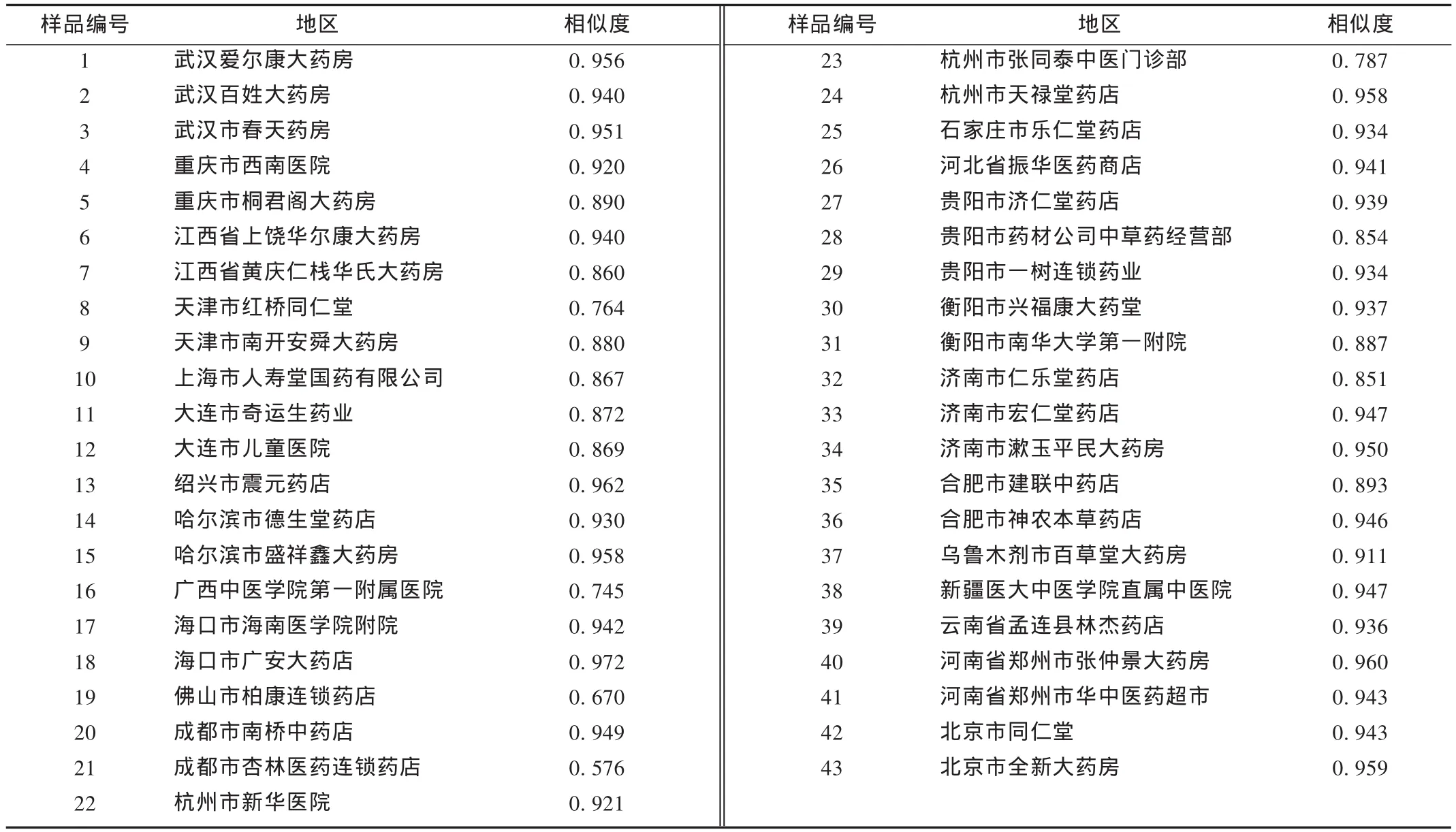
表1 陈皮样品来源及相似度计算结果

图1 高效液相色谱图
2.4 方法学考察
精密度试验:取同一供试品溶液,连续进样5次,检测指纹图谱。计算各共有色谱峰的相对保留时间和相对峰面积的 RSD值,各色谱峰的相对保留时间 RSD为0.02% ~0.41%,色谱峰的相对峰面积的 RSD为0.75% ~1.36%。精密度试验符合指纹图谱研究技术的要求。
稳定性试验:取同一批供试品溶液,按照上述色谱条件,分别于0,6,12,18,24 h检测指纹图谱。结果其共有峰峰面积 RSD均小于2.0%,表明供试品溶液在24 h内稳定。
重复性试验:取同一批陈皮饮片5份,依法制备供试品溶液,并按照上述色谱条件分别检测指纹图谱,考察各共有峰相对峰面积,各供试品溶液的主要共有峰的相对峰面积 RSD均小于5%。结果表明,该方法的重现性良好。
2.5 样品测定结果
陈皮饮片指纹图谱测定:对中药陈皮饮片进行高效液相色谱指纹图谱测定分析。结合各地不同饮片的色谱峰状况,选择高效液相色谱图中可以用于反映饮片内在质量的共有峰,以参照物峰(S)的保留时间和峰面积为1,计算其余各峰的相对保留时间和相对峰面积,并计算不同饮片各个产地的高效液相色谱指纹图谱的相似性。将各地的陈皮饮片按样品制备方法制备样品,并在2.1项色谱条件下检测HPLC指纹图谱,根据不同产地样品分析的结果,标定共有峰,见图2。共有峰的峰面积占总峰面积的95%以上,非共有峰的峰面积在总峰面积中所占比例小于5%,所选择的共有峰可以较全面地反映样品中化学成分的信息。
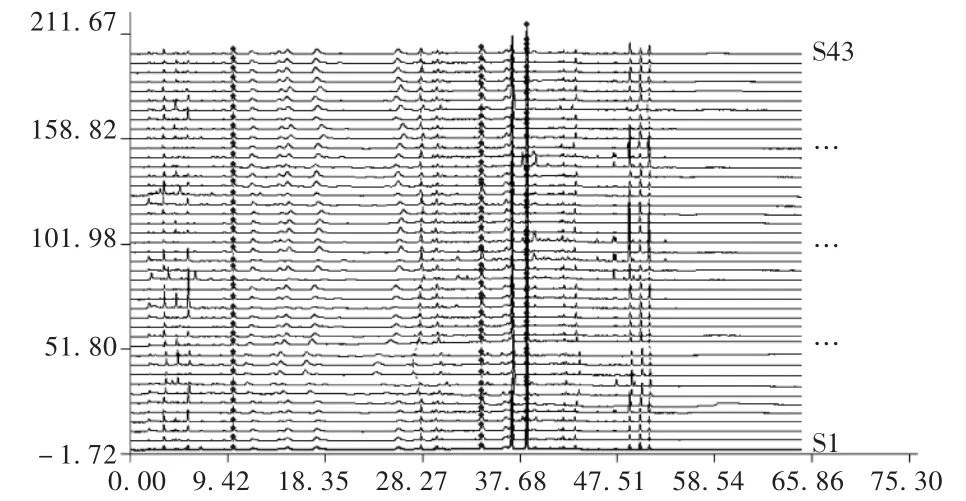
图2 43批陈皮饮片匹配后指纹图谱
陈皮饮片的指纹分析图:应用指纹图谱相似度评价软件对各地的陈皮饮片指纹图谱进行谱图比较,并对谱图校正匹配。见图2。
陈皮饮片的指纹图谱相似度计算:应用“中药色谱指纹图谱相似度评价系统研究版(2004A)”(国家药典委员会),对各地的陈皮饮片指纹图谱进行相似度计算,以相关系数表示相似度。结果38批陈皮饮片指纹图谱的相似度在0.85以上,结果见表1及图3。陈皮饮片的指纹图谱相对峰面积值计算见表2。
3 讨论
3.1 流动相选择
陈皮饮片所含成分复杂,且各种类型的化合物极性差别较大,在等度洗脱时,改变流动相的组成或比例只能得到较少的色谱峰,并且洗脱时间长,色谱峰分离度差。改梯度洗脱,样品中不同极性组分均获得了合适保留,在65 min内各组分全部出峰。试验过程中选用了多种流动相,如甲醇 -0.1%甲酸、甲醇-乙腈 -0.1%甲酸、乙腈-0.1%甲酸的不同梯度洗脱。由于醇-水系统的热力学和可压缩性因素,在梯度洗脱时易导致基线漂移;且醇-甲酸系统柱压相对较高,而乙腈相对较好,且所得指纹图谱峰数较多,故试验选取3号系统为流动相。比较了4个不同柱温,发现随柱温上升各色谱峰保留时间略有提前,但分离度以25℃为佳。故选择25℃为指纹图谱检测柱温。

图3 全国不同省市的43批市售样品的相似度分布

表2 43批样品饮片指纹图谱共有峰的相对峰面积值
3.2 波长选择
结果表明,波长300 nm检测时,其高效液相图谱中可观察到较多的色谱峰,同时各色谱峰分离较好,并且在此波长处各色谱峰的吸收均较强,故确定300 nm为检测波长。
3.3 提取方式选择
4种提取方法的提取效果可从高效液相色谱图中看出,以甲醇作为溶剂所得到的提取液,其橙皮苷的含量很高,即橙皮苷提取率很高,而从峰个数上看,其峰数很少;水回流提取液的效果却恰恰相反。加热回流较超声提取率要高。并且,传统陈皮饮片采用水煎(水提),因此,笔者采用水加热回流提取作为最佳提取方法。研究中还发现,橙皮苷、柚皮芸香苷、川陈皮素、3,5,6,7,8,3',4'-七甲氧基黄酮及红橘素不易溶于冷水,较溶于热水中。为了减少这现象给试验带来的影响,水提物应趁热滤过。
3.4 对照品选择
陈皮中含有黄酮类化合物、挥发油及生物碱等,各类成分均能在一定程度上代表陈皮的某些药理活性,其中,橙皮苷为其主要活性成分之一,同时,笔者研究发现该成分在陈皮饮片中含量最高。因此,选择橙皮苷作为对照品。
3.5 指纹图谱相似度评价
采用高效液相色谱法对陈皮饮片的指纹图谱进行了研究,各样品图谱虽存在一定差异,但均具有相同的色谱特征峰。该方法一次进样即能得到众多的色谱峰,分离分析效率高,且各色谱峰保留时间相当稳定,所建立的指纹图谱具有稳定性和可控性。
分析了全国不同省市市售43批陈皮饮片指纹图谱,共有11个特征峰,各色谱峰的保留时间匹配总体较好,保留时间 RSD均小于5%。但因样品的个体差异,特征峰的相对含量分布差异较大。样品编号为 8,16,19,21,23 的相似度在 0.576 ~0.787 之间,质量与其他大多数样品存在较大差异,建议将相似度0.85作为判定陈皮饮片合格与否的限度。结果表明,全国各地的市售陈皮饮片质量不统一,这更迫切的要求我们建立可靠的质量标准来控制药材的质量,同时也说明相似度与药材销售地相关。
[1]严寒静,房志坚,黄 宁.中药陈皮挥发油的成分分析[J].广东药学,2001,11(1):17 -18.
[2]沈明勤,叶齐下,常复蓉.陈皮水溶性生物碱的升压作用量-效关系及药动学研究[J].中国药学杂志,1997,32(2):97-100.
[3]王妹梅,何春美.陈皮提取物清除自由基和抗脂质过氧化作用[J].中国药科大学学报,1998,29(6):462 -465.
[4]俞建平,张红玉,邱静帆.HPLC法测定咳喘平中橙皮苷的含量[J].中国现代应用药学,2001,18(5):388 -389.
[5]蔡 萍,张水寒,肖 娟,等.HPLC测定湖南道地药材陈皮中橙皮苷的研究[J],中医药导报,2006,12(4):65 -67.
[6]贾晓斌,施亚芳,黄一平,等.HPLC测定苏州地区陈皮中辛弗林含量[J].南京中医药大学学报:自然科学版,1999,15(1):27-28.
[7]胡艳飞,王长海.微波法提取陈皮中 3,5,6,7,8,3',4'- 七甲氧基黄酮及其含量测定[J].烟台大学学报:自然科学与工程版,2005,18(1):45-49.
[8]廖 斌,陈钟华.离子对色谱法测定昔奈福林含量)[J].中国药科大学学报,1997,28(2):94-96.
[9]李晓蒙,何新荣.秦艽药材HPLC指纹图谱研究[J].中成药,2004,26(1):4-7.
[10]王振月,孙 晖,崔红花,等.毛脉酸模不同生长发育期HPLC色谱指纹图谱研究[J].植物研究,2005,25(1):53-58.
