利拉萘酯乳膏的制备与质量控制
2012-09-14吴亚利
吴亚利
(上海市徐汇区中心医院,上海 200031)
利拉萘酯(liranaftate)是由日本Tosoh公司和ZenyakuKogyo公司共同研制开发的角鲨烯环氧化酶抑制剂,结构与托萘酯相似,属于硫代氨基甲酸类抗浅表皮肤真菌感染药。抗真菌谱广,对包括须发癣菌在内的皮真菌有强大的抗菌活性,药效比托萘酯大10多倍,对一些致病酵母菌也有很好的活性。该药毒性小,可口服,不会产生明显的耐药性,在用药过程中不会诱导胆固醇的生物合成[1]。目前国内对本品制备的报道较少。为此,笔者根据临床需要研制了利拉萘酯乳膏,用于治疗皮肤浅部真菌病,并对此工艺下制备的产品进行了质量控制和稳定性研究。
1 仪器与试验
1100 型高效液相色谱仪(美国Agilent公司);AB204-N型电子天平(瑞士Mettler公司);DT5-6型离心机(北京医用离心机厂);HWS-80型恒温恒湿培养箱(北京中兴伟业仪器有限公司);Agilent 1100液相色谱仪(配备单元泵,VWD检测器和杭州英普2000工作站)。利拉萘酯(湖南九典制药有限公司,批号为110203,含量不低于98.5%);利拉萘酯对照品(中国药品生物制品检定所,批号为100791-200501);利拉萘酯乳膏(试制,批号分别为 20111201,20111202,20111203,规格为 20 mg/10 g);乙腈为色谱纯,磷酸二氢钾为分析纯。
2 方法与结果
2.1 处方与制备
处方:利拉萘酯20 g,硬脂酸122 g,单硬脂酸甘油酯32 g,白凡士林 9 g,液体石蜡80 g,十八醇45 g,甘油 150 g,三乙醇胺4 g,尼泊金甲酯 0.4g,纯化水加至 1 000 g。
制备工艺:取处方量的硬酯酸、单硬脂酸甘油酯、白凡士林、十八醇、液体石蜡置于油相锅内,水浴加热至85℃,使融化。取处方量的利拉萘酯加入油相锅内,搅拌至完全溶解,水浴保持25 min。另取处方量的甘油、水置于水相锅内,于水浴加热至60℃。再将三乙醇胺、尼泊金甲酯、尼泊金丙酯加入水相锅内,搅拌至完全溶解,水浴加热至85℃。先将油相置于乳化锅内,恒温下将水相缓缓加入,迅速搅拌。搅拌至室温,测定软膏的含量。灌装于10克规格的软管中,装量为10 g/支。
2.2 一般质量控制
性状:本品为白色乳膏。
鉴别:采用色谱法鉴别。取本品适量(约相当于利拉萘酯5 mg),精密称定,置10 mL量瓶中,加流动相适量,超声15 min,加流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。另取60℃真空干燥至恒重的对照品适量,用流动相溶解并稀释,制成每1 mL含100 μg的对照溶液。照有关物质测定项下的色谱条件检查,分别取20 μL进样,供试品溶液色谱中主峰的保留时间与对照品溶液色谱主峰的保留时间一致。
粒度:取适量的供试品,涂成薄层,薄层面积相当于盖玻片面积,共涂3片,照[2010年版《中国药典(二部)》附录ⅨE]第一法,在50~100倍显微镜(型号LEICA S91410)下检视,样品的粒度均小于 180 μm,符合规定。
装量:取本品5支,照[2010年版《中国药典(二部)》附录ⅩF]项下方法检查。结果见表1。本品的标示装量为10.0 g(<20 g),[2010年版《中国药典(二部)》附录ⅩF]项下规定,软膏平均装量不少于标示装量的93%。测定了3批软膏的装量,符合规定。
2.3 有关物质检测
2.3.1 色谱条件与系统适用性试验
照高效液相色谱法[2010年版《中国药典(二部)》附录ⅤD]试验。色谱柱为 Diamonsil C18柱(250 mm ×4.6 mm,5 μm),流动相为磷酸盐缓冲溶液(取磷酸二氢钾2.7g,加水1000 mL溶解,用磷酸调节pH至3.0)-乙腈(20∶80),检测波长为281 nm,流速1.0 mL/min,柱温室温。理论板数按利拉萘酯峰计算应不低2 500。利拉萘酯与相邻峰的分离度符合规定。
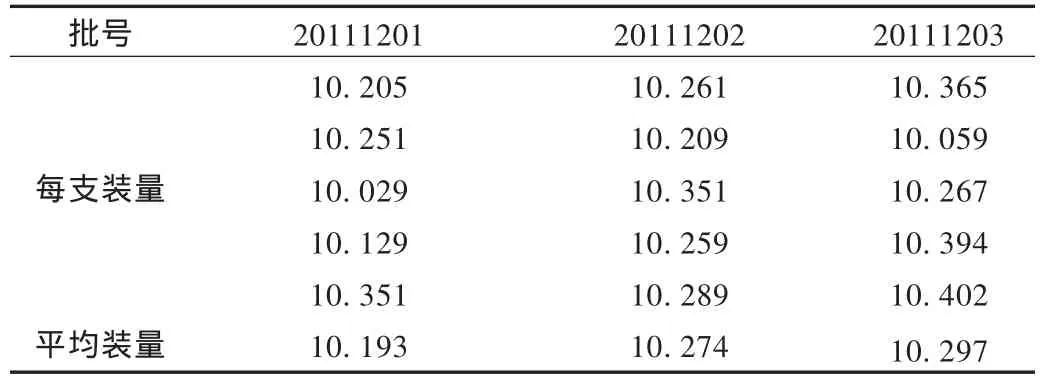
表1 3批利拉萘酯乳膏装量检查结果(g)
2.3.2 溶液制备
取空白软膏约0.25 g,置10 mL量瓶中,加流动相适量,超声15 min,再加流动相稀释至刻度,摇匀,滤过,取续滤液作为空白辅料溶液。精密称取本品原料药50 mg,置100 mL量瓶中,加流动相溶解并稀释,制成每1 mL含100 μg的溶液,作为对照溶液。精密称取本品软膏适量(约相当于利拉萘酯5 mg),置10 mL量瓶中,加流动相适量,超声15 min,再加流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。
2.3.3 方法学考察
专属性试验:分别取上述溶液各20 μL,按拟定色谱条件测定,记录色谱图。结果显示,在利拉萘酯主峰和主要杂质的出峰位置,空白辅料无信号,不干扰含量测定和有关物质的检查。
破坏性试验:取本品适量(约相当于利拉萘酯5 mg),分置10 mL试管中。于强酸(1 mol/L盐酸溶液2 mL)、强碱(1 mol/L氢氧化钠溶液2 mL)、加热(沸水浴1 h)、光照(紫外光照射24 h)及氧化(30%双氧水2 mL)等恶劣条件下,对试验样品进行加速破坏。酸、碱破坏的样品分别用盐酸和氢氧化钠溶液调节pH至中性后,再分别加流动相至10 mL,超声15min,摇匀,滤过,取续滤液作为供试品溶液。氧化、光照及加热破坏的样品加流动相10 mL,超声15 min,摇匀,滤过,取续滤液作为供试品溶液。另取未经破坏的软膏色谱图,作为对照色谱图。照拟订色谱条件试验,分别进样20 μL,记录色谱图,见图1。由试验可知,本品在紫外光照、强酸条件破坏不明显,而在碱、热、氧化条件下均有破坏,各破坏产物峰与主峰能完全分离,拟订的色谱条件可用于本品有关物质检查。
定量限和最小检测限:取利拉萘酯对照品10.21 mg,用流动相逐步稀释,依法依法进样20 μL,记录色谱,至利拉萘酯主峰峰高约为噪音的3倍时,计算出最低检出限为2.6 ng。至利拉萘酯主峰峰高约为噪音的10倍时,计算出定量限为7.6 ng。
2.3.4 样品有关物质检查
称取本品约15 g,加流动相溶解并稀释至50 mL,滤过,取滤液5 mL用流动相稀释至50 mL,作为供试品溶液。精密量取供试品溶液1 mL,加流动相稀释至100 mL,作为对照溶液。照2.3.1项下方法,取对照溶液20 μL注入液相色谱仪,调节仪器灵敏度,使主成分色谱峰的峰高约为满量程的10%~25%,再取供试品溶液和自身对照溶液各20 μL,分别注入液相色谱仪,记录色谱至主峰保留时间的2倍,分别计算最大单一杂质峰含量及各杂质峰总和的含量。3批样品中有关物质测定结果见表2。结果表明,本品3批样品总有关物质均小于1.0%,单个最大杂质均小于0.5%。
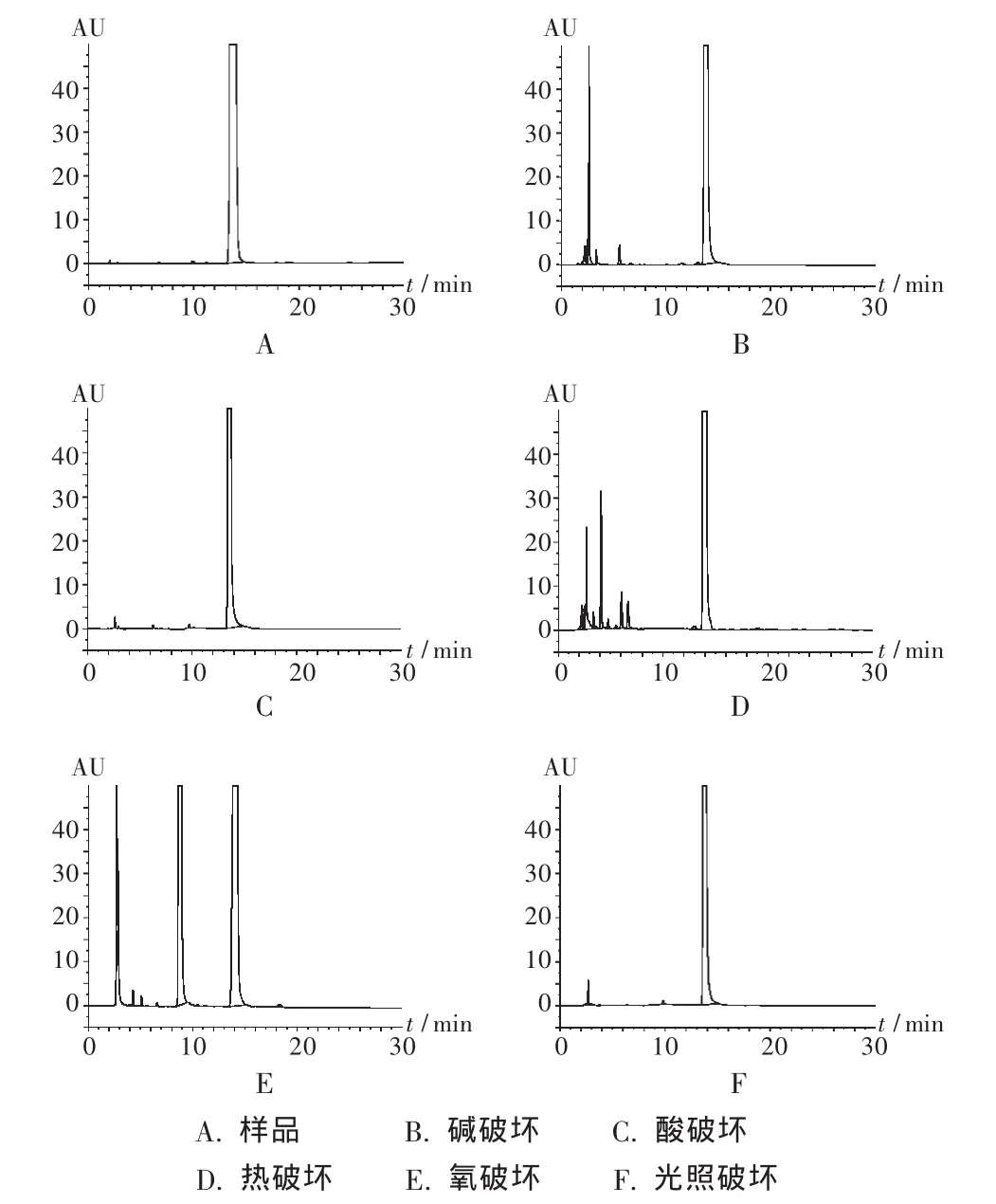
图1 利拉萘酯乳膏高效液相色谱图
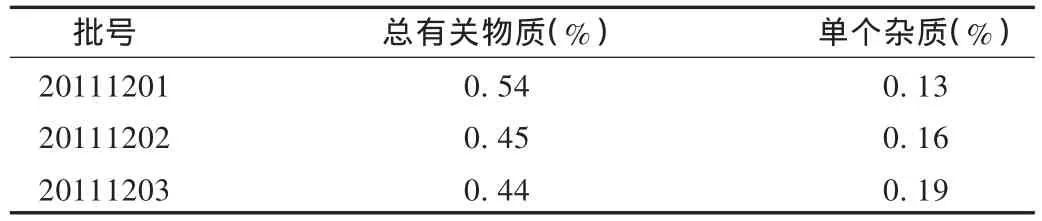
表2 3批样品有关物质测定结果(%)
2.4 含量测定
2.4.1 色谱条件
由于本品辅料多,且有关物质采用液相法测定,拟采用有关物质测定色谱条件进行含量测定方法学验证。
2.4.2 方法学考察
线性关系考察:精密称取利拉萘酯对照品9.63 mg,置25 mL容量瓶中,加流动相使溶解并稀释至刻度,摇匀,再精密量取该溶液 1.0,2.0,3.0,4.0,5.0 mL,分别置 10 mL 容量瓶中,加流动相稀释至刻度,摇匀,得标准系列溶液,各取标准系列溶液20 μL注入液相色谱仪,记录色谱,以峰面积(A)对质量浓度(C)进行线性回归,得回归方程为 C=4.45×10-7A -0.297(r=0.999 8)。结果表明,利拉萘酯质量浓度在38.52~192.6 μg/mL范围内与峰面积线性关键良好。
精密度试验:取质量浓度为115.56 μg/mL的利拉萘酯对照品溶液,连续进样6次,按拟订的色谱条件测定。结果峰面积的RSD=0.68%(n=6),表明方法精密度良好。
加样回收试验:取60℃真空干燥至恒重的利拉萘酯对照品和空白软膏适量,精密称定,照软膏规格(利拉萘酯20 mg/g)按80%,100%和120%的比例配制成模拟软膏,各分别称取3份。置10 mL量瓶中,加适量流动相,超声15 min,再加流动相稀释至刻度,摇匀,滤过,精密量取续滤液2.0 mL至10 mL量瓶中,加流动相稀释至刻度,摇匀,作为供试品溶液。另取60℃真空干燥至恒重的利拉萘酯对照品适量,用流动相溶解并稀释成每1 mL含100 μg的对照溶液。取20 μL注入液相色谱仪,记录色谱图。按含量测定项下方法测定含量,计算回收率。结果见表3。
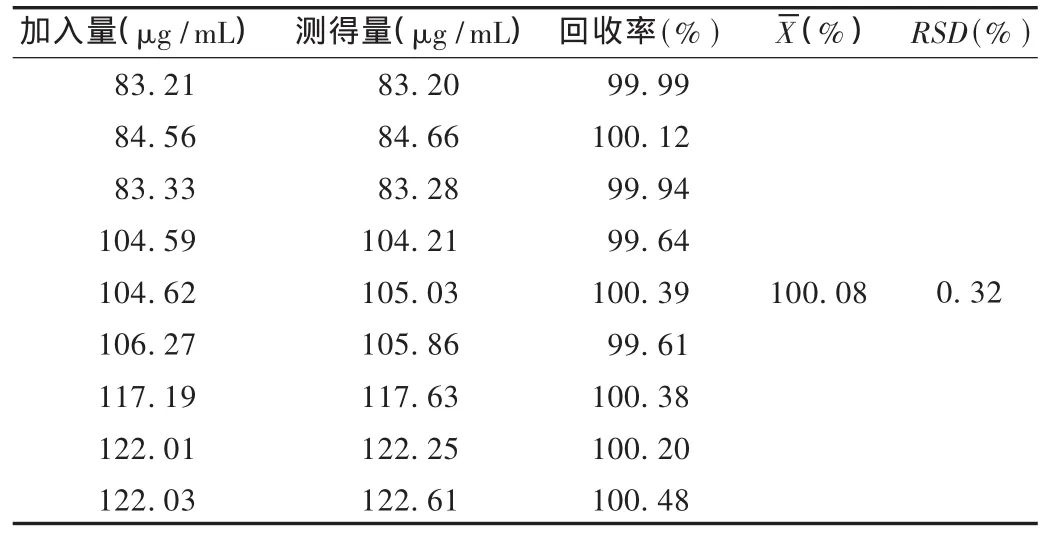
表3 加样回收试验结果
2.4.3 样品含量测定
精密称取本品适量(约相当于利拉萘酯5 mg),置10 mL量瓶中,加流动相,超声15 min,再加流动相稀释至刻度,摇匀,滤过,精密吸取续滤液2 mL置10 mL量瓶中,加流动相稀释至刻度。另取60℃真空干燥至恒重的利拉萘酯对照品适量,精密称定,用流动相溶解并稀释成每1 mL中约含100 μg的溶液,作为对照品溶液。分别取对照品溶液与供试品溶液各20 μL注入液相色谱仪,记录色谱图,量取利拉萘酯峰的峰面积。用外标法计算利拉萘酯的含量,结果见表4。结果表明,3批软膏中利拉萘酯含量范围为 99.81% ~103.09%;RSD均小于 2.0%,说明用本法测定软膏中利拉萘酯含量,其方法精密度能够满足定量要求,可以作为含量测定的方法。
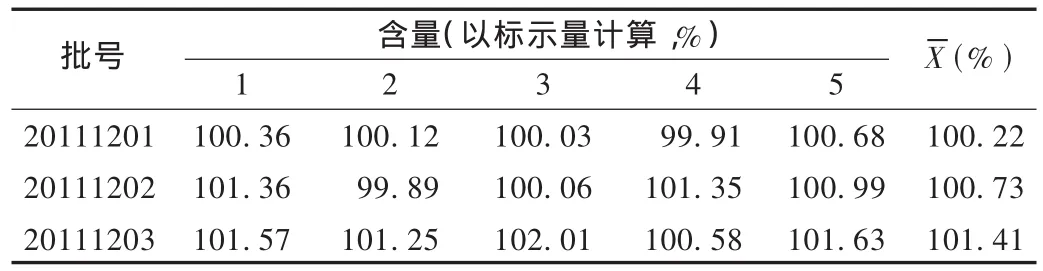
表4 样品含量测定结果
2.5 皮肤刺激试验[2]
采用人体贴敷法,分别在手臂、面部及背部皮肤上涂搽,并取另侧皮肤相对位置进行乳膏基质对照试验,涂样量均为1 g,24 h后观察。结果两侧皮肤均未发现过敏反应,且无刺激感。
2.6 稳定性试验[3]
离心试验:取样品10 g,置玻璃离心管中,以3 000 r/min转速离心30 min,结果乳膏未见分层现象。
耐热、耐寒试验:取本品10 g,装于密闭小瓶中,分别置55℃恒温水浴箱中恒温6 h、置冰箱(-12℃)中放置24 h。结果乳膏均未见分层现象。
影响因素试验:取一批样品,试验前全部除去包装,将乳膏置玻璃平皿中,暴露于强光(4 500 lx)、高温(40℃)、低温(4℃)、高湿(RH 92.5%)的环境下试验,分别于第5,10天取样供检测,与0天作比较。结果见表5。可知,利拉萘酯软膏在光照、高温、低温及高湿等试验环境中均稳定,含量均无明显改变,HPLC法检查未发现新的杂质峰,利拉萘酯的峰面积比也未下降;除在高湿条件下体积略有增大和高温条件下除体积略有减小外(由于完全暴露在试验环境中,此变化为吸水或失水过程,属物理改变),其余均无明显改变。提示本品应置阴凉干燥处保存。
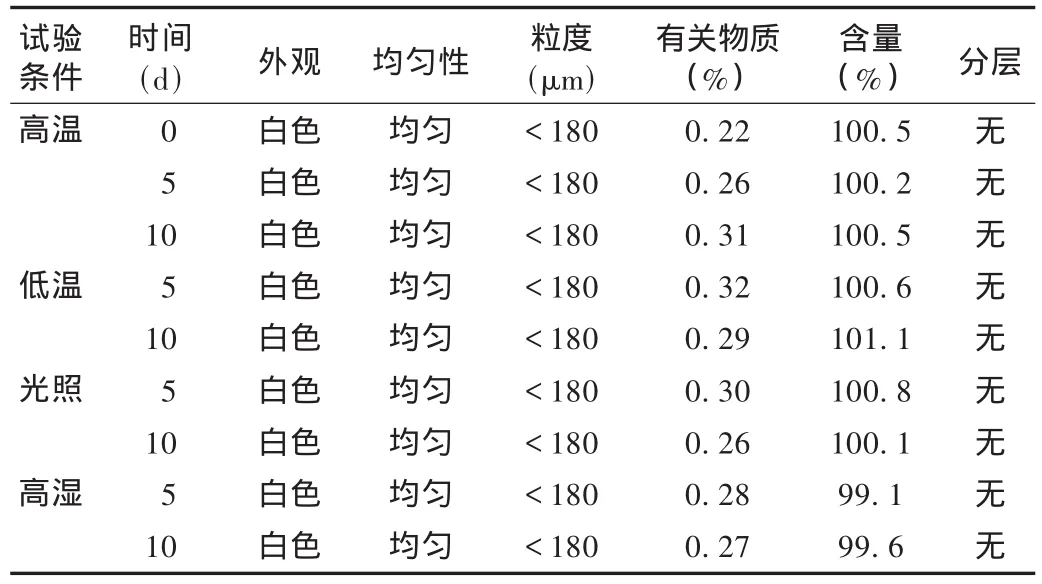
表5 样品稳定性影响因素试验结果(批号20111201)
3 讨论
参考日本Torii公司上市制剂Zefnart®[4],每g含20 mg利拉萘酯的规格,制订本品每g含利拉萘酯2%。考虑到本品为治疗真菌感染的外用制剂,故将本品制成O/W型软膏,使基质中药物的释放和穿透皮肤较其他类型基质快,且无油腻性、易用水洗除。
在选择液相色谱条件时,由于辅料多,且极性差异大,流动相不同,可能导致辅料等干扰主成分的测定。经过试验,最终选择以磷酸盐缓冲溶液(取磷酸二氢钾2.7 g,加水1 000 mL溶解,用磷酸调节pH至3.0)-乙腈(20∶80)为流动相时,利拉萘酯能在较合适的时间出峰,而且能消除辅料对测定的干扰;乙腈对乳膏样品中的利拉萘酯溶解性较好,采用流动相直接稀释样品,操作简便。本法准确度和精密度高,稳定性好,可用于控制利拉萘酯乳膏的含量。
[1]钟 倩.角鲨烯环氧化酶抑制剂抗真菌药利拉萘酯[J].国外医药:合成药、生化药、制剂分册,2001,22(3):190.
[2]张军霞,仲 平,卢来春.克林霉素磷酸酯乳膏的制备与质量控制[J].中国药房,2010,21(21):1 979 - 1 981.
[3]匡长春,欧阳京,王志朝,等.替硝唑乳膏的制备及质量控制[J].中国药业,2011,20(4):51 -52.
[4]日本病院藥劑師会医.藥品インタビュ一フォ一ム[EB/OL].日本:日本病院藥劑師会医,2010[20120315].http://www.shijieyaofang.com/upload/product/2011112121260426.PDF
