奥曲肽与奥美拉唑联合应用对肝癌H22生长的抑制作用
2012-09-13李春雷朱雪松
李春雷 刘 菁 耿 丽 李 鹏 朱雪松 郑 芳
湖北医药学院附属东风医院药学部,湖北十堰 442008
从1889年Stephen Paget提出肿瘤微环境的 “种子与土壤”假说至今,研究者认识到肿瘤微环境对于肿瘤的增殖、侵袭、迁移、黏附能力及新生血管的形成具有重要影响[1],也影响肿瘤细胞对放疗、化疗的敏感性,其中异常的细胞外酸性微环境的诱导和维持,被认为是肿瘤形成和进展的关键环节之一[2]。奥美拉唑能够通过作用质子泵改变肿瘤细胞的酸环境产生抗肿瘤作用[3]。生长抑素类似物奥曲肽和其受体作用发挥抗肿瘤作用,特别是具有很强的肿瘤新生血管生成抑制作用,影响肿瘤组织供血,并且具有逆转肿瘤耐药的作用。而且,奥曲肽和奥美拉唑是临床肿瘤放化疗中常用的治疗和预防性药物,两者作用机制不同,都可以影响肿瘤组织微环境的变化,联合用药是否具有增强抗肿瘤作用呢?因此,本研究拟联合奥曲肽和奥美拉唑共同作用小鼠肝癌H22,初步研究联合用药的抗肿瘤效果。
1 材料与方法
1.1 药物与试剂
奥曲肽(0.1 mg/支,诺华制药),注射用奥美拉唑钠(40 mg/支,阿斯利康制药有限公司),顺铂(DDP)注射液(10 mg/支,齐鲁制药),所有抗体、二抗及显色试剂盒购自武汉博士德试剂公司,其他试剂为分析纯。
1.2 实验动物与瘤株
SPF 级 ICR 雌性小鼠,体质量(20.0±2.0)g,昆明医学院动物实验中心提供,合格证号:滇实动证字第SCXK(滇)2005-008,室温条件下小鼠分笼饲养,自由饮水摄食,过夜;小鼠肝癌H22,本院肝病研究中心提供。
1.3 奥曲肽和奥美拉唑对肝癌H22 肿瘤生长的影响
小鼠肝癌H22 瘤株,腹腔传代接种。待腹水生长旺盛时,抽出腹水,细胞计数,用生理盐水调整细胞浓度为5.0 ×106个/mL,于小鼠腋下皮下注射肝癌H22 肉瘤细胞悬液0.2mL/只,接种24 h后随机分组给药。根据小鼠体质量随机分为五组:阴性对照组、顺铂组、奥曲肽组、奥美拉唑组和奥曲肽+奥美拉唑组(联合用药组),每组10只,给药同时观察小鼠的精神、皮毛光泽度、饮食和活动等一般情况。阴性对照组腹腔注射生理盐水,其他组分别腹腔注射顺铂1mg/kg、奥曲肽100μg/kg、奥美拉唑100mg/kg,奥曲肽100 μg/kg联合奥美拉唑100mg/kg,给药1次/d,连续用药9 d,末次给药次日处死小鼠,剥瘤体,称重计算抑瘤率。抑瘤率(%)=(阴性对照组平均瘤质量-给药组平均瘤质量)/阴性对照组平均瘤质量×100%,并通过抑瘤率比较联合用药的疗效。
1.4 免疫组织化学法测量微血管密度
各组小鼠瘤体剥离后,参照试剂盒说明书采用免疫组化SABC法染色血管。切取标本,固定,包埋,切片,经染色后,内皮细胞褐染,血管呈黄褐色。采用Weidner[4]的方法及判断标准进行,计算肿瘤内着色的毛细血管和微小血管,即在低倍视野下选取肿瘤微血管最丰富的区域,然后在400 倍视野范围 (0.72 mm2)为标准计数被染色的微血管数目,取3个数值的平均值作为微血管密度(micro vessel density,MVD)值。
1.5 统计学方法
应用SPSS 11.5统计软件,计量资料数据以均数±标准差(±s)表示,多组间的比较采用方差分析,两两比较采用LSD-t检验。计数资料采用 χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 奥曲肽和奥美拉唑对肝癌H22 肉瘤生长的影响
小鼠接种肿瘤细胞前2 d活动饮食无异常,第3 天腋下可触及黄豆大小移植瘤,实验过程中阴性对照组肿瘤生长明显快于其他给药组,且小鼠饮食急剧减少,毛发杂乱无光泽,竖毛现象明显,蜷缩多活动减少。顺铂组表现出明显的化疗副作用,毛发杂乱无光泽,体质生长缓慢瘦小。随着肿瘤的生长和药物的作用,其他组小鼠食欲下降程度、活动减少、体质虚弱、精神不振等表现也不同,同时毛发光泽度出现差异化,实验完毕各组小鼠体质量的变化也不同。实验完毕,阴性对照组小鼠肿瘤平均重量>1 g,说明本实验小鼠肝癌H22 肿瘤模型移植成功。奥曲肽组、奥美拉唑组、联合用药组的瘤重与阴性对照组相比差异有统计学意义(P<0.05),联合用药组的抑瘤率大于单独用药的抑瘤率,初步表明两药联合用药可以增强抗肿瘤效果。见表1。
表1 奥曲肽和奥美拉唑对肝癌H22肉瘤生长的影响(±s,n=10)
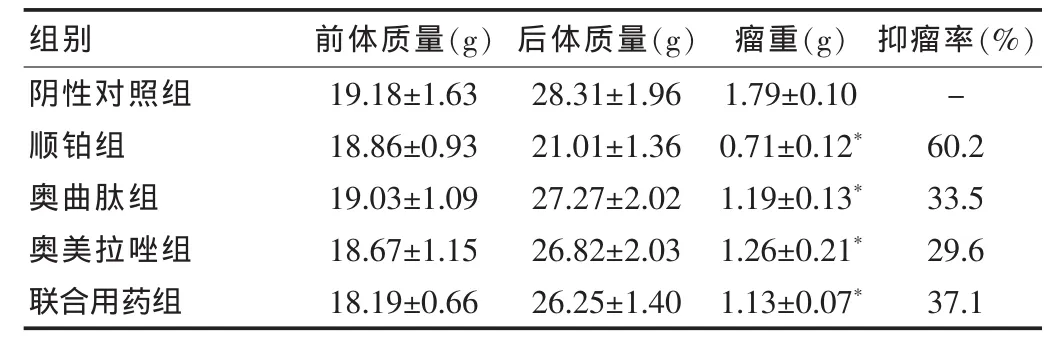
表1 奥曲肽和奥美拉唑对肝癌H22肉瘤生长的影响(±s,n=10)
注:与阴性对照组比较,*P<0.05;“-”表示无数据
组别 前体质量(g) 后体质量(g) 瘤重(g) 抑瘤率(%)阴性对照组顺铂组奥曲肽组奥美拉唑组联合用药组19.18±1.63 18.86±0.93 19.03±1.09 18.67±1.1518.19±0.66 28.31±1.96 21.01±1.36 27.27±2.02 26.82±2.03 26.25±1.40 1.79±0.10 0.71±0.12*1.19±0.13*1.26±0.21*1.13±0.07*-60.2 33.529.6 37.1
2.2 奥曲肽和奥美拉唑对肝癌H22 组织微血管密度的影响
小鼠肝癌H22 瘤体经免疫组化染色后,血管内皮细胞被褐染,微血管的大小、形态差异较大,有的仅为单个内皮细胞和内皮细胞族,微血管管腔形态不规则,特别是肿瘤组织出现坏死的边缘的MVD高于中央。阴性对照组可见微血管广泛分布于肿瘤组织间质内,其他给药组微血管明显减少,减少程度不一,与阴性对照组比较差异有统计学意义(P<0.05),见表2。
表2 奥曲肽和奥美拉唑对肝癌H22组织微血管密度的影响(±s,n=10)

表2 奥曲肽和奥美拉唑对肝癌H22组织微血管密度的影响(±s,n=10)
注:与阴性对照组比较,*P<0.05
组别微血管密度阴性对照组顺铂组奥曲肽组奥美拉唑组联合用药组55.42±10.3536.01±6.73*29.34±8.78*40.95±9.23*23.89±5.76*
3 讨论
在临床肿瘤放化疗过程中,质子泵抑制剂奥美拉唑常被用来抑酸护胃、止吐等预防不良反应的发生,其潜在的抗肿瘤作用很少引起重视。在体外,奥美拉唑能够通过不同途径诱导不同的肿瘤细胞凋亡[5],还可以作用于肿瘤细胞V型ATP酶来改变肿瘤的微酸环境产生抗肿瘤作用[3],而且临床研究资料显示奥美拉唑可以诱导胃癌前病变组织细胞凋亡[6],间接提示质子泵抑制剂在肿瘤的放化疗中具有非常大的辅助治疗价值。同样,生长抑素类似物奥曲肽主要用于消化道系统疾病治疗,辅助用于肿瘤治疗,并且临床研究也报道了生长抑素及其类似物能够影响胃癌血管的生成[7],胃癌组织中生长抑素及其受体的表达与胃癌的发生、发展及预后存在密切关系,生长抑素及其类似物对胃癌有抗增殖、促凋亡及抗血管增生等作用[8]。因此,本研究采用奥曲肽和奥美拉唑单独和联合用药作用小鼠抑制瘤模型,初步观察抗肿瘤效果。
实验小鼠接种肝癌H22 成功后,各组小鼠的一般情况变化具有很大差异,包括饮食、活动、精神和毛发光泽度等。阴性对照组呈现出典型的癌性恶病质症状,顺铂组呈现出典型的化疗损伤,而奥美拉唑组和奥曲肽组小鼠在饮食、活动和毛发光泽度好于阴性对照组和顺铂组小鼠,这种差异性暗示奥美拉唑和奥曲肽对荷瘤小鼠的机体具有一定的保护作用,能够改善肿瘤导致的小鼠癌性恶病质的作用,与沈永华等[9]的研究报道相一致,该作用在临床肿瘤综合治疗中具有非常大的潜在辅助治疗价值。
奥曲肽、奥美拉唑单用和联用时对肝癌H22的抑制率分别为33.5%、29.6%、37.1%,联合用药的抑制率高于单独用药者,两者比较差异无统计学意义。同时,单独用药和联合用药对肿瘤微血管密度的影响也不同,联合用药组微血管密度低于单独用药组,两者比较差异也无统计学意义。无论单用还是联合用药,奥曲肽和奥美拉唑均表现出一定的抗肿瘤作用,联合用药的作用效果优于单独用药,但是没有统计学差异,分析这种差异可能受给药剂量、给药时机等因素的影响较大,假如间歇给药或者提前预防给药是否具有更强的抗肿瘤活性。同时,在对肿瘤血管密度影响方面,联合用药对肿瘤血管密度的抑制作用大于单独用药,也表现出协同效应,与抑瘤率的作用效果一致,但是组间比较没有差异性,分析原因可能与剂量、给药时机有关,但是结果间接提示有必要深入研究联合用药对肿瘤血管的生长抑制作用。
综上所述,奥曲肽和奥美拉唑联合用药初步显示出增强抗肿瘤效果,该增强机制、对临床放化疗的减毒增效作用亟需深入的研究,以便更好地应用于临床肿瘤的辅助治疗。
[1] 郜明,吴家明,陆茵.肿瘤微环境与肿瘤的恶变[J].癌变、畸变、突变,2008,20(8):412-417.
[2] 张慈安,魏品康,李勇进.肿瘤酸性微环境的研究进展[J].肿瘤,2010,6(30):550-553.
[3] 沈秋瑾,覃文新.靶向肿瘤酸性微环境的抗肿瘤策略[J].生命科学,2008,20(5):795-710.
[4] Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180.
[5] Yeo M,Kim DK,Kim YB.Selective induction of apoptosis with proton pump inhibitor in gastric cancer cells [J].Clin Cancer Res,2004,10(24):8687-8696.
[6] 蒋鹏程,倪洪昌,李琦恒.奥美拉唑对胃癌前病变细胞凋亡的影响[J].中国医院药学杂志,2006,26(4):405-408.
[7] 刘明学,吴凯南.生长抑素及其类似物对肿瘤学管生成的影响[J].中华普通外科杂志,2002,17(12):763-766.
[8] 陈瑞丰,杜国平.生长抑素与胃癌关系的研究[J].临床和实验医学杂志,2008,7(6):178-179.
[9] 沈永华,陈敏,沈卫东,等.质子泵抑制剂对SGC-7901 胃腺癌裸小鼠癌性恶病质的作用[J].胃肠病学,2011,16(1):11-15.
