以CoSol-Sur技术制备脂溶性药物吲哒帕胺壳聚糖温敏原位凝胶的实验研究
2012-09-13叶田田董江南潘卫三
彭 缨 李 杰 叶田田 李 静 尹 飞 董江南 潘卫三
1.沈阳药科大学药学院,辽宁沈阳 110016;2.辽宁省肿瘤医院药学部,辽宁沈阳 110042
温敏原位凝胶(thermosensitive in situ gel),又称温敏在位凝胶,是指高分子材料以溶液状态给药后,在用药部位对温度产生响应,发生分散状态或构像的可逆转化,形成半固体状态的药物储库[1]。近年来,作为自然界中唯一含游离氨基的碱性多糖——壳聚糖被广泛地应用于生物医学和药物传递系统等领域[2-3]。然而,壳聚糖不溶于有机溶剂,而只能溶解于酸性的水性介质(pH<6)中,这在一定程度上限制了其应用。在生理pH值(6.8~7.2)下,于壳聚糖溶液中加入甘油磷酸盐(Glycerophosphate,G),得到的壳聚糖溶液在低温(4℃)下呈现溶液状态,温度达到37℃时形成凝胶[4-5],即所谓的温敏性质。该体系中的GP也是公认的高生物相容性物质,故壳聚糖/GP体系在关节修复、组织工程支架等生物医学领域得到了广泛应用[6]。
潜溶-表面活性剂相结合技术(CoSol-Sur技术)的核心是利用少量的、适于注射给药的、安全性得到广泛验证的潜溶剂(Cosolvent),如 Pharmasolve、Glycerolformal,作为脂溶性药物的溶媒[7],借助安全高效的新型表面活性剂,如Cremphor ELP、Solutol HS15、生育酚聚乙二醇琥珀酸酯(tocopheryl polyetheyene glycol 1000 succinate,TPGS), 通过过饱和原理在体形成脂溶性药物微晶(microcrystal)[8-9]。
笔者以往的有关研究已经证明壳聚糖/GP体系可以较好地应用于水溶性药物传递系统中,但在脂溶性药物的运载上还存在一些问题。本文采用CoSol-Sur技术,以脂溶性降压药物吲哒帕胺(Indapamide,IPM)为模型药物[10-11],为壳聚糖/GP温度敏感型原位凝胶在脂溶性药物药物传递系统中的应用进行探索性研究。
1 仪器与试药
LC-10A型HPLC系统,SPD-10A检测器(日本岛津株式会社);MD200-2 电子分析天平 (奥豪斯国际贸易有限公司);NDJ-8S旋转式黏度计 (上海精科天平);SHA-BA型水浴恒温振荡器(江苏荣华仪器公司);Dimension 3100 原子力显微镜 (美国Veeco Metrology)。吲哒帕胺 (北京燕山制药厂);壳聚糖 (脱乙酰度96%,济南海得贝海洋生物有限公司);α,β-GP (紫光古汉生物公司);β-GP(Fluka);Pharmasolve(ISP 国际特品有限公司);Glycerolformal(Servon XGF,广州纪雅);Tween 80(Croda,美国);Cremphor ELP(德国巴斯夫);Solutol HS15(德国巴斯夫);TPGS(伊士曼化学公司),其余试剂为分析纯。
2 方法与结果
2.1 利用CoSol-Sur技术制备IPM壳聚糖/GP原位凝胶
于0.13 mol/L的盐酸中在高速搅拌的条件下加入壳聚糖,室温下搅拌24 h得到澄清溶液(3%,W/V);冰水浴下,于去离子水/潜溶剂/表面活性剂三元溶剂系统中分别溶解处方量的GP、IPM。磁力搅拌下,先将IPM溶液滴加到壳聚糖盐酸溶液中,搅拌5min。然后再滴加GP溶液,4℃搅拌5min,即得原位凝胶。
2.2 胶凝时间与胶凝形态考察
将2 mL壳聚糖/GP溶液分装到6 mL西林瓶中,放置于37℃水浴中以保温;每隔0.5min将西林瓶倾斜以观察体系由自由流动液体转变成半固体所需时间,记为胶凝时间。以评分制为标准,评价壳聚糖/GP溶液保温1 h后的胶凝形态,考察药物,GP含量和壳聚糖浓度胶凝时间和胶凝状态的影响,具体评分标准见表1。

表1 壳聚糖/GP原位凝胶胶凝形态评分标准
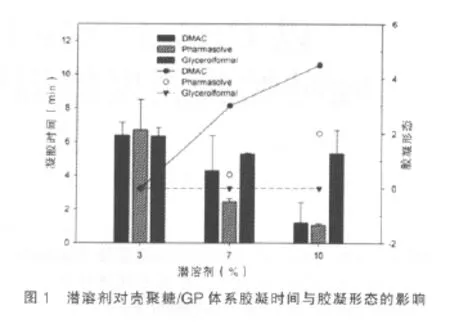
2.2.1 潜溶剂对胶凝时间与胶凝形态的影响 于制备工艺下制得的空白壳聚糖/GP原位凝胶中分别加入3%、7%、10%潜溶剂,体系的胶凝时间及胶凝形态有所不同(图1)。结果表明,体系的胶凝时间随着潜溶剂含量的升高而缩短,特别的是,Glycerolformal对体系胶凝时间影响较小。含DMAC、Pharmasolve体系胶凝形态分值随着潜溶剂含量的升高而升高,其中对壳聚糖/GP体系胶凝形态影响最为显著的是DMAC。
2.2.2 表面活性剂对胶凝时间与胶凝形态的影响 于制备工艺下制得的空白壳聚糖/GP原位凝胶中分别加入1.8%、3.6%、5.4%表面活性剂,体系的胶凝时间与胶凝形态的评价结果有所不同(图 2)。结果表明,Tween 80、Solutol HS15的含量影响体系的胶凝时间,且成反比的关系;而Cremphor ELP、TPGS对其影响相对较小,但5.4%的TPGS导致体系胶凝形态分值迅速升高。相对于其他表面活性剂,对壳聚糖/GP体系胶凝形态影响最小的是Cremphor ELP,最显著的为Tween 80。

2.3 黏度考察
将按照制备工艺制得的壳聚糖/GP原位凝胶于37℃下保温1 h,利用旋转式黏度计进行黏度测定。
2.3.1 潜溶剂对凝胶黏度的影响 于制备工艺下制得的壳聚糖/GP原位凝胶中加入含量分别为1.7%、3.4%的潜溶剂,37℃下保温1 h,测定黏度,结果见图3。结果表明,当潜溶剂含量升高时,壳聚糖/GP凝胶黏度降低,且含Glycerolformal体系黏度会较高于含Pharmasolve的体系。

2.3.2 表面活性剂对凝胶黏度的影响 于按照制备工艺制得的壳聚糖/GP原位凝胶中加入含量分别为0.8%、1.6%的表面活性剂,37℃下保温1 h,测定黏度,结果见图4。结果表明,总体上,当表面活性剂含量升高时,壳聚糖/GP凝胶黏度降低,此效应与潜溶剂及表面活性剂的种类相关。表面活性剂的用量对含Solutol HS15的壳聚糖/GP原位凝胶的凝胶黏度影响最为显著,而对以Glycerolformal为潜溶剂,TPGS为表面活性剂的壳聚糖/GP原位凝胶的黏度影响相对不显著。

3 讨论
表面活性剂可起到增溶的作用,其原理为表面活性剂在水溶液中缔合形成胶束,亲水基团向外,疏水内核包裹IPM。当表面活性剂的含量一定时,Tween 80、Cremphor ELP、Solutol HS15、TPGS对IPM的增溶能力呈递增趋势。潜溶剂能够降低水相的极性,使得外水相对表面活性剂分子的亲和性升高,胶束内核的疏水作用降低,部分表面活性剂分子以游离形式进入外水相,降低胶束的缔合度,进而影响其对IPM的增溶效果。因此,系统中IPM的溶解度会因为低含量的潜溶剂的存在而降低,特别是对于Solutol HS15。此外,由于潜溶剂对IPM突出的增溶能力,随着体系中潜溶剂含量的进一步升高,IPM的溶解度亦增大(Pharmasolve、DMAC尤其明显)。
有文献报道将药物溶解于潜溶剂,利用过饱和原理使该溶液遇水在体形成脂溶性药物纳米混悬液[14]。然而,单独应用潜溶剂制备的IPM纳米混悬液呈簇状结晶,且粒径较大,效果不理想。因此本文采用表面活性剂来抑制IPM晶核长大。表面活性剂疏水基团吸附于IPM新生晶核表面,亲水基团指向外水相,产生空间位阻致使药物晶体生长受到抑制。文献报道HPMC、PVP等高分子溶液具有对药物结晶抑制作用。其作用机制被认为:①高分子通过氢键作用吸附于晶体表面;②药物晶体周围高分子的聚集形成流体动力学界面,从而抑制其生长。
利用CoSol-Sur技术,以脂溶性药物IPM为模型药物,通过过饱和原理,于壳聚糖/GP体系中在体形成IPM微晶。潜溶剂、表面活性剂对药物的增溶作用,以及表面活性剂于药物微晶表面的吸附,使得IPM能够部分溶解,或以胶束、微晶状态均匀分散于壳聚糖/GP系统之中,可以有效提高脂溶性药物与壳聚糖/GP水性基质的相容性以及制剂的含量均匀性。
[1] 魏刚,陆伟跃,郑俊民.温度敏感原位凝胶中药物的扩散行为[J].药学学报,2004,39(3):232-235.
[2] Martino AD,Sittinger M,Risbud MV.Chitosan:A versatile biopolymer for orthopaedic tissue-engineering [J].Biomaterials,2005,26:5983-5990.
[3] Hou Q,Bank P,Shakesheff KM.Injectable scaffolds for tissue regeneration[J].J Mater Chem,2004,14:1915.
[4] Chenite A,Buschmann M,Wang D,et al.Rheological characterisation of thermogelling chitosan&glycerol-phosphate solutions[J].Carbohydrate Polymers,2002,46:39-47.
[5] Chenite A,Chaput C,Wang D.Novel injectable neutral solutions of chitosan form biodegradable gels in situ[J].Biomaterials,2000,21(21):2155-2161.
[6] Molinaro G,Leroux JC,Damas J,et al.Biocompatibility of thermosensitive chitosan-based hydrogels:an in vivo experimental approach to injectable biomaterials[J].Biomaterials,2002,23:2717-2722.
[7] Jain P,Yalkowsky SH.Solubilization of poorly soluble compounds using 2-pyrrolidone[J].Int J Pharm,2007,342:1-5.
[8] Raghavan SL,Schuessel K, Davis A,et al.Formation and stabilisation of triclosan colloidal suspensions using supersaturated systems[J].Int J Pharm,2003,261:153-158.
[9] Douroumis D,Fahr A.Stable carbamazepine colloidal systems using the cosolvent technique[J].Eur J Pharm Sci,2007,30:367-374.
[10] Robinson DM,Wellington K.Indapamide sustained release a review of its use in the treatment of hypertension[J].Drugs,2006,66:257-271.
[11] Sassard J,Bataillard A,Mcintyre H.An overview of the pharmacology and clinical efficacy of indapamide sustained release [J].Fundamental&Clinical Pharmacology,2005,19:637-645.
