局部亚低温对急性脑梗死患者血清一氧化氮和内皮素含量的影响
2012-09-12杨健军赵修敏卢英云杜怡峰房淑欣山东省交通医院血栓病房山东济南25003
杨健军 程 林 赵修敏 卢英云 杜怡峰 房淑欣 (山东省交通医院血栓病房,山东 济南 25003)
近年来,脑局部亚低温治疗已在急性脑血管病、颅脑损伤等临床疾病中广泛应用,但对其脑保护的作用机制及临床疗效的报道较少。一氧化氮(NO)和内皮素(ET)作为血管内皮细胞合成的因子,具有重要的器官局部血流调节作用。血管内皮细胞在脑梗死的发生及发展中起到了重要的作用,脑卒中后NO、ET浓度的变化对判断病情进展及预后有重要意义,各种原因引起的血流动力学改变几乎都是通过这些因子发挥作用的〔1〕。本研究通过观察局部亚低温治疗对急性脑梗死患者血清NO和ET的影响,探讨局部亚低温对脑缺血的保护机制。
1 资料与方法
1.1 研究对象 对山东省交通医院血栓病房2009年5月至2010年10月住院的急性脑梗死患者66例,所有病例均符合1995年全国第四届脑血管病学术会议制定的脑梗死诊断标准〔2〕,并经头颅 CT或MRI证实;发病时间为24 h内;年龄在45~88岁之间;首次发病或未留下后遗症的再发者;有肢体瘫痪且瘫痪肢体肌力在Ⅲ级以下。66例患者随机分为亚低温治疗组33例,其中男17例,女16例,平均(63.54±13.26)岁,从发病到治疗的时间平均为(12±9)h,NIHSS评分为(17.22±1.91)分;对照组33例,男18例,女15例,平均(62.76±13.68)岁,从发病到治疗的时间平均为(13±8)h,NIHSS评分(17.37±2.44)分。两组在年龄、性别比、病情严重程度、开始治疗时间、伴随疾病无显著差异(P>0.05),具有可比性。对于既往有脑出血、大面积脑梗死病史的患者,伴有严重的心、肝、肾功能障碍及肺部感染,以及已采用动静脉溶栓治疗的患者不予入选。
1.2 方法 两组病例均给予常规抗血小板、吸氧、脱水降颅压、脑保护剂、活血化淤、对症支持等综合治疗。亚低温组在此基础上采用SDL-V型双控颅脑降温仪(唐山市北方医用设备有限公司)行局部亚低温治疗,采用欧姆龙红外线耳式温度计(大连欧姆龙有限公司)测量鼓膜温度,先在头盔内部装入导冷枕垫,然后在病人头部套上衬套,将头盔置于病人头部,头盔与医用低温治疗仪处于同一水平位置安放。冰帽温度设置在-2℃ ~4℃,使脑温维持在33℃ ~35℃,自动调温,亚低温维持时间为48~72 h,同时进行心电、血压、呼吸、脉搏、瞳孔、血钾等监测。复温:采用每1~2 d恢复1℃的缓慢升温方式,复温速度每小时不超过0.1℃。观察指标:在发病第1、3、7、14天所有入组患者抽取空腹静脉血,3 000 r/min离心后分离血清,放置在-70℃冰箱中待测。采用硝酸还原法测定血清中NO的含量,采用放免分析方法测定血清中ET的含量。ET试剂盒用自上海工硕生物技术有限公司,NO试剂盒用自上海一基实业有限公司。临床神经功能缺损评分采用NIHSS评分,最高分22分;采用 Fugl Meyer评价法评价运动功能,最高分100分,Bathel指数评分评价日常生活活动能力,最高分100分。两组病人都分别在治疗前、治疗后30 d进行评分。
1.3 统计学处理 采用SPSS11.0软件进行统计分析,数据均以±s表示,组间比较采用t检验。
2 结果
2.1 治疗组、对照组血清NO、ET含量 治疗后第3、7、14天治疗组NO含量较对照组显著升高(均P<0.01),见表1;在治疗后第7天治疗组ET含量低于对照组(P<0.05),第3、14天治疗组ET含量显著低于对照组(P<0.01),见表2。
表1 两组患者血浆NO浓度比较(±s,μmol/L,n=33)

表1 两组患者血浆NO浓度比较(±s,μmol/L,n=33)
与治疗前比较:1)P<0.05,2)P<0.01;与对照组比较:3)P<0.01
组别 治疗前 第3天 第7天 第14天对照组 26.48±4.23 22.91±6.261) 36.75±4.641) 41.36±9.921)治疗组 27.83±6.37 38.88±7.361)3)51.31±10.422)3)55.08±6.572)3)
2.2 治疗组、对照组神经功能缺损、运动功能评分比较 治疗1个月后,治疗组NIHSS评分比对照组显著降低,治疗组Bathel指数和Fugl Meyer评分均明显高于对照组(P<0.01),见表3。
表2 两组患者血浆ET浓度比较(± s,pg/ml,n=33)

表2 两组患者血浆ET浓度比较(± s,pg/ml,n=33)
与治疗前比较:1)P<0.05,2)P<0.01;与对照组比较:3)P<0.05,4)P<0.01
组别 治疗前 治疗第3天 治疗第7天 治疗第14天对照组 89.85±10.36 92.24±8.621) 76.37±5.161) 67.52±10.422)治疗组 91.88±3.71 80.73±5.541)4)70.05±6.882)3)52.63±4.572)4)
表3 治疗前后两组病人神经功能和运动功能评定结果比较(分,± s,n=33)
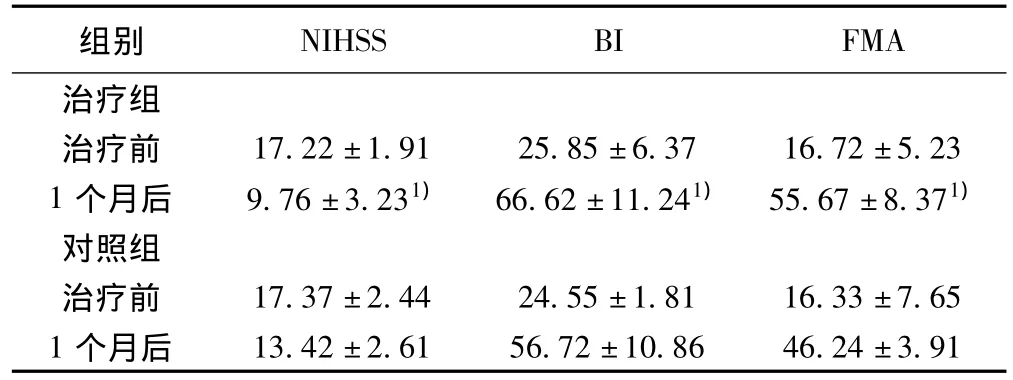
表3 治疗前后两组病人神经功能和运动功能评定结果比较(分,± s,n=33)
与对照组比较:1)P<0.01
组别NIHSS BI FMA治疗组治疗前 17.22±1.91 25.85±6.37 16.72±5.23 1个月后 9.76±3.231) 66.62±11.241) 55.67±8.371)对照组治疗前 17.37±2.44 24.55±1.81 16.33±7.65 1个月后13.42±2.61 56.72±10.86 46.24±3.91
3 讨论
NO是新被发现的细胞内和细胞间的信息传递分子,也是一种内皮舒张因子,由内皮细胞产生并持续释放,体内多种生理和病理活动受到它的调节和参与,NO具有扩血管、抑制血管平滑肌增生、抑制血小板聚集,缓解血细胞间及其与血管内皮之间的粘连,有助于改善血流,在病理情况下可被异常表达,介导广泛的毒性作用〔3,4〕。Batteur-Parmentier 等〔5〕的研究表明:短暂性局灶性缺血性损伤与白细胞-内皮细胞黏附有关,这都是由NO的水平下降或NO合酶受抑制导致的。Laufs等〔6〕研究表明,缺乏内皮型NO合酶的小鼠大脑中动脉闭塞后,梗死面积较对照组更大,脑血流是由血管内皮衍生的NO调节的,NO的基础释放可通过疏通组织灌注、抑制白细胞-内皮细胞黏附和抗血小板凝集等限制缺血性脑损伤。ET是血管内皮细胞分泌和释放的含21个氨基酸的多肽,它具有强烈缩血管效应,是一种内源性致损伤因子,是机体在严重缺血、缺氧状态下产生的〔7〕。动物研究结果表明:ET表达过量时,可显著破坏血脑屏障,增加脑组织缺血,水肿,进一步提高脑梗死体积〔8,9〕。脑梗死急性期,无论是局部病变,全身ET水平或增加,可引起血管收缩,使病变进一步降低局部血流量,从而增加了缺血性脑损伤的脑区和神经元。NO和ET的生理作用是相互拮抗的,它们之间存在着负反馈调节机制,他们共同调节脑血管的舒缩功能。在正常情况下,脑血管内ET和NO的表现为动态平衡状态,维持正常的血管收缩和舒张〔10〕。急性脑梗死的中ET,NO含量的异常,ET与NO的平衡损失,导致脑血管舒缩功能障碍,血管内皮细胞损伤和通透性改变,改变了血流动力学,影响了脑梗死的发病和发展。本研究表明脑局部亚低温治疗脑梗死能抑制ET的生成与释放,诱导生成具有扩张血管、改善脑灌注等功效的NO,保护血管内皮细胞功能、维护内皮细胞分泌的ET、NO处于动态平衡状态,从而对脑缺血损伤起到保护作用。
迄今为止,国内外大多学者认为,脑缺血后亚低温治疗越早越好,但对亚低温具体的时间窗及时程尚无明确的定论,汪云春等〔11〕的动物研究发现:亚低温治疗时间窗必须在缺血后30 min内,且至少维持3 h才能发挥良好的脑保护作用,并且推测亚低温最佳持续时间可能为48 h,在病情严重者亚低温的时程可相应延长。本研究的患者大多在发病后24 h以内入院,亚低温实施时间为2~24 h,维持时间为48 h,本研究结果显示,越早给予亚低温治疗,越有利于神经功能的恢复,但具体的治疗时间窗及时程有待进一步研究。
本研究结果表明局部亚低温治疗有保护脑梗死周围半暗带脑组织的功能,对神经功能的恢复有促进作用,能显著改善急性脑梗死病人的预后,同时避免了全身亚低温所带来的各种并发症,为制定临床治疗策略提供了依据。
1 张志琳,霍红梅,王运良,等.进展性脑卒中患者内皮素、一氧化氮含量的变化〔J〕.河南实用神经疾病杂志,2004;7(4):8-9.
2 中华神经科学会.各类脑血管疾病诊断要点〔J〕.中华神经内科杂志,1996;29(6):379.
3 Spinnenye B,Cornet S,Auquet M,et al.Synergistic protective effects of antioxidant and nitric oxide synthase inhibitor in transient focal ischemia〔J〕.J Cereb Blood Flow Metab,1999;19(1):139.
4 姜德华,金男革,幺汉石,等.大鼠急性局灶性脑缺血再灌注脑组织NO含量和NOS活性的变化〔J〕.临床神经病学杂志,2000;13(2):201-2.
5 Batteur-Parmentier S,Margaill I,Plotkine M.Modulation by nitric oxide of cerebral neutrophil accumulation after transient focal ischemia in rats〔J〕.J Cereb Blood Flow Metab,2000;20(8):812-9.
6 Laufs U,Endres M.Stagliano N,et al.Neuroprotection mediated by changes in the endothelial actin cytoskeleton〔J〕.J Clin Invest,2000;106(1):15-24.
7 Tayag EC,Katolik LI,Lin RCS,et al.Endothelin-1 and endothelin converting enzyme-1 following experimental traumatic brain injury in the rat〔J〕.J Neurotrauma,1995;12(6):992-4.
8 Eeung JWC,Ho HCY,Lo HCY,et al.Endothelial cell-specific over-expression of endothelin-1 leads to more severe cerebral damage following transient middle cerebral artery occlusion〔J〕.J Cardiovascpharmacol,2004;44(2):293-300.
9 Lo ACY,Chung SSM,Chung SK.Endothelin-1 over-expression leads to blood-brain barrier disruption resulting in increased infarct and edema after focal ischemia〔J〕.J Neurochem,2003;87(1):142.
10 Noiri E.Permissive role of nitric oxide in endothelin induced migration of endothelial cells〔J〕.J Biol Chem,1997;272(3):1747.
11 汪云春,付铁娟,赵智宇,等.亚低温对大鼠局灶性脑缺血氧自由基和一氧化氮的影响〔J〕.中国老年学杂志,2007;27(5):991-2.
