磷酸化ERK1/2在6-OHDA致PC12细胞损伤中的作用
2012-09-12张一娜姜礼红
李 静 张一娜 范 鹰 马 兰 姜礼红 崔 璨 吴 博
(哈尔滨医科大学附属第二医院老年病科,黑龙江 哈尔滨 150086)
由于帕金森病(PD)的复杂性目前尚未发现理想的治疗方法,以阻止神经元退行性变,修复已损伤的神经元,临床上只能针对症状进行对症治疗,因此对帕金森病发病机制的研究依然非常重要。MAPK家族重要成员细胞外信号调节激酶(ERK1/2)研究得最早最深入。它在细胞分化、发育、存活及死亡等生理过程中发挥重要的调节作用。但ERK1/2在细胞凋亡性死亡时的变化及其意义却存在争议〔1〕。因此本研究拟在6-OHDA致PC12细胞损伤模型上,观察ERK通路的表达,并引入特异性的抑制剂U0126和PD98059以探讨ERK通路在帕金森病发病中的作用。
1 材料与方法
1.1 材料 PC12细胞,胎牛血清、DMEM(美国Invitrogen公司),6-OHDA、MTT、U0126 和 PD98059(英国 Sigma-Aldrich 公司),一抗总 ERK1/2(L34F12,鼠单克隆),p-ERK1/2(Thr202/Tyr204,兔多克隆)(美国CST公司),Odyssey IRDye 800 nm荧光抗兔二抗、Odyssey IRDye 700 nm荧光抗鼠二抗(美国Li-COR Biosciences公司),Hoechst 33258染色试剂盒购自碧云天公司。其他均为国产分析纯。
1.2 细胞培养 复苏冻存的PC12细胞,接种于含5%胎牛血清的DMEM培养基中,在5%CO2,37℃的培养箱内进行培养,隔天换液并传代。用0.05%的胰蛋白酶消化使细胞从瓶壁上分离下来,以1∶3~1∶4传代,当细胞进入对数生长期即进行实验。接种于培养瓶、96孔板用于实验。
1.3 MTT法 将细胞分为 4组,对照组、6-OHDA组、PD98059+6-OHDA组、U0126+6-OHDA组。将PC12细胞的单细胞悬液以2×104个/孔密度接种于96孔培养板中。对照组加入维生素C溶液,6-OHDA组加入6-OHDA,使6-OHDA终浓度分别为 25、50、100、150、200 和 400 μmol/L,U0126+6-OHDA组加入U0126(10 nmol/L)处理1 h后加入6-OHDA终浓度为100 μmol/L,PD98059+6-OHDA 组加入 PD98059处理 1 h加入6-OHDA 终浓度为 100 μmol/L,于 37℃、5%CO2孵箱中培养。给药后于第24小时检测。每孔加入10 μl MTT溶液(5 mg/ml),37℃继续孵育4 h。终止培养后,小心吸弃孔内培养上清液。每孔加入100 μl DMSO,振荡10 min,以终止反应并充分溶解甲臜颗粒。选择570 nm波长,在酶标仪上测定各孔吸光度值(OD),实验组与对照组均设5个复孔,采用组间比较的t检验法进行统计学分析。整个实验重复3次。
1.4 免疫印迹法检测ERK1/2和磷酸化ERK1/2表达 实验设正常对照组和 6-OHDA(100 μmol/L)处理 2、6、12、24、48 h组,以及U0126+6-OHDA组和PD98059+6-OHDA组。处理后收集细胞,离心 10 min,以PBS洗2次,用100 μl细胞裂解液于冰浴裂解1 h,离心5 min,收集上清。经BCA法进行蛋白定量后以10%SDS-PAGE凝胶电泳分离蛋白质。电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭后,分别加入1∶1 000稀释的鼠抗人ERK1/2、单克隆抗体,以1∶1 000稀释的兔抗人p-ERK1/2多克隆抗体,GAPDH作为内参照,4℃培育过夜,PBST洗涤3次,加1∶5 000稀释的荧光标记二抗,37℃反应1 h,TBST洗涤3次,采用Odyssey双色红外线荧光成像系统(LI-COR公司)扫描图像入计算机,并进行分析。实验重复3次。
1.5 Hoechst 33258染色 按前述方法培养PC12细胞,并用6-OHDA处理,于培养后24 h进行检测。将生长良好的PC12细胞用D-Hanks液清洗2次,在细胞培养皿上直接染色,加入Hoeehst33258(终浓度为10 mg/ml),37℃染色10 min。清洗5次,在荧光显微镜下观察。
1.6 统计学分析 采用SPSS13.0软件进行统计分析,计量资料以±s表示,采用t检验和方差分析。
2 结果
2.1 6-OHDA作用后PC12细胞观察 6-OHDA作用后PC12细胞的相差显微镜图片显示,正常对照组的细胞胞膜完整,胞质丰富,细胞连接广泛,可见细胞突起;随着6-OHDA剂量的加大,细胞数目和细胞间连接胞质浓缩与胞膜破裂、胞质内容物外溢逐渐增多,6-OHDA的高剂量组活细胞数目少,细胞间连接中断,细胞肿胀和细胞皱缩并存。见图1。
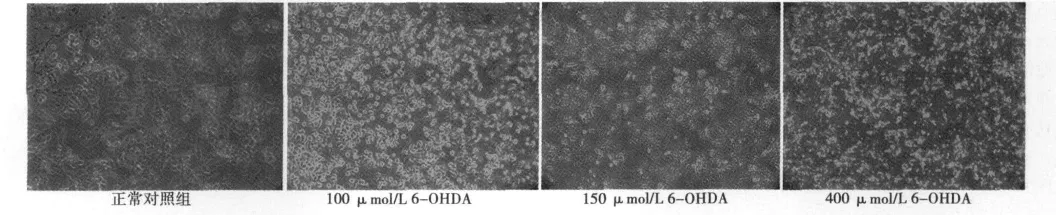
图1 6-OHDA作用后PC12细胞形态观察(×100)
2.2 MTT法检测6-OHDA对 PC12细胞的作用 25、50、100、150、200和400 μmol/L 6-OHDA分别与 PC12细胞共同孵育24 h后,细胞存活率分别为:(0.683±0.039)、(0.597±0.054)、(0.482±0.009)、(0.403±0.010)、(0.068±0.008)、(0.019±0.004),逐渐降低并呈剂量依赖性。同一时间,药物浓度越大,细胞活性下降越明显。6-OHDA处理24 h后半数致死量107 μmol/L,以后实验我们应用6-OHDA的浓度为100 μmol/L。浓度为200 μmol/L和400 μmol/L时,细胞存活率进一步降低与对照组相比差异非常显著(P<0.05)。
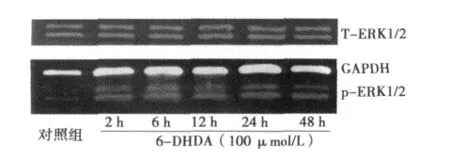
图2 6-OHDA作用后PC12细胞ERK1/2的表达
2.3 6-OHDA对PC12细胞ERK1/2和p-ERK1/2表达的影响
6-OHDA作用后PC12细胞ERK1/2磷酸化蛋白电泳结果见图2。6-OHDA 作用后 PC12细胞 2、6、12、24 h及 48 h后,ERK1/2蛋白磷酸化水平开始明显变化,分别为:(1.114±0.199)、(1.171±0.128)、(0.887 ±0.091)、(1.097 ±0.164)、(0.776±0.052),2 h ERK1/2磷酸化开始明显升高(P<0.01),且一直持续到48 h仍然有较高水平磷酸化,对照组为(0.332±0.046)。
2.4 U0126,PD98059减轻ERK1/2磷酸化和PC12细胞损伤
提前1 h加入U0126和PD98059可以分别减轻6-OHDA(100 μmol/L)对PC12细胞的毒性作用,PC12细胞生存率分别为:(0.589±0.063)和(0.622±0.047),较单用6-OHDA引起的细胞生存率明显增加〔(0.486±0.045),P<0.05〕,而U0126和PD98059两者之间无统计学意义。U0126和PD98059对PC12细胞有保护作用(F=142.565,P=0.000)。见图3。
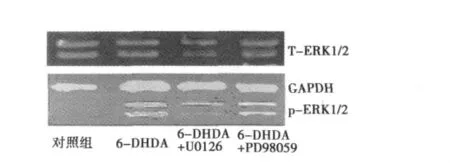
图3 U0126,PD98059对6-OHDA作用PC12细胞ERK1/2磷酸化变化
3 讨论
6-OHDA是多巴胺能神经递质的羟基化衍生物,其结构与多巴胺类似,通过自氧化产生泛醌和一系列氧自由基,如过氧化氢(H2O2),启动细胞氧化应激,引起多巴胺能神经元的凋亡,常用于制造体内外模型研究PD神经变性的潜在机制。PC12细胞来源于大鼠嗜铬细胞瘤的无性系,当生长在血清充足的培养基时拥有正常嗜铬细胞的许多特征,如能合成多巴胺和去甲肾上腺素。PC12细胞拥有多一种多巴胺转运体,可以向细胞内转运6-OHDA和多巴胺。6-OHDA通过调整细胞信号传导通路引起氧化应激而致病。因而我们选取PC12细胞和6-OHDA为研究对象,通过探讨6-OHDA的细胞毒性可能的信号转导位点并进行干预研究。
ERK1/2是细胞信号传导通路中的重要成员,其活化在细胞增殖和分化等关键过程中发挥了重要的作用,一直以来被认为是起保护作用的激酶,很多神经保护/营养因子,如脑源神经营养因子及胶质细胞系神经营养因子,主要通过ERK传递信号,后者经历双磷酸化而活化,经核转位发挥保护多巴胺能神经的作用〔2〕,产生诸如分化、神经保护等有益反应。但是近年来有研究表明,6-OHDA可以诱导线粒体ERK1/2激活〔3〕同时还发现在SH-SY5Y细胞系中6-OHDA可诱导线粒体内ERK2活化后导致细胞自噬死亡〔4〕。因此认为它与细胞损伤密切相关,我们发现6-OHDA还诱导ERK1/2在PC12细胞胞浆中持续激活,可直接导致对多巴胺能神经元的毒性这与国外一些研究和我们以往的研究结果相符合〔5,6〕,但6-OHDA如何诱发持续性ERK1/2磷酸化尚待进一步探讨。
本文结果提示ERK1/2活化可能参与6-OHDA介导的PC12细胞损伤过程。当然PD的病理过程复杂,是多因素共同作用的结果,除ERK1/2因素外,是否还有其他因素和途径共同影响神经元变性损伤尚未完全清楚。ERK1/2通路具体传导因素也还有待进一步研究。
1 Cagnol S,Chambard J.ERK and cell death:mechanisms of ERK-induced cell death-apoptosis,autophagy and senescence〔J〕.FEBS,2010;277(1):2-21.
2 Choi-Lundberg D,Lin Q,Chang Y,et al.Dopaminergic neurons protected from degeneration by GDNF gene therapy〔J〕.Science,1997;275(5301):838 41.
3 Kulich SM,Horbinski C,Patel M,et al.6-Hydroxydopamine induces mitochondrial ERK activation〔J〕.Free Radic Biol Med,2007;43(3):372-83.
4 Dagda RK,Zhu J,Kulich SM,et al.Mitochondrially localized ERK2 regulates mitophagy and autophagic cell stress:implications for Parkinson's disease〔J〕.Autophagy,2008;4(6):770-82.
5 Jun Chen,Milan Rusnak,Paul J,et al.Dopamine promotes striatal neuronal apoptotic death via ERK signaling cascades〔J〕.Eur J Neurosci,2009;29(2):287-306.
6 范 鹰,张一娜,张艳桥,等.蛋白激酶C亚型磷酸化参与6羟基多巴胺对SH-SY5Y细胞的毒性作用〔J〕.中华医学杂志,2006;86(45):3173-76.
