血栓调节蛋白在糖尿病大鼠心肌中的表达及意义
2012-09-12董志恒北华大学基础医学院细胞生物教研室吉林吉林3203
张 雷 董志恒(北华大学基础医学院细胞生物教研室,吉林 吉林 3203)
糖尿病(DM)的慢性并发症累及全身各个系统,其中糖尿病性心肌病(DCM)危害最大。研究显示,长期的高血糖可引起各种组织蛋白非糖氧化,脂质堆积产生的大量中间产物和自由基诱发各级血管内皮损伤〔1〕。糖基化终末产物的形成促使多种细胞因子与生长因子的释放与表达,增加血管内皮细胞通透性及单核细胞趋化性,加重了管壁炎症反应和血管增生,引发了微循环障碍和心肌纤维细胞的增殖〔2〕。因此对于血管内皮细胞损伤及内皮细胞释放的细胞因子的研究将为DCM的发病机制及防治提供可靠的理论依据,其意义重大。血栓调节蛋白(TM)是存在于内皮细胞表面的一类糖蛋白,对血管内凝血的调节起重要作用。在各种引起血管内皮损伤的病理情况下,由损伤的血管内皮细胞释放TM,因此TM被认为是血管内皮细胞损伤的一个分子标志物〔3〕。国外有研究〔4〕提出血糖水平的波动与血管内皮损伤显著相关,同时研究表明2型DM患者TM水平显著升高,TM的水平与病情呈正相关〔5〕。国内学者研究发现〔6〕,TM在DM出现并发症时显著升高,随病情进展,血管内皮损伤的加重,TM大量释放入血,而凝血功能严重障碍加重了DM并发症。虽然目前TM在DCM时的作用尚不清楚。基于以上所述,本实验以TM为研究指标,通过观察TM在DM大鼠心肌组织中的表达,初步探讨其在DCM发生、发展过程中的可能作用,为进一步阐明DCM发病机制提供理论依据和防治的新靶标。
1 材料与方法
1.1 实验动物 选用普通级、健康SD雄性大鼠50只,6周龄,体重(220±20)g,由吉林大学动物实验中心提供。大鼠精神状态良好,反应灵敏,皮毛光泽,饮食正常。大鼠在通风及光线良好、环境卫生、温湿度适宜的饲养环境下适应性喂养1 w后,进入实验。实验期间动物饲料为鼠用常规饲料。
1.2 方法
1.2.1 试剂与仪器 链脲佐菌素(STZ)为美国Sigma公司产品。乐康全血糖检测仪及试纸条为德国罗氏诊断公司生产。血糖高灵敏度试剂盒采用长春汇力生物工程技术开发中心生产的试剂盒。Whatman PCR扩增仪为德国产品。引物序列由上海生工生物工程有限公司合成。免疫试剂盒为北京中杉生物技术公司提供。逆转录酶试剂盒由Invitrogen公司生产。DNA Marker(DL-2000)由Takara公司提供。
1.2.2 模型的制备与分组 50只健康SD雄性大鼠适应性喂养1 w后随机分为正常对照组(C组)及糖尿病组(DM组),其中C组18只,DM组32只。DM组大鼠禁食 12 h后,按55 mg/kg一次性腹腔注射 STZ溶液(临用前用0.1 mol/L、pH4.2枸橼酸缓冲液溶解),C组腹腔注射等量0.1 mol/L枸橼酸缓冲液。72 h后测定空腹血糖及尿糖定性,空腹血糖≥16.7 mmol/L,尿糖定性≥,动物多饮、多食、多尿者确定为DM模型。造模完成后,除去造模失败及死亡大鼠共20只造模成功大鼠完成实验。分别于2、8、12 w末将大鼠分批处死:2 w末(模型组7只、正常组6只);8 w末(模型组7只、正常组6只);12 w末(模型组6只、正常组6只)。每日观察大鼠进食、饮水、毛色等一般情况,每周固定时间测量体重、血糖、尿糖。
1.2.3 标本采集及制备
1.2.3.1 光镜标本 分别在2、8、12 w末进行标本收集。在标本收集前两组大鼠禁食、禁水12 h,处死前称体重。所有大鼠乙醚麻醉处死,眶后静脉采血后,开胸取心脏,用生理盐水清洗吸干称重后,将留取的光镜标本立即置入10%中性甲醛液固定48 h,常规制备石蜡切片。连续4 μm切片,进行HE、PAS及免疫组化染色。
1.2.3.2 电镜标本 将留取的小块心肌在0.2 mol/L二甲砷酸钠缓冲液(pH7.4,含2.5%戊二醛)中细切,4%戊二醛前固定,1%锇酸后固定1 h,包埋、聚合后制备成超薄切片,电子染色,透射电镜观察心肌超微结构,摄片。
1.2.4 血糖及血脂测定 采用葡萄糖氧化酶法测定血糖;采用日立7150型自动生化分析仪测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)含量。
1.2.5 心脏指数 将两组大鼠心脏称重。计算公式如下:心脏指数=心脏重量/体重。
1.2.6 TM mRNA测定 取速冻大鼠心肌组织约100 mg,按Trizol试剂说明书方法提取心肌组织总RNA。取其中1 μg,进行RT-PCR反应。TM引物序列分别为:上游5'-CGGCTTCCAGTGGGTTAC-3';下游 5'-TTCCCGAGTCCAGTGTCT-3',扩增产物片段长度为401 bp。同时扩增β-actin,其引物序列分别为:上游 5'-ACAACCGTCATCGCCCACAT-3';下游 5'-ACTTCCCTGACCTTGCTAGT-3',扩增产物片段长度为540 bp。PCR变性、退火和延伸温度分别为94℃、55℃和72℃,反应时间分别为45、45和60 s,共进行30个循环。循环完毕再72℃ 延伸10 min。PCR产物用2%琼脂凝胶电泳分析,电泳后在紫外灯下拍摄照片,然后用凝胶成像处理系统对每一标本的PCR产物扩增的特异性片段进行灰度扫描,以β-actin密度作为参考定量标准,数值以两者之积分吸光度的比值表示,以对照组的比值作为标准1.0。
2 结果
2.1 一般状态及心脏指数
2.1.1 大鼠一般情况观察 正常对照组大鼠精神状况良好,毛色白、有光泽,反应灵敏、动作自如,饮食水正常,实验期间未有死亡。模型组大鼠逐渐出现精神萎靡,多饮、多食、多尿等典型糖尿病症状。前期(2 w)模型组与正常组相比饮水量并无明显变化,后期(8、12 w)模型组每只大鼠每天饮水量多于120 ml,每天需换垫料一两次。模型组早期多动,后期反应迟钝,动作迟缓,弓背曲体,毛竖无光泽,部分出现烂尾、烂趾、白内障等症状。整个实验过程中3只大鼠造模失败被淘汰,9只模型组大鼠(1 w 3只,4 w 1只,11 w 2只,12 w 3只)死亡。
2.1.2 大鼠心脏指数变化 与相应C组相比,2 w末DM组大鼠心脏指数无统计学差异(P>0.05);8、12 w末DM组大鼠心脏指数明显增加(P<0.01)。与2 w末DM组大鼠比较,8、12 w末DM组大鼠心脏指数差异显著(P<0.01)。12 w末与8 w末DM组相比,心脏指数显著增加(P<0.01)。上述结果提示,8、12 w末DM组大鼠已经出现心肌纤维化,心肌肥厚,见表1。
表1 各时段各组大鼠心重、体重、心脏指数比较(±s)
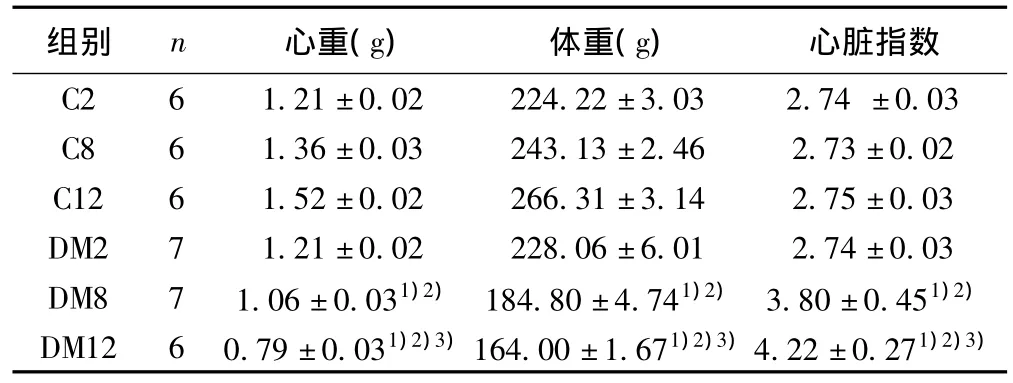
表1 各时段各组大鼠心重、体重、心脏指数比较(±s)
与相应C组比较:1)P<0.01;与2 w末DM组比较:2)P<0.01;与8 w末DM组比较:3)P<0.01
组别 n 心重(g) 体重(g)心脏指数C2 6 1.21±0.02 224.22±3.03 2.74 ±0.03 C8 6 1.36±0.03 243.13±2.46 2.73±0.02 C12 6 1.52±0.02 266.31±3.14 2.75±0.03 DM2 7 1.21±0.02 228.06±6.01 2.74±0.03 DM8 7 1.06±0.031)2) 184.80±4.741)2) 3.80±0.451)2)DM12 6 0.79±0.031)2)3)164.00±1.671)2)3)4.22±0.271)2)3)
2.2 大鼠生化指标的变化 与C组比较,DM组血糖、血清TC、TG、LDL均显著升高,而HDL降低(P<0.01),提示DM 组大鼠伴有明显的糖、脂代谢紊乱,见表2。
2.3 形态学观察
2.3.1 HE染色显示 正常对照组大鼠心肌细胞排列整齐,横纹清晰,细胞核呈椭圆形,大小均一,位于中央,胞浆染色均匀,闰盘未见异常。2 w末模型组未见明显病理改变。8、12 w末模型组心肌细胞肥大、排列紊乱,胞浆疏松化,细胞核大小不甚规则,细胞外间质增多。8 w末较12 w末病理变化略轻。
2.3.2 电镜下 正常对照组大鼠心肌细胞排列整齐,细胞连接清晰,肌丝排列规整,明暗带清晰;细胞核呈卵圆形,核仁清晰可见;线粒体结构清晰,异染色质成簇状聚集,细胞间质可见少量胶原纤维。2 w末模型组未见明显病理变化。8、12 w末模型组心肌细胞排列紊乱,肌丝溶解、断裂、稀疏,线粒体肿胀、变形,嵴排列紊乱,部分线粒体破裂,肌浆网扩张,闰盘扭曲模糊断裂,间质可见大量胶原纤维分布;8 w末电镜病变较12 w为轻,见图1。
2.4 TM蛋白表达 免疫组化显示,正常对照组心肌细胞内可见少量稀疏的浅棕色颗粒,主要定位于胞质,呈弱阳性表达。模型组阳性表达明显增多,其中2 w末可见细颗粒状棕黄颗粒弥散分布于部分心肌细胞胞质内;8、12 w末胞质内可见浓密的深棕色颗粒;统计分析显示模型组间阳性表达由低到高顺序依次是 2、8 和12 w 末,见表3,图2。
表2 各时段各组大鼠血糖、TC、TG、LDL、HDL比较(±s,mmol/L)
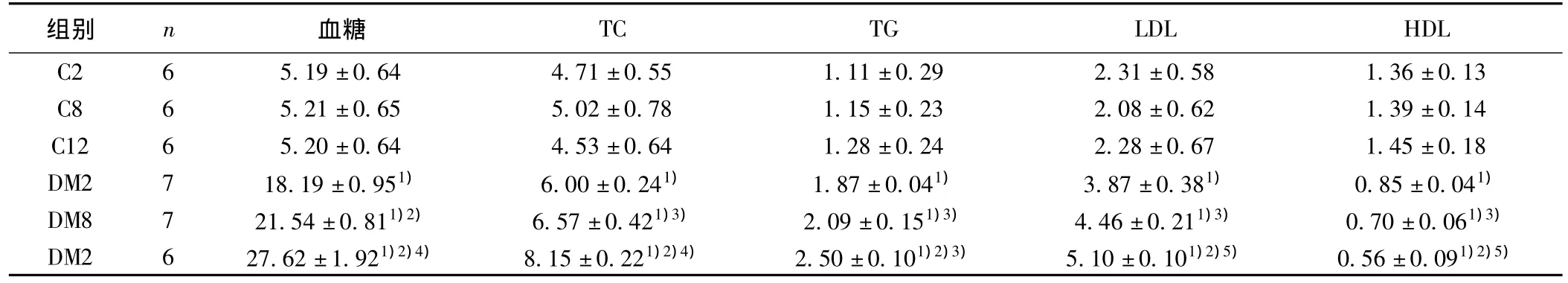
表2 各时段各组大鼠血糖、TC、TG、LDL、HDL比较(±s,mmol/L)
与C组比较:1)P<0.01;与DM2组比较:2)P<0.01,3)P<0.05;与DM8组比较:4)P<0.01,5)P<0.05
组别 n 血糖TC TG LDL HDL C2 6 5.19±0.64 4.71±0.55 1.11±0.29 2.31±0.581.36±0.13 C8 6 5.21±0.65 5.02±0.78 1.15±0.23 2.08±0.62 1.39±0.14 C12 6 5.20±0.64 4.53±0.64 1.28±0.24 2.28±0.67 1.45±0.18 DM2 7 18.19±0.951) 6.00±0.241) 1.87±0.041) 3.87±0.381) 0.85±0.041)DM8 7 21.54±0.811)2) 6.57±0.421)3) 2.09±0.151)3) 4.46±0.211)3) 0.70±0.061)3)DM2 6 27.62±1.921)2)4) 8.15±0.221)2)4) 2.50±0.101)2)3) 5.10±0.101)2)5) 0.56±0.091)2)5)
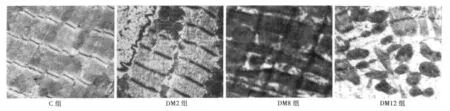
图1 各组大鼠心肌组织超微结构变化(×10 000)
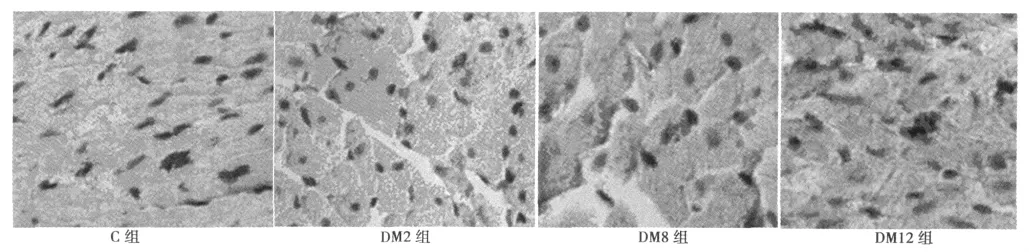
图2 各组大鼠心肌组织TM免疫组化染色(×400)
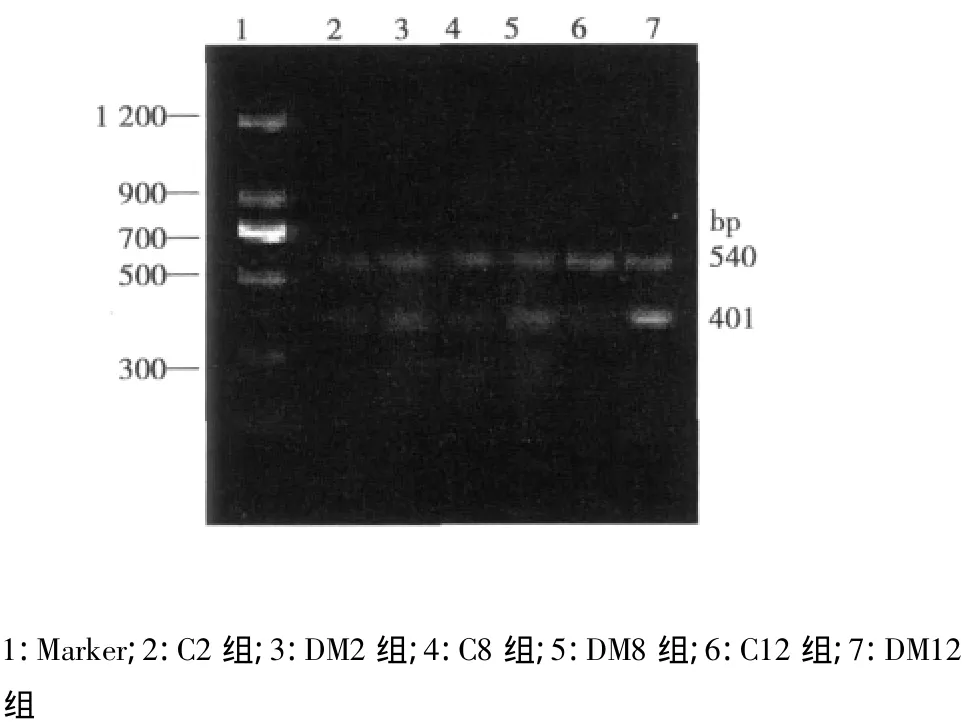
图3 大鼠心肌组织TM mRNA的PCR的电泳图
2.5 TM mRNA表达 与正常对照组相比,2、8、12 w末模型组心肌组织TM mRNA表达明显增高(P<0.01);随病程发展,TM mRNA表达由低到高顺序依次为2、8、12 w末,见表3,图3。
表3 各时段各组大鼠心肌组织TM蛋白及mRNA表达(±s)
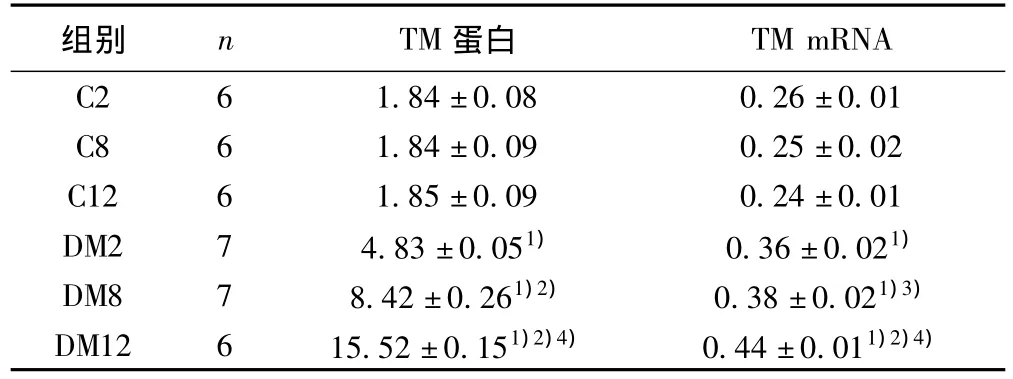
表3 各时段各组大鼠心肌组织TM蛋白及mRNA表达(±s)
与C组比较:1)P<0.01;与DM2组比较:2)P<0.01,3)P<0.05;与DM8组比较:4)P<0.01
组别 n TM蛋白TM mRNA C2 6 1.84±0.08 0.26±0.01 C8 6 1.84±0.09 0.25±0.02 C12 6 1.85±0.09 0.24±0.01 DM2 7 4.83±0.051) 0.36±0.021)DM8 7 8.42±0.261)2) 0.38±0.021)3)DM12 6 15.52±0.151)2)4) 0.44±0.011)2)4)
3 讨论
DCM主要病理改变为心肌细胞肥大、凋亡,心肌间质纤维化,心肌微循环障碍及心肌间质重构。长期高血糖所诱发的血管内皮损伤促使各种细胞因子的释放,引发了微循环障碍和心肌细胞的增殖,在DCM的发生发展中起着重要作用。
张芳林等〔7〕研究发现糖尿病SD大鼠成模8 w后心肌细胞凋亡、心脏舒张功能受损,提示糖尿病动物及患者早期即可发生心肌损伤。本研究通过测量STZ诱导的糖尿病大鼠心脏重量,并计算心脏指数发现,糖尿病大鼠8、12 w末心脏指数显著高于正常对照组。HE染色及电镜下显示,8、12 w末模型组均有心肌细胞肥大、排列紊乱,胞浆疏松样变,肌纤维排列紊乱、断裂、溶解,线粒体肿胀、变形,嵴排列紊乱,部分线粒体破裂,肌浆网扩张,间质内大量胶原纤维分布等病理变化,上述结果与穆松牛〔8〕、黄昶荃等〔9〕研究相一致,证实了DCM 的存在。
TM是血管内皮细胞的膜表面发现的一种糖蛋白,广泛分布在除中枢神经系统和肝窦外人体各组织器官的动、静脉、毛细血管及淋巴管内皮细胞内,血管内皮细胞受损时,TM脱落释放入血,参与调节血管紧张度与免疫反应〔10,11〕。大量研究发现〔12~15〕,DM时高血糖能直接抑制血管内皮细胞DNA合成,影响内皮细胞更新。慢性高血糖状态下,内皮细胞膜功能蛋白的非酶糖基化使细胞膜受损,高糖至局部血流淤滞,组织缺氧,自由基损伤内皮。此外,山梨醇代谢亢进、血管舒缩因子的不平衡及内皮细胞表面黏附因子增加等因素协同作用导致了糖尿病内皮损伤,而损伤的血管内皮细胞释放大量TM入血〔16〕。进一步研究发现〔17,18〕,DM时细胞膜上TM的植物血凝素被降解,细胞之间的信号途径被激活,有丝分裂原活化的蛋白激酶被磷酸化,细胞间黏附分子-1表达增加,促进白细胞黏附到内皮细胞表面,使白细胞运动停滞,引起毛细血管阻塞,内皮细胞功能失调,毛细血管无灌注和血管渗漏,导致组织循环淤滞和局部缺氧,最终微血管通透性增加和新生血管生成。本研究结果提示TM水平反映了DCM心肌血管病变程度,且与DCM的心肌病变呈正相关。结合上述研究结果进一步发现推测,TM在DCM心肌组织中的表达很有可能是DM时,高血糖引起的血管内皮细胞损伤使其脱落于细胞膜表面,并因微血管通透性增加、新血管形成等因素进入心肌细胞间质中,从而参与DCM的发生发展。
总之,DM心肌组织中TM表达状况可部分反映DCM发生及其严重程度,进一步深入研究其在体内的代谢和生理功能,可有利于解释DM心肌病变危险性增加的原因,这对探讨DCM的发病机制提供了新的靶向,对指导DCM的防治也有着极其重要的理论和临床意义。
1 耿 静,宋 敏,葛志明.糖尿病心肌病的研究进展〔J〕.中国心血管病研究杂志,2007;5(6):468-71.
2 蔡晓波,范建高.高血糖及肝硬化模型大鼠肝脏糖基化终末产物及其受体的表达〔J〕.中国肝病杂志,2007;12(2):121-2.
3 Yagmur E,Tacke F,Weiss C,et al.Elevation of Nepsilon-(carboxymethyl)lysine-modified advanced glycation end products in chronic liver disease is an indicator of liver cirrhosis〔J〕.Clin Biochem,2006;39:39-45.
4 Dong CM,Yoon WY,Goldschmidt-Clermont PJ.DNA methylation and atherosclerosis〔J〕.J Nutr,2002;132(8 Suppl):2406-9.
5 Yoshii Y,Okada Y,Sasaki S,et al.Expression of thrombomodulin in human aortic smooth muscle cells with special reference to atherosclerotic lesion types and age differences〔J〕.Med Electron Microsc,2003;36(3):165-72.
6 李翠玲,李金玲,谭红香.糖尿病患者血浆TM和TAT变化的临床意义〔J〕.中国乡村医药,2004;10:55-8.
7 张芳林.糖尿病性心肌病发病机理的研究进展〔J〕.国外医学·内分泌学分册,2002;22(4):245-7.
8 穆松牛,高 云.链脲佐菌素和高脂饮食诱导2型糖尿病中国地鼠模型的建立和稳定性观察〔J〕.中国比较医学杂志,2007;17(9):497-500.
9 黄昶荃,肖 谦,赵柯湘,等.2型糖尿病心肌病变模型建立方法的实验研究〔J〕.重庆医科大学学报,2007;32(1):15-7.
10 Seigneur M,Dufourcq P,Conni C,et al.Levels of plasma thrombomodulin are increased in atheromatous arterial disease〔J〕.Thromb Res,2001;71:423-31.
11 张 菁,沈 洪.急性心肌梗死患者冠脉再通后无复流与血栓调节蛋白的相关变化〔J〕.世界急危重病医学杂志,2006;3(6):1541-4.
12 Bastard JP,Pieroni L,Hainque B.Relationship between plasma plasminogen,activator inhibitor 1 and insulin resistance〔J〕.Diabetes Metap Res Rev,2002;16:192-201.
13 张 强,卢兴国,黄连生,等.血浆血栓调节蛋白与糖尿病血管病变的关系〔J〕.临床内科杂志,2000;17(4):223-4.
14 管 乐,郑少雄.糖尿病肾病患者血浆血栓调节蛋白和D-二聚体的变化及意义〔J〕.天津医药,2006;34(11):765-7.
15 徐 丽,杨庆才.糖尿病视网膜病变患者血中血栓调节蛋白水平研究〔J〕.临床眼科杂志,2004;12(3):201-3.
16 Aso Y,Matsumoto S,Fujiwara Y,et al.Impaired fibrinolytic compensation of hypercoagulability in obese patients with type 2 diabetes:association with increased plasminogen activator inhibitor-1〔J〕.Metabolism,2002;51:471-6.
17 Herrington DM,Reboussin DM,Brosnihan KB,et al.Effects of estrogen replacement on the progression of coronary artery atherosclersis〔J〕.N Engl J Med,2000;343:522-9.
18 吕小红.糖尿病患者血清血栓调节蛋白变化及临床意义〔J〕.山东医药,2006;46(25):33-4.
