小牛血清去蛋白注射液对大鼠局灶性脑缺血再灌注后Caspase-12表达的影响
2012-09-11闵鹤鸣鲁璐清姜兴千王文娟武晓宁罗玉敏闵连秋
闵鹤鸣 黄 澈 鲁璐清 姜兴千 王文娟 武晓宁 罗玉敏 闵连秋
(辽宁医学院基础学院,辽宁 锦州 121001)
内质网应激(ERS)介导的细胞凋亡是一种不同于经典凋亡途径的新的细胞凋亡途径〔1〕,它所引发的细胞凋亡是通过下游的调控信号分子产生的,其中一个重要的途径就是ERS介导的天冬氨酸特异性半胱氨酸蛋白酶-12(Caspases-12)途径〔2〕。研究表明Caspases-12与内质网的联系非常显著,且只有在ERS引发的细胞凋亡中起作用〔3〕。小牛血清去蛋白注射液(DCSI)的主要药理活性成分为磷酸肌醇寡糖(IPOs)和小分子激活肽〔4〕,对脑缺血再灌注损伤有一定的保护作用〔5,6〕,但其具体机制还不十分清楚。本实验拟探讨DCSI是否通过阻断ERS引发的细胞凋亡途径对脑缺血再灌注损伤大鼠产生保护作用。
1 材料与方法
1.1 动物与试剂 健康Sprague-Dawley(SD)大鼠,雌雄各半,共130只,体重(300±20)g,由辽宁医学院实验动物中心提供,许可证号:SCXK(辽)2003-0007。DCSI购自锦州奥鸿药业有限责任公司(商品名:奥德金;批号:20080810);Caspase-12兔抗大鼠抗体由北京博奥森生物有限公司提供;RT-PCR试剂盒由大连宝生物公司提供。
1.2 方法
1.2.1 分组与给药 健康SD大鼠随机分为假手术组(10只)、模型组(60只)和DCSI组(60只),每笼6只。DCSI组按照每日80 mg/kg的剂量于术前1 w开始经大鼠尾静脉注射给药,1次/d,末次给药时间在术前5 h;模型组和假手术组给予相同体积的生理盐水,疗程和给药方法与DCSI组相同。分别在脑缺血再灌注后3、6、12、24、48 h五个时间点进行神经缺损功能评分,然后处死大鼠,进行后续实验。
1.2.2 动物模型的建立 参照Longa等〔7〕方法加以改进制备大鼠大脑中动脉(MCA)局灶性脑缺血再灌注模型。模型成功的标准为大鼠清醒后出现左侧Horner征及对侧以前肢为主的瘫痪,神经行为学评分1~3分〔4〕。假手术组仅暴露颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),栓线插入CCA及ICA但不阻断MCA。采用Longa等〔7〕6级5分制评分标准进行神经行为学评估。
1.2.3 脑组织病理学观察 切片常规脱蜡水化,焦油紫染色。正常细胞不同程度的含有尼氏体,经焦油紫染色后呈蓝色,细胞凋亡后,细胞质内尼氏体可发生变化,甚至可以消失。
1.2.4 TUNEL检测大鼠海马细胞凋亡情况 切片常规脱蜡水化,3%H2O2室温处理后蛋白酶K 37℃消化10 min。标记液32℃标记2 h,后封闭30 min,生物素化地高辛抗体37℃反应37 min。加链霉亲和素-生物素复合物(SABC)、二氨基联苯胺(DAB)显色。常规封片,镜下观察,在海马CA1区和假手术组相应区域不重复随机选取5个高倍视野,计算阳性细胞百分比(阳性细胞数/计数细胞总数×100%)。
1.2.5 免疫组化检测大鼠海马Caspase-12抗原的表达 石蜡切片经常规脱蜡、复水,按照免疫组化试剂盒说明进行常规SABC法,阴性对照采用磷酸盐缓冲液(PBS)代替一抗。显微镜下观察大脑海马CA1区Caspase-12表达情况,染色阳性反应物为棕黄色颗粒。每只大鼠取1张脑组织切片,显微镜下定位,取缺血侧大脑海马CA1区观察,每张免疫组化切片中采集5个具有代表性的高倍视野,根据光镜400倍时阳性细胞计数,采用双盲法计算每个高倍镜视野Caspase-12阳性细胞数。
1.2.6 Western印迹检测大鼠海马Caspase-12蛋白的表达用10%的水合氯醛按350 mg/kg剂量腹腔注射麻醉动物,断头取脑。参照Ishige等〔8〕方法进行匀浆,上样,电泳,转膜,封闭,一抗、二抗孵育,洗膜后进行增强化学发光法(ECL)反应,暗室曝光,显影后冲洗胶片。凝胶成像分析系统摄像分析测定目标带(IDV),计算出各组目标带与β-actin的比值。
1.2.7 RT-PCR检测大鼠海马Caspase-12 mRNA的表达 取冻存的脑组织置于离心管中,Trizol法抽提RNA。参照Bian等〔9〕方法构建反应体系。Caspase-12和β-actin基因全长检索自Pubmed GenBank,引物由南京金思特科技有限公司设计。Caspase-12上游引物:5'-CCTGGAAGGAATCTGTGG-3',下游引物5'-AGTTCACCTGGGACCTCA-3',预扩增片段438 bp。
β-肌动蛋白(β-actin)上游引物:5'-CCTAAGGCCAACCGTGAA-3',下游引物:5'-AGCCAGGGCAGTAATCTC-3',预扩增片段为630 bp。经30个循环后,取20 μl反应产物,加2 μl 10倍上样缓冲液,1%琼脂糖凝胶电泳,成像,测目的基因和β-actin的表达强度,以同一标本的β-actin产物强度值校正各目的基因的强度值,相对值=目的基因表达强度/β-actin表达强度。
1.3 统计学方法 应用SPSS17.0统计分析软件中的单因素方差分析,数据以的形式表示,组间差异比较采用t检验。
2 结果
2.1 DCSI对脑缺血再灌注后大鼠神经行为的影响 模型组和DCSI组大鼠清醒后出现不同程度的左侧Horner征及对侧以前肢为主的瘫痪,5个时间点神经行为学评分在1~3分,造模成功。假手术组神经行为学评分为0。与模型组比较,DCSI组各时间点症状相似,神经行为学评分相对较低,但无显著性差异(P>0.05)。见表1。
表1 各组大鼠脑缺血再灌注后各时间点神经行为学评分(分,)

表1 各组大鼠脑缺血再灌注后各时间点神经行为学评分(分,)
组别 模型组 DCSI组3 h 2.50±0.58 2.20±0.45 6 h 2.40±0.55 2.00±0.63 12 h 2.50±0.58 2.25±0.50 24 h 2.67±0.58 2.25±0.96 48 h 2.40±0.89 2.25±0.50
2.2 DCSI对脑缺血再灌注后大鼠脑组织病理变化的影响大鼠海马CA1区脑组织病理学尼氏染色光学显微镜(×400)下观察。假手术组尼氏体清晰可辨,受染后呈块状,尼氏体大而数量多,反映神经元合成蛋白质的功能较强;模型组尼氏体减少甚至消失,表现为尼氏体从核周开始崩解为细尘状颗粒,并逐渐向外扩展,进而完全溶解消失,胞质着色浅,胞体肿胀,细胞由多极形变为圆形,胞核移位;DCSI组与假手术组比较各时间点有不同程度的尼氏体减少,但与模型组相比,神经元细胞中尼氏体明显增加,神经元细胞的损害相对较轻。见图1。
2.3 DCSI对脑缺血再灌注后大鼠海马CA1区神经细胞凋亡的影响 假手术组海马CA1区偶见细胞凋亡,推测是生理性死亡。脑缺血再灌注后模型组和DCSI组均可见神经细胞凋亡,除缺血再灌注3、6 h后凋亡细胞数无明显差异外,缺血再灌注12、24、48 h时DCSI组的凋亡细胞数均少于模型组(P<0.05,P<0.01)。见表2。
表2 三组大鼠脑缺血再灌注后神经细胞凋亡的变化(%,)

表2 三组大鼠脑缺血再灌注后神经细胞凋亡的变化(%,)
P1值:模型组与假手术组比较;P2值:DCSI组与模型组比较;下表同
组别 假手术组 模型组 P1值 DCSI组 P2值3 h 2.21±0.71 9.03±2.38 0.012 7.29±2.06 0.519 6 h - 19.85±2.01 0.000 17.95±3.75 0.435 12 h - 28.67±4.01 0.000 21.79±5.03 0.019 24 h - 54.50±3.71 0.000 44.42±4.75 0.002 48 h - 48.19±6.59 0.000 35.09±5.87 0.000
2.4 免疫组化检测大鼠脑缺血再灌注后Caspase-12抗原的表达 Caspase-12抗原阳性细胞呈棕黄色,细胞皱缩、变形,胞质胞核均有表达,但以胞核表达为主,多数细胞发生坏死的形态学改变,可见核固缩、核溶解。与假手术组相比,模型组和DCSI组Caspase-12抗原表达均明显增高(P<0.01);与模型组相比,除3 h、48 h两组差异不明显外,DCSI组其余各时间点Caspase-12抗原表达均明显低于模型组(P<0.01,P<0.05)。见表3。
表3 三组大鼠海马Caspase-12抗原的表达()
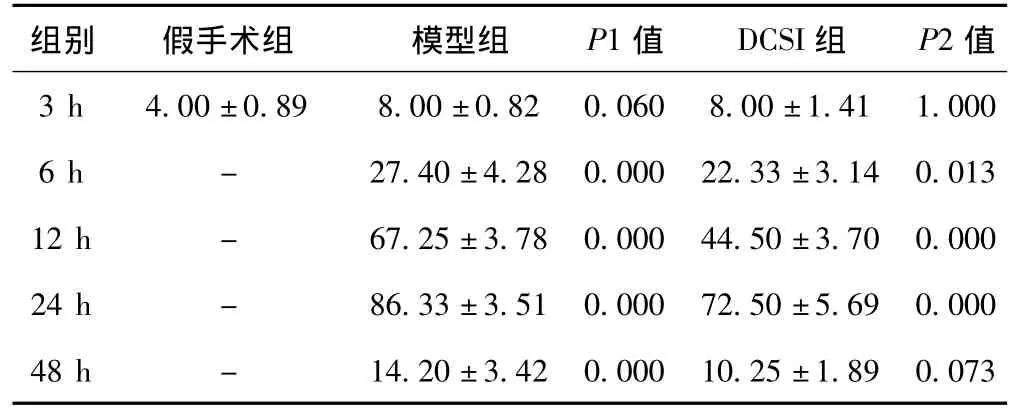
表3 三组大鼠海马Caspase-12抗原的表达()
组别 假手术组 模型组 P1值 DCSI组 P2值3 h 4.00±0.89 8.00±0.82 0.060 8.00±1.41 1.000 6 h - 27.40±4.28 0.000 22.33±3.14 0.013 12 h - 67.25±3.78 0.000 44.50±3.70 0.000 24 h - 86.33±3.51 0.000 72.50±5.69 0.000 48 h - 14.20±3.42 0.000 10.25±1.89 0.073
2.5 Western印迹方法检测各组大鼠海马Caspase-12蛋白的表达 Caspase-12蛋白在假手术组表达很少,缺血再灌注后各时间点表达逐渐增加,至24 h时达到高峰,然后逐渐下降,与假手术组相比,模型组和DCSI组表达均明显增加(P<0.01)。与模型组相比,DCSI组各个时间点Caspase-12蛋白表达相对较少(P<0.01)。见表4,图2。
2.6 RT-PCR检测大鼠脑缺血再灌注后Caspase-12 mRNA的表达 Caspase-12 mRNA在假手术组表达很少,缺血再灌注后随时间的延长表达逐渐增加,至24 h达到高峰后逐渐下降,与假手术组相比,模型组和DCSI组表达均明显增高(P<0.01);与模型组比较,DCSI组在除3 h外的各时间点Caspase-12表达均显著降低(P<0.01)。见表5,图3。
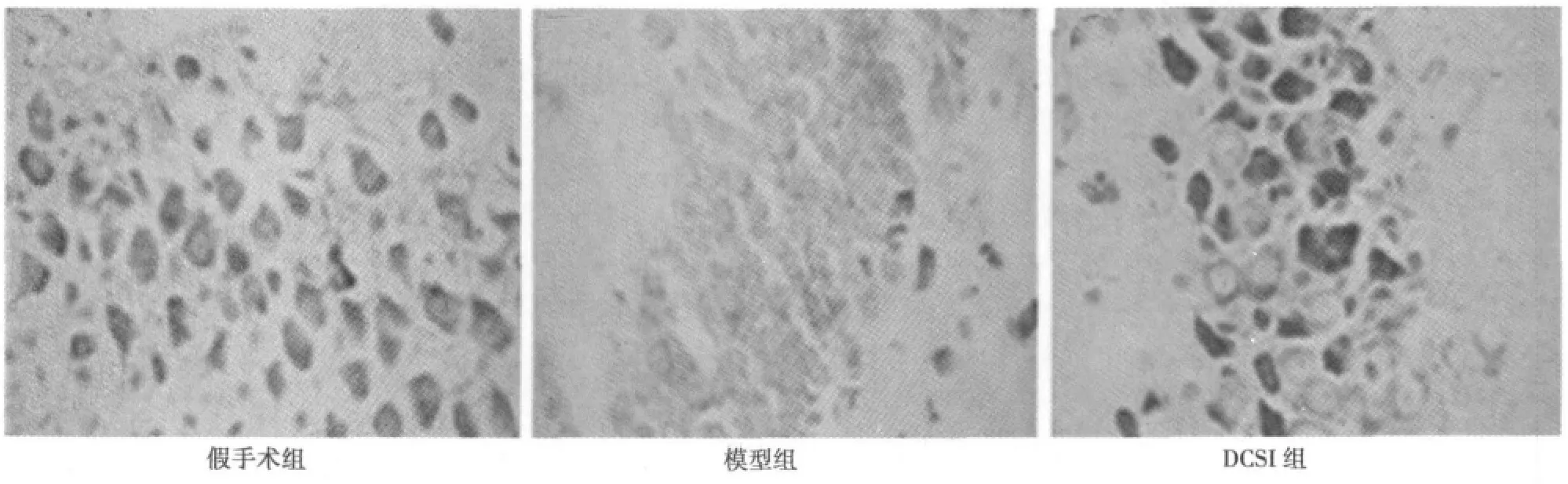
图1 DCSI对大鼠脑缺血再灌注后海马CA1区脑组织病理变化的影响(尼氏染色,×400)
表4 三组大鼠海马Caspase-12蛋白的表达(,×103)
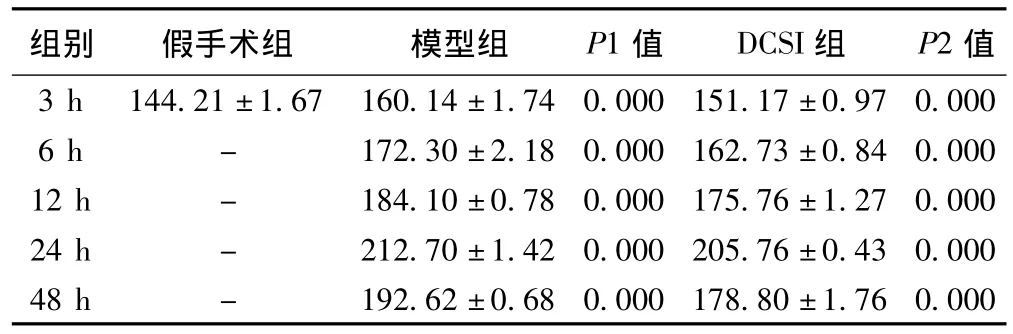
表4 三组大鼠海马Caspase-12蛋白的表达(,×103)
组别 假手术组 模型组 P1值 DCSI组 P2值7 0.000 6 h - 172.30±2.18 0.000 162.73±0.84 0.000 12 h - 184.10±0.78 0.000 175.76±1.27 0.000 24 h - 212.70±1.42 0.000 205.76±0.43 0.000 3 h 144.21±1.67 160.14±1.74 0.000 151.17±0.9 48 h - 192.62±0.68 0.000 178.80±1.76 0.000

图2 DCSI对大鼠脑缺血再灌注后海马CA1区Caspase-12蛋白表达的影响(Western印迹法)
表5 DCSI对脑缺血再灌注后Caspase-12 mRNA表达的影响()

表5 DCSI对脑缺血再灌注后Caspase-12 mRNA表达的影响()
组别 假手术组 模型组 P1值 DCSI组 P2值3 h 0.63±0.01 0.71±0.02 0.000 0.69±0.03 0.260 6 h - 0.78±0.04 0.000 0.73±0.01 0.001 12 h - 0.87±0.02 0.000 0.81±0.01 0.000 24 h - 0.95±0.01 0.000 0.86±0.02 0.000 48 h - 0.83±0.01 0.000 0.78±0.02 0.007
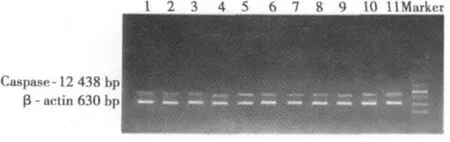
图3 DCSI对大鼠脑缺血再灌注后海马CA1区Caspase-12 mRNA表达的影响(RT-PCR)
3 讨论
缺血期间,特别是再灌注时,自由基的产生与内源性抗氧化系统失衡,会引起脑组织损伤。本研究参照Longa等〔7〕方法加以改进制备大鼠MCA局灶性脑缺血再灌注模型。大鼠清醒后出现左侧Horner征及对侧以前肢为主的瘫痪,5个时间点神经行为学评分在1~3分,模型成功。细胞和分子学水平结果显示,模型组大鼠缺血的海马神经细胞胞体肿胀,细胞由多极形变为圆形,胞核移位,尼氏体减少甚至消失,Caspase-12蛋白表达/基因转录明显上调,表现为细胞凋亡征象。
Caspases-12定位于内质网的外膜,是介导ERS凋亡的关键分子。Caspase-12缺陷鼠能抵抗ERS引起的凋亡,而其他死亡刺激仍可诱导其发生凋亡,表明Caspase-12与ERS介导凋亡的机制有关,而与非ERS介导的凋亡无关〔10〕。本研究发现,在脑缺血再灌注初期Caspase-12表达不明显,随着再灌注时间的延长逐渐升高,在24 h时达到高峰。分析可能在ERS初期,ERS诱导了未折叠蛋白质反应(unfolded protein response,UPR),形成自我保护通路〔11〕,但是当ERS的时间过长时,ERS就会启动凋亡途径,激活Caspase-12,表现为缺血再灌注后期Caspase-12的表达上调。以上机制尚待进一步研究,但可推测对其适当干预可能成为脑缺血再灌注损伤的潜在治疗靶点。本研究发现,与模型组相比较,无论在Caspase-12蛋白表达还是基因转录水平,DCSI组在各个时间点的海马组织内检测水平均较低,并且DCSI组大鼠的神经行为学改变相对较轻,反映细胞蛋白合成功能的尼氏体减少程度也较轻,细胞凋亡数明显减少,推测DCSI可能通过抑制Caspase-12的表达和活化,从而抑制由Caspase-12介导的内质网应激引起的神经元的损伤和凋亡,发挥神经保护作用。
1 Harding HP,Ron D.Endoplasmic reticulum stress and the development of diabetes:a review〔J〕.Diabetes,2002;51(3):455-61.
2 Nakagawa T,Yuan J.Cross-talk between two cysteine protease families.Activation of caspase-12 by calpain in apoptosis〔J〕.J Cell Biol,2000;150(4):887-94.
3 Nakagawa T,Zhu H,Morishima N,et al.Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-β〔J〕.Nature,2000;403(6765):98-103.
4 吕 媛,权菊香.小牛血清去蛋白注射液对脑细胞缺血缺氧的保护作用及临床应用〔J〕.中国临床药理学杂志,2006;22(2):141-4.
5 任淑萍,张 婕.小牛血清去蛋白注射液治疗脑血管病作用的研究进展〔J〕.中国医药导刊,2006;8(3):200-1.
6 赵 明,王洪新,王桂君,等.小牛血去蛋白注射液对大鼠脑缺血再灌注损伤的保护作用〔J〕.中国临床药理学与治疗学,2003;8(5):541-3.
7 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occusion without craniotecmy in rats〔J〕.Stroke,1989;20(1):84-91.
8 Ishige K,Takagi N,Imai T,et al.Role of caspase-12 in amyloid β-peptide-induced toxicity in organotypic hippocampal slices cultured for long periods〔J〕.J Pharmacol Sci,2007;104(1):46-55.
9 Bian ZM,Elner SG,Elner VM,et al.Expression of caspase-12 in human retinal pigment epithelial cells suggests its immunomodulating role〔J〕.Invest Ophthalmol Vis Sci,2008;49(12):5593-601.
10 关丽英,许彩民,潘华珍.内质网应激介导的细胞凋亡〔J〕.生物化学与生物物理进展,2007;34(11):1136-41.
11 Bertolotti A,Zhang Y,Hendershot LM,et al.Dynamic interaction of BiP and ER stress transducers in the unfolded-protein response〔J〕.Nat Cell Biol,2000;2(6):326-32.
