慢性低剂量LPS刺激对大鼠脑内黑质部小胶质细胞和多巴胺神经元的影响
2012-09-11任占秀罗晓光何志义
任占秀 曹 丹 高 超 罗晓光 任 艳 何志义
(中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
近年来,越来越多的研究者认为脑内炎症引起小胶质细胞的免疫反应可能是帕金森病(PD)发病机制的一个重要因素〔1〕。日常生活中,人们会遇到各种体内体外的有害刺激,这种外周的刺激会对中枢免疫系统产生影响〔2〕,使之激活。虽然每一次有害刺激不都是致病性的,但在反复多次非致病性有害刺激下,有可能会积累造成脑内免疫环境的改变,导致或促进了脑内慢性炎症过程,成为PD发病的基础〔3〕。既往的PD炎症动物模型研究,大多向黑质内单次注入致病剂量(>2 μg)的LPS〔4〕,模拟的是脑内急性炎症反应过程,不能真正反映PD的慢性炎症的病变环境。本实验向黑质内反复多次注入亚损伤剂量的LPS,力图以更接近PD自然病程的方式模拟脑内反复慢性炎症的过程,观察其对脑内慢性炎症环境形成的作用,以及对小胶质细胞形态和功能及多巴胺神经元存活的影响。
1 材料与方法
1.1 动物模型制作
1.1.1 实验材料及试剂 大鼠脑立体定位仪(日本NARISHIGE 公司,型号:SN-3),LPS(Sigma),PBS(Sigma),10% 水合氯醛。健康雄性SD大鼠两月龄 (体重200~250 g)(由中国医科大学动物部提供)30只。酪氨酸羟化酶(TH)抗体:Cell Signaling#2792,小胶质细胞(Iba1)抗体:日本 Roth公司 Code No.019-19741;SP试剂盒,福州迈新,大鼠抗兔/鼠。大鼠TNF-α、IL-1β ELISA试剂盒:博士德公司,武汉。
1.1.2 实验过程 30只SD大鼠随机分为LPS一次注射组、PBS四次注射组和LPS四次注射组。LPS一次注射组大鼠右侧黑质部注入 0.5 μg(0.25 μg/μl)LPS,LPS 四次注射组大鼠脑右侧黑质部注入 0.5 μg(0.25 μg/μl)LPS,PBS 四次注射组大鼠脑右侧黑质部注入等体积PBS,后两组每月注射一次,共注射四次。每只大鼠分别以10%水合氯醛腹腔注射麻醉。以前囟为标志确定黑质SN给药点的三维坐标图,即前囟后4.4 mm,中线右旁1.2 mm,硬脑膜下7.8 mm。将0.5 μg LPS或者2 μl PBS在10 min内缓慢注入黑质部,留针5 min后缓慢退出注射器。在每组最后一次注射后一个月,心脏灌流后固定取材。
1.2 切片制作及免疫组化染色 10%水合氯醛腹腔注射麻醉。左心室多聚甲醛灌流,迅速取脑,随后多聚甲醛后固定,二甲苯透明,包蜡,进行4 μm连续切片。染色时对照大鼠解剖图谱取包含黑质部位切片。每隔5张取一张片子,每组各取10张。常规脱水后,先经3%过氧化氢灭活内源性过氧化物酶活性,继之用高压锅法3 min抗原修复,自然晾凉至室温,山羊血清封闭15 min,弃去血清不洗。直接加TH一抗(1∶200)或Iba1一抗(1∶200)4℃过夜,二抗用大鼠抗兔/鼠SP试剂盒,TH用DAB显棕黄色,显微镜下控制显色时间,去离子水终止反应。中性树脂封片,Iba1用AEC显红色,直接水性封片剂封片。显微镜下观察。
ELISA法检测各组大鼠脑黑质部TNF-α、IL-1β炎症介质含量。动物处死后,迅速分离出大鼠左右脑黑质部,冰上操作,生理盐水冲去血液,放入EP管中,眼科剪子剪碎,匀浆器匀浆,分别按照TNF-α、IL-1β的ELISA试剂盒说明,在抗体包被的96孔板中分别加入倍比稀释的标准蛋白和待测样品,置于4℃摇床过夜,以试剂盒带的洗涤液洗涤,加入一抗,37℃ 2 h,洗涤,再加入HRP二抗,洗涤后TMB显色,以96孔酶标计数仪检测光密度值。
1.3 细胞计数 首先检查切片的对称性,切片左右不对称的大鼠切片不用于细胞计数,每只大鼠随机取包含黑质的中脑切片5张,在40倍显微镜下计数两侧黑质有完整细胞体的TH阳性细胞,计算各组与LPS一次注射组黑质TH阳性细胞数的百分比(各组黑质TH阳性细胞数/LPS一次注射组黑质TH阳性细胞数×100%),最后5张切片进行平均。同时在400倍显微镜下观察小胶质细胞形态。根据其形态分为3期:静止期(小细胞体,许多细小突起),激活期(细胞体变大,短粗突起),活化期(伪足或圆形细胞体无突起)。每张切片均由3人采用盲法进行计数。
2 结果
2.1 小胶质细胞形态学改变 见图1。
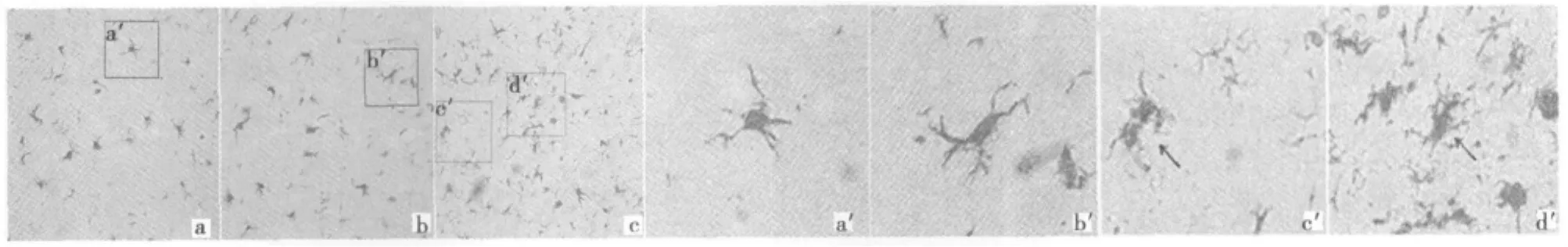
图1 各组黑质部小胶质细胞形态学改变(AEC显色,Iba1一抗1∶200)
2.2 各组多巴胺神经元生长情况 见图2。LPS一次注射组,多巴胺神经元分布形态完整,数量无减少,TH计数为186.4±3.7;PBS四次注射组,多巴胺神经元数量少量减少,TH计数为152.7±3.9,与LPS一次注射组的比值为81.9%,二组间比较无显著差异(P>0.05);LPS四次注射组多巴胺神经元数量显著减少,TH计数为95.5±6.9,与LPS一次注射组的比值为51.2%,二组间比较差异显著(P<0.05)。
2.3 ELISA检测结果 见图3。与LPS一次注射组相比,PBS四次注射组TNF-α、IL-1β含量略增加,但差异无统计学意义(P>0.05);LPS四次注射组TNF-α、IL-1β含量相对于LPS一次注射组及PBS四次注射组明显增多(P<0.05)。

图2 各组右脑黑质部多巴胺神经元免疫组化染色DAB显色(×40,TH 一抗1∶200)
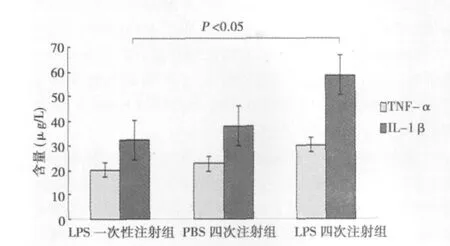
图3 各组黑质部炎性因子含量变化情况(ELISA法)
3 讨论
本文仅一次注入低剂量(0.5 μg)LPS后,黑质部小胶质细胞在一个月后呈正常静止状态,多巴胺神经元数量也没有减少,可见此剂量的LPS对小胶质细胞的功能形态及多巴胺神经元存活和脑内炎症环境没有太大影响。说明0.5 μg LPS对于本实验是一种亚损伤剂量。但在LPS四次注射组,炎性因子释放增多,提示脑内形成炎性环境,小胶质细胞形态发生明显改变,多巴胺神经元数量减少,说明反复多次注入低剂量LPS能够导致脑内慢性炎性环境,积累刺激使小胶质细胞形态及功能均发生改变,对多巴胺神经元产生毒害作用。
本实验中LPS四次注射组小胶质细胞形态学异常改变,符合功能障碍或老化小胶质细胞的特征〔5〕,功能障碍的小胶质细胞在退行性疾病进程中的作用已被许多证据证明〔6〕。因此我们推测,在本实验中,是这种形态异常的小胶质细胞参与了TH神经元的死亡。
已有实验证实大鼠脑内注射非致病剂量LPS不会对多巴胺神经元产生损害作用,但是可以增加多巴胺神经元变性的敏感性〔7〕,小胶质细胞的反复激活,会使小胶质细胞的端粒酶消耗,最终导致小胶质细胞衰老,产生功能障碍,发挥有害作用,使敏感的多巴胺神经元死亡。由于小胶质细胞对外界环境异常敏感,因此PBS四次注射组实际上模拟了四次机械性刺激,结果小胶质细胞形态学未见明显变化,多巴胺神经元数量相对于LPS一次注射组少量减少,炎性因子少量增加,虽然无统计学意义,但也从侧面说明非致病性刺激反复激活小胶质细胞,会导致小胶质细胞形态及功能发生改变。
小胶质细胞的激活主要产生两种神经炎性因子:TNF-α,IL-1β。TNF-α是炎症反应的启动物质,其释放失控,将产生更多炎症介质,并相互作用,形成炎性因子网络,参与机体炎症反应,使致炎因子与抗炎因子之间的平衡失调,炎症反应过度,实验表明脑内TNF-α表达增加对多巴胺神经元产生损害作用,而抑制TNF-α则对多巴胺神经元有保护作用〔8〕。IL-1β在炎症反应及其他疾病中,对生理和病理起着重要的调节作用,激活的小胶质细胞释放IL-1β介导细胞毒性作用促进神经元的慢性变性坏死。本实验中LPS四次注射组这两种炎性因子均增高,表明小胶质细胞异常激活对多巴胺神经元产生有害作用,异常释放的炎性因子发挥了重要作用。
1 Nehe R.Primary phagocytosis of neurons by inflammed microglia:potential roles in neurodegeneration〔J〕.Neuropharmacology,2012;27(1):1-9.
2 Liya Q.Systemic LPS causes chronic neuroinflammation and progressive neurodegeneration〔J〕.Glia,2007;55(5):453-62.
3Hernao¨ndez-Romero MC.Peripheral inflammation increases the deleterious effect of CNS inflammation on the nigrostriatal dopaminergic system〔J〕.Neurotoxicology,2012;33(3):347-60.
4 王普清,孙圣刚.黑质内注射脂多糖对多巴胺能神经元和小胶质细胞活性的影响〔J〕.中国康复,2008;23(6):380-1.
5 Streit WJ.Life and death of microglia〔J〕.Neuroimmun Pharmacol,2009;4(2):371-9.
6 Streit WJ.Dystrophic(senescent)rather than activated microglial cells are associated with tau pathology and likely precede neurodegeneration in Alzheimer's disease〔J〕.Acta Neuropathol,2009;118(3):475-85.
7 Koprich JB,Reske-Nielsen C.Neuroinflammation mediated by IL-1β increases susceptibility of dopamine neurons to degeneration in an animal model of Parkinson's disease〔J〕.J Neuroinflamm,2008;5(1):8-15.
8 Carta AR,Frau L.Rosiglitazone decreases peroxisome proliferator receptor-gamma levels in microglia and inhibits TNF-alpha production:new evidences on neuroprotection in a progressive Parkinson's disease model〔J〕.Neuroscience,2011;194(2):250-61.
