血肿穿刺清除术对大鼠脑出血灶周组织中IL-6、TNF-α 表达的影响
2012-09-05刘振华张清华赵佳丽王敏忠杜怡峰
刘振华,张清华,赵佳丽,王敏忠,杜怡峰
(山东大学附属省立医院,济南 250021)
目前,脑出血血肿穿刺清除术的最佳时机尚无定论。单从手术角度考虑,血肿抽吸的理想时间为出血后4~8 d,此时血肿大部分液化有利于清除,但血肿对脑组织的压迫时间过长,脑损伤恢复的可能性小。近年研究[1~3]证实,一些细胞因子或炎症介质与出血性脑血管疾病的发生、发展有关,其中以白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)关系最为密切。2010~2011年,我们观察了不同时机的血肿穿刺清除术对大鼠脑出血灶周组织中IL-6、TNF-α表达的影响,旨在为临床手术时机的选择提供理论依据。
1 材料与方法
1.1 材料 健康成年雄性Wistar大鼠90只,体质量260~320 g,购自山东大学实验动物中心;大鼠脑立体定向仪,微量注射仪(购于瑞沃德生命科技有限公司),微量注射器 (上海高鸽工贸有限公司);IL-6、TNF-α抗体(均为非结合多克隆兔抗体)SP免疫组化试剂盒及DAB显色试剂盒购于北京博奥森生物技术有限公司。
1.2 方法
1.2.1 分组与造模 将大鼠随机分为对照组、模型组和手术组各30例。模型组和手术组参照Rosenberg等[4]报道的方法制备大鼠脑出血模型。术前禁食,自由饮水。用10%水合氯醛腹腔麻醉大鼠(350 mg/kg),将其俯卧位固定在立体定向仪上;沿头皮正中作一长约10 mm切口,暴露前囟;于前囟前0.2 mm中线旁开3 mm处钻一直径为0.5 mm的孔,进针深度为5.5 mm(尾壳核位置)。剪尾取血,在8 min内缓慢注入自体未抗凝动脉血50 μL;注血结束留针10 min后缓慢退针,局部用骨蜡封闭后缝合皮肤。对照组手术过程同上,注射等量生理盐水。操作均在无菌条件下进行,术毕将大鼠放回笼中饲养,自由活动,进食进水。Bederson评分[5]≥2分者为造模成功。手术组在造模成功后6、12、24、48、72 h行血肿穿刺清除术(每次6只):将大鼠重新麻醉后固定在定位仪上,坐标值同前;用头皮针连接微量注射器抽取尿激酶 10 μL[6,7],沿钻孔处进针深约 6.3 mm,5 min内注入尿激酶;待约45 min后用1 mL注射器代替微量注射器连接真空管外端,利用负压轻柔缓慢抽吸血肿,抽吸量为总量的30% ~40%;缓慢退针,常规创口消毒后缝合皮肤。
1.2.2 大鼠脑出血灶周组织中IL-6、TNF-α 的检测手术组于术后4 h、造模组和对照组均于造模后6、12、24、48、72 h 各断头处死 6 只大鼠,取血肿靠近皮层侧(尾状核平面)脑组织约2 mm3,用4%多聚甲醛固定,常规脱水,石蜡包埋,切片厚度约4 μm。采用免疫组化SP法染色,按试剂盒说明书操作,阳性细胞为细胞质内出现黄色或棕黄色颗粒。每组随机选取5个不重叠视野,在400倍显微镜下进行观察,计数阳性细胞数,取平均值。
1.2.3 统计学方法 采用SPSS18.0统计软件。所得数据以表示,组间比较用t检验,多组、多时点的比较采用Post-hoc方差分析。P≤0.05为差异有统计学意义。
2 结果
不同时点各组大鼠脑出血灶周组织中TNF-α、IL-6阳性细胞数比较,见表1。
表1 不同时点各组大鼠脑出血灶周组织中TNF-α、IL-6 阳性细胞数比较(个/HP,)
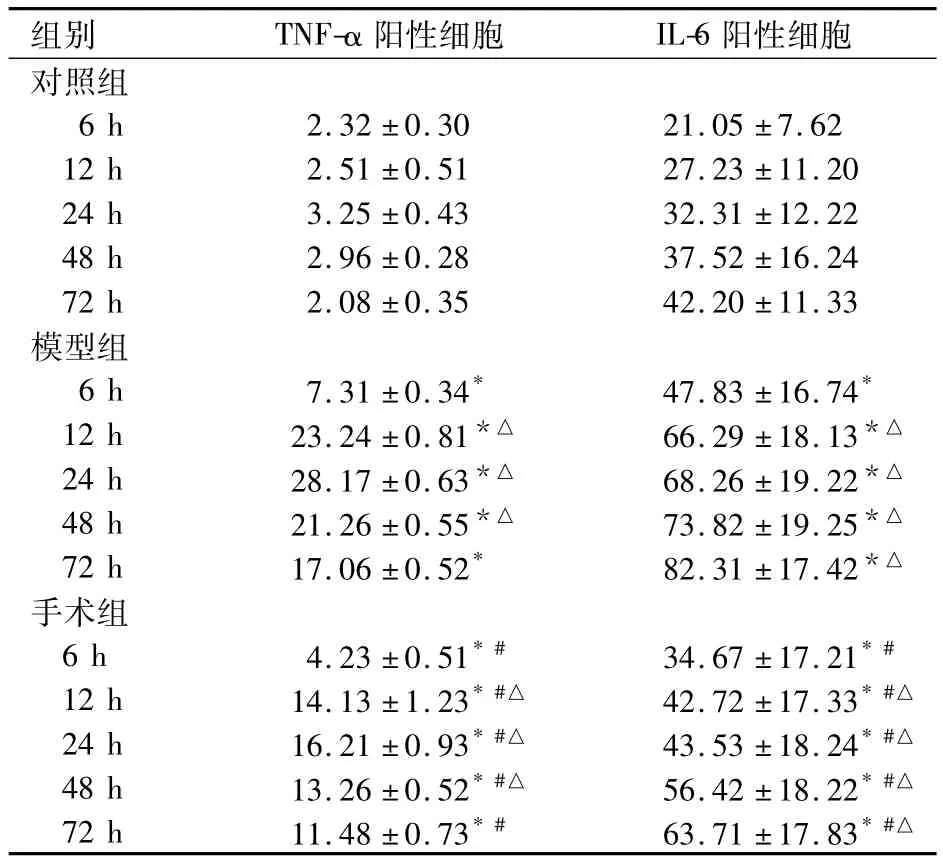
表1 不同时点各组大鼠脑出血灶周组织中TNF-α、IL-6 阳性细胞数比较(个/HP,)
注:与对照组同时点比较,*P<0.05;与模型组同时点比较,#P <0.05;与同组前一时点比较,△P <0.05
组别 TNF-α阳性细胞 IL-6阳性细胞对照组6 h 2.32 ±0.30 21.05 ±7.6212 h 2.51 ±0.51 27.23 ±11.2024 h 3.25 ±0.43 32.31 ±12.2248 h 2.96 ±0.28 37.52 ±16.2472 h 2.08 ±0.35 42.20 ±11.33模型组6 h 7.31 ±0.34* 47.83 ±16.74*12 h 23.24 ±0.81*△ 66.29 ±18.13*△24 h 28.17 ±0.63*△ 68.26 ±19.22*△48 h 21.26 ±0.55*△ 73.82 ±19.25*△72 h 17.06 ±0.52* 82.31 ±17.42*△手术组6 h 4.23 ±0.51*# 34.67 ±17.21*#12 h 14.13 ±1.23*#△ 42.72 ±17.33*#△24 h 16.21 ±0.93*#△ 43.53 ±18.24*#△48 h 13.26 ±0.52*#△ 56.42 ±18.22*#△72 h 11.48 ±0.73*# 63.71 ±17.83*#△
3 讨论
近年来研究[8,9]表明,自发性高血压性脑出血后,积血释放凝血酶、细胞毒性物质及其他分解产物,造成炎症细胞浸润,导致脑水肿及神经细胞凋亡和炎性因子如 IL-1、IL-6、IL-10、TNF-α 等的释放,引起附近脑组织损害,进一步造成血脑屏障的破坏。TNF-α是一种具有广泛生物学功能的细胞因子,可通过促进凝血、增加内皮细胞通透性及诱导黏附分子或其他炎性介质等表达,增加血脑屏障的通透性,加重脑损伤。本研究结果显示,模型组和手术组大鼠脑出血后6 h,脑出血灶周组织中TNF-α表达即增加,24 h达高峰,以后逐渐下降;而手术组TNF-α表达明显低于模型组、高于对照组(P均<0.05),且以造模后6 h手术的大鼠表达最低(P均<0.05)。提示尽早进行微创清除血肿可以减轻血肿周围组织中TNF-α表达,从而保护神经组织。
在自发或其他因素的刺激下,淋巴细胞与多种非淋巴细胞都能产生IL-6。在中枢神经系统IL-6主要源于巨噬细胞、有活性的星形胶质细胞、小胶质细胞及神经内皮细胞等。有学者认为,正常神经细胞中IL-6保持低表达发挥中枢介导、神经修复等生理作用,但在脑出血后IL-6表达增高,参与神经损伤过程。本研究结果显示,随着脑出血时间的延长,模型组和手术组大鼠脑出血灶周组织中IL-6表达逐渐增加,72 h时最高。说明在脑出血急性期IL-6表达处于高水平,介导了脑出血后的脑组织损伤。
微创穿刺治疗操作简便,可以早期清除血肿,降低颅内压,挽救患者生命,有利于脑功能康复,具有创伤小、费用少、术后康复快、技术易掌握等优点[10],但对于微创治疗最佳时机的选择尚无定论。本研究分别在大鼠脑出血后6、12、24、48、72 h行血肿穿刺清除术,观察不同时机手术对脑组织中TNF-α、IL-6表达的影响。结果显示,观察组6 h手术大鼠血肿周围脑组织中TNF-α、IL-6的表达明显低于其他时间手术大鼠。说明在脑出血早期即有脑内的炎症因子激活,超早期(出血后6 h)进行血肿清除可解除血肿压迫引起的脑损伤,还能降低血液分解产物的炎症反应。本研究结果还显示,脑出血后脑组织中IL-6表达高峰较TNF-α表达高峰出现的晚,可能与TNF-α激活了小胶质细胞和星形胶质细胞分泌IL-6有关。
[1]Wang KW,Cho CL,Chen HJ,et al.Molecular biomarker of inflammatory response is associated with rebleeding in spontaneous intracerebral hemorrhage[J].Eur Neurol,2011,66(6):322-327.
[2]ziedzic T,Bartus S,Klimkowicz A,et al.Intracerebral hemorrhage triggers interleukin-6 and interleukin-10 release in blood[J].Stroke,2002,33(9):2334-2335.
[3]Dziedzic T.Clinical significance of acute phase reaction in stroke patients[J].Front Biosci,2008,13(1):2922-2927.
[4]Rosenberg GA,Mun-Bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats[J].Stroke,1990,21(5):801-807.
[5]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[6]Wagner KR,Xi G,Hua Y,et al.Ultra-early clot aspiration after lysis with tissue plasminogen activator in a porcine modeI of intracerebral hemorrhage:edema reduction and bloat-brain barrier protection[J].J Neurosurg,1999,90(3):491-498.
[7]Ahumbabic M,Peling J,Del Bigio MR.Intracerebral hemorrhage in the rat-effects of hematoma aspiration[J].Stroke,1998,29(9):1917-1923.
[8]Siddique MS,Mendelow AD.Surgical treatment of intracerebral haemorrhage[J].Br Med Buu,2000,56(2):444-456.
[9]Hua Y,Keep RF,Hoff JT,et al.Brain injury after intracerebral hemorrhage the role of thrombin and iron[J].Stroke,2007,38(Suppl 2):759-762.
[10]Samadani U,Rohde V,A review of stereotaxy and lysis for intracranial hemorrhage[J].Neurosurg Rev,2009,32(1):15-22.
