单肺通气对大鼠肺组织结构、细胞凋亡的影响及机制探讨
2012-06-14杜学柯彭丹晖陈肖东潘灵辉
黎 阳,易 娟,杜学柯,彭丹晖,陈肖东,黄 冰,潘灵辉,阮 林
(广西医科大学附属肿瘤医院,南宁530021)
单肺通气(OLV)是胸科手术麻醉中常用的一种机械通气模式。机械通气能使炎症级联反应激活,通过分子生物学和细胞学效应对肺组织产生损伤。有研究[1]认为,在机械通气早期就有肺泡上皮细胞凋亡的发生。2011年4~12月,我们观察了OLV对大鼠肺组织细胞凋亡及凋亡执行因子Caspase-3表达的影响。现报告如下。
1 材料与方法
1.1 材料 健康SD雄性大鼠42只,体质量200~250 g,由广西医科大学实验动物中心提供;江湾Ⅰ型微型动物呼吸机,Caspase-3兔抗鼠单克隆抗体,GAPDH内参抗体、TUNEL试剂盒、凝胶成像系统及配套分析软件均购自美国Bio-Rad公司,多功能酶标仪购自芬兰雷勃公司。
1.2 方法
1.2.1 动物分组 将大鼠随机分成OLV组(A组)18只、双肺通气组(B组)18只及对照组(C组)6只。根据通气时间,A、B组又各分成3个亚组,即A1(OLV 0.5 h,恢复通气0.5 h)、A2(OLV 1 h,恢复通气 0.5 h)、A3 组(OLV 1.5 h,恢复通气 0.5 h)及B1(双肺通气1 h)、B2(双肺通气1.5 h)、B3 组(双肺通气2 h),各6只。
1.2.2 模型制备 A组大鼠肌注氯胺酮80 mg/kg、速眠新Ⅱ0.6~0.8 mL/kg麻醉,行气管切开并插入气管导管至主气管;给予维库溴铵2 mg/kg后接呼吸机进行机械通气,通气参数为氧浓度(FiO2)100%、潮气量(VT)10 mL/kg、呼吸频率(RR)60次/min。于左侧第5肋间开胸,暴露左肺;将气管导管过深插入至右侧支气管,调节通气参数VT 5~6 mL/kg、RR 80次/min;见左侧肺叶萎陷,对侧肺通气,开始计时;至各亚组预定时间后,将气管导管退回主气管开始复张,恢复至双肺通气时的通气参数。B组则于暴露左肺后,始终保持双肺通气至预定时间。C组自主呼吸。
1.2.3 标本采集 A、B组通气至预定时间及C组麻醉后,立即颈动脉放血处死动物;分离两侧完整肺叶,置入预冷的生理盐水中;漂洗数次以清洁表面的血迹,用滤纸吸干;取部分左肺下叶组织置入4%多聚甲醛固定48 h,脱水后石蜡包埋,做肺组织切片;将余下左肺下叶组织-80℃冰箱保存,备用。
1.2.4 检测项目与方法 取左肺下叶组织行HE染色,光镜下观察肺组织形态结构的改变。Western blot法检测100 mg超低温保存肺组织中的Caspase-3蛋白,按试剂盒说明操作;用Image Lab凝胶图像分析系统对胶片扫描后的反应蛋白条带图像进行分析,得出目标条带的灰度值,以目标蛋白条带灰度值与内参GAPDH蛋白条带灰度值的比值表示Caspase-3蛋白相对表达量。采用原位末端标记法(TUNEL)检测肺组织的细胞凋亡,按试剂盒说明操作,细胞核呈棕黄色染色为阳性细胞;每张切片选取10个不重复视野,计算细胞凋亡指数(AI),即每高倍视野中阳性细胞数和该高倍视野中细胞总数的比值,计算平均值。
1.2.5 统计学方法 采用SPSS13.0统计软件。计量资料以±s表示,各亚组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用 LSD-t检验,相对应亚组间样本比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织形态变化 C组肺组织无明显病理改变,肺泡结构形态完整,肺泡间隔正常。B组中B1组无明显病理改变;随通气时间增加,B2、B3组肺泡内可见少量渗出液,肺间质增厚。A组中A1组可见少量渗出液,肺间质增厚;A2、A3组非通气侧肺泡内可见大量红细胞,部分肺泡腔萎陷不张,肺间质增厚明显。
2.2 各组大鼠肺组织细胞AI及Caspase-3蛋白相对表达量比较 见表1。
表1 各组大鼠肺组织细胞AI及Caspase-3蛋白相对表达量比较(±s)
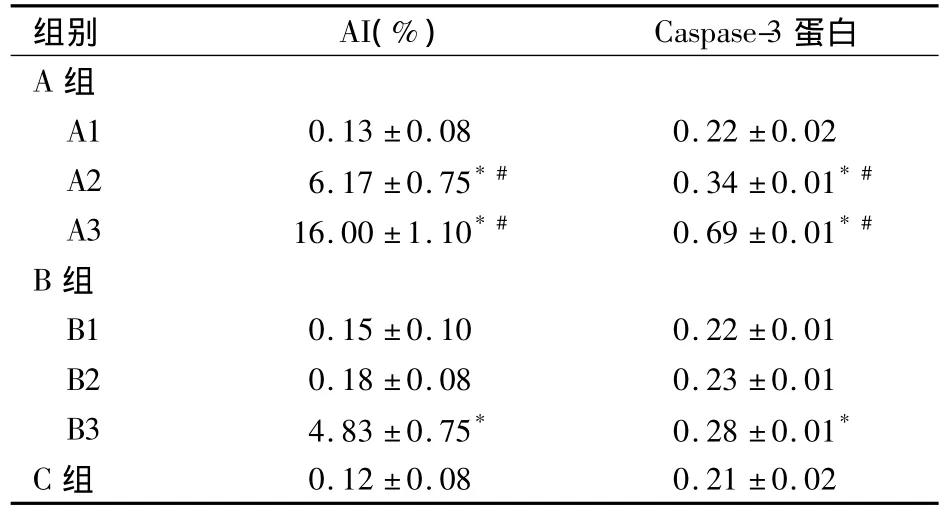
表1 各组大鼠肺组织细胞AI及Caspase-3蛋白相对表达量比较(±s)
注:与C组比较,*P<0.05;与B组对应亚组比较,#P<0.05
组别 AI(%) Caspase-3蛋白A 组A1 0.13±0.08 0.22±0.02 A2 6.17±0.75*# 0.34±0.01*#A3 16.00±1.10*# 0.69±0.01*#B组B1 0.15±0.10 0.22±0.01 B2 0.18±0.08 0.23±0.01 B3 4.83±0.75* 0.28±0.01*C组0.12±0.08 0.21±0.02
3 讨论
OLV期间,由于非通气侧肺的血液未得到充分氧合,造成静脉血掺杂,引起肺组织缺氧,从而导致肺组织细胞损伤以及功能损害;此外,肺萎陷后复张及在复张通气过程中过度的牵张等,可引起一系列反应加重肺损伤[2,3]。本研究结果显示,随着 OLV时间延长,大鼠肺组织复张后出现肺泡结构破坏、充血水肿、肺间质逐渐增厚等组织损伤并逐渐加重。说明OLV时非通气侧肺组织受到机械牵张时间虽然短,但此后的肺复张可加重萎陷肺组织的损伤。
本研究发现,C组肺组织中未见有凋亡细胞存在,B组只有在通气2 h的肺泡腔内侧面及肺间质中见少量凋亡细胞,而A组在机械通气1.5 h时肺组织中就已经出现凋亡细胞。在机械通气2 h后,A组肺组织细胞的AI高于B组,提示A组肺组织中凋亡细胞的数量较B组多。在机械通气过程中,支气管上皮细胞和肺泡上皮细胞受到机械牵张的刺激,通过激活NF-κB的炎症级联反应而诱导细胞凋亡[1];多种因素通过诱导肺组织细胞过度凋亡导致肺泡结构破坏,加重肺泡毛细血管膜的损伤从而参与急性肺损伤(ALI)的病理过程[4]。OLV较双肺机械通气易导致肺组织细胞凋亡,可能与肺组织的缺氧/低灌注、萎陷/复张有关。在OLV过程中,非通气侧肺萎陷,肺泡氧分压下降,使得非通气侧肺组织缺氧;肺泡氧分压下降可引起肺血管阻力增加即非通气侧肺缺氧性肺血管收缩(HPV),是肺循环对缺氧的一种代偿反应,但是HPV在起到这些保护作用的同时,也减少了肺组织的血流灌注量。Krick等[5]研究发现,在低氧的状态下,大鼠可通过诱导缺氧诱导因子(HIF-1)引起肺泡Ⅱ型上皮细胞凋亡。肺组织缺氧或缺血/再灌注损伤时,组织中多形核白细胞(PMN)被激活,激活的PMN耗氧量大增,不但进一步增加组织缺氧,而且还释放大量细胞因子和炎症介质,可导致及加重ALI[6]。有研究表明,小肠缺血再灌注后,可通过上调TNF-α导致Ⅱ型上皮细胞凋亡从而引起ALI。OLV各亚组的左肺虽然只通气0.5 h,但随着肺萎陷的时间延长,肺组织中细胞凋亡数量增加。游志坚等[7]的研究也表明,兔OLV时肺组织氧化应激水平显著升高,且随着OLV时间的延长表现更为明显。在非通气侧肺萎陷后复张的过程中,肺泡的膨胀并非都是协调的,膨胀和萎陷肺泡交界处产生的界面切力对肺泡壁过度牵张可引起肺泡上皮细胞的凋亡[8]。以上的研究结果提示,OLV机械通气时,肺萎陷可能较肺机械牵张更易导致肺细胞凋亡。肺泡上皮细胞及血管内皮细胞凋亡的增加,可导致肺血管内皮屏障功能障碍[9,10]。随着 OLV时间的延长,肺组织凋亡细胞增多,可导致肺泡和血管内皮结构破坏加重,这与本研究发现的随着OLV时间延长,肺泡腔内出现红细胞、肺间质水肿逐渐增厚等ALI病理改变相一致。
正常组织中的细胞凋亡对生物体的进化、内环境的稳定以及多个系统的发育起着重要作用。Caspase家族属于天冬氨酸特异的半胱氨酸蛋白酶,与细胞凋亡密切相关。Caspase-3是其家族中最重要的一员,处于细胞凋亡的共同路径上,是细胞凋亡的关键执行者之一。本研究中,C组的肺组织中出现凋亡细胞和Caspase-3蛋白表达可视为一种正常的生物学现象。Caspase-3在胞质中以无活性的酶原形式存在,只有当许多细胞外凋亡信号使之激活时,可引起细胞质、细胞核及细胞构架的关键蛋白酶失活,导致细胞凋亡。本研究结果显示,各组Caspase-3蛋白表达的变化与细胞凋亡变化的趋势大体一致。
综上所述,随着通气时间的延长,OLV可导致肺组织结构的改变,并导致细胞凋亡及Caspase-3蛋白表达增加。由此推测,细胞凋亡可能是OLV导致ALI的重要因素,该作用与Caspase-3蛋白表达上调有关。更具体的作用机制还有待于进一步研究。
[1]赵兵,张华茹,李海明,等.大鼠机械通气相关性肺损伤与肺组织细胞凋亡的关系[J].中国实用医刊,2011,38(3):50-52.
[2]Plataki M,Hubmayr RD.The physical basis of ventilator-induced lung injury[J].Expert Rev Respir Med,2010,4(3):373-385.
[3]黎阳,彭丹晖,梁锐,等.单肺通气过程血中性粒细胞计数和通气后肺组织形态学的改变[J].广西医科大学报,2009,26(5):733-734.
[4]Chopra M,Reuben JS,Sharma AC.Acute Lung Injury:Apoptosis and Signaling Mechanisms [J].Exp Biol Med,2009,234(4):361-371.
[5]Krick S,Eul BG,Hanze J,et al.Role of hypoxia-inducible factor-1alpha in hypoxia-induced apoptosis of primary alveolar epithelial type Ⅱ cells[J].Am J Respir Cell Mol Biol,2005,32(5):395-403.
[6]Den Hengst WA,Gielis JF,Lin JY,et al.Lung ischemia-reperfusion injury:a molecular and clinical view on a complex pathophysiological process[J].Am J Physiol Heart Circ Physiol,2010,299(5):1283-1299.
[7]游志坚,徐红霞,周子超,等.不同时间单肺通气对肺部氧化应激水平的影响[J].中华全科医学,2010,8(12):1492-1493.
[8]Circu ML,Aw TY.Reactive oxygen species,cellular redox systems,and apoptosis[J].Free Radic Med,2010,48(6):749-762.
[9]An S,Hishikawa Y,Liu J,et al.Lung injury after ischemiareperfusion of small intestine in rats involves apoptosis of type II alveolar epithelial cells mediated by TNF-alpha and activation of Bid pathway[J].Apoptosis,2007,12(11):1989-2001.
[10]Hammerschmidt S,Kuhn H,Grasenack T,et al.Apoptosis and necrosis induced by cyclic mechanical stretching in alveolar type II cells[J].Am J Respir Cell Mol Biol,2004,30(3):396-402.
