右室心尖部和间隔部S1S2刺激电重构后对跨室壁复极离散的影响
2012-09-02王又平朱中升徐伟刘利娜
王又平,朱中升,徐伟,刘利娜
生理性起搏越来越受到关注,已有大量研究证明右室间隔部起搏对患者心功能的改善要好于右室心尖部起搏。目前起搏相关的心律失常受到关注,而跨室壁复极离散是评价心律失常的一项重要指标,近年来人们了解到参与室壁复极的有三类细胞,即心内膜下细胞、心外膜下细胞和中层的M细胞,三者复极的不均一性导致跨室壁复极离散[1]。心室肌跨壁复极离散增大是多种室性心律失常(室速、室颤、心性猝死)发生的主要机制[2]。而心脏起搏器置入者,QRS波时限间隔部起搏较右室心尖部起搏短,但其电重构后跨室壁复极离散研究较少,为验证右室间隔部(RVS)起搏跨室壁复极离散是否比右室心尖部(RVA)小,收集18例电生理检查患者数据进行比较来进一步验证上述推想。
1 资料与方法
1.1 研究对象 选择2010年3月至2012年2月我院收治的体表心电图诊断阵发性室上性心动过速而行射频消融的18例患者,男性10例,女性8例,随机分为RVA组(9例)和RVS组(9例)。入选条件:无心肌梗死病史、高血压病史、心肌病史、先天性心脏病史、心脏手术史(包括器械置入史)。心功能正常、心脏大小正常。符合电生理检查条件并签署手术同意书的患者。
1.2 方法
1.2.1 电生理检查 患者清醒状态平卧于手术台,穿刺右颈内静脉或左锁骨下静脉送入10极冠状静脉窦电极,穿刺右股静脉送入4极右室电极,分别在左前斜45°与右前斜30°证实电极在RVA和RVS,心室4极电极采用远端1、2极行电生理刺激,据患者耐受情况和电生理要求分别对RVA和RVS进行S1S2程序刺激,以S1S1500ms刺激达到同一频率电重构心肌细胞后,观察S1S2(400~240)ms不同间期刺激后心肌细胞跨室壁复极离散情况。
1.2.2 数值测量 由国产四川锦江多导记录仪记录刺激图和体表心电图,因刺激信号明显稳定,故均选择刺激信号为测量起点,因电生理检查时S1S2刺激停止刺激后有一个长间歇有利于S2刺激QRS-T波的完整表达,故选择S2刺激波体表心电图V1导联测量QRS波时限。QTp:心室刺激信号至T波顶点间期。QT间期:心室刺激信号至T波终点间期。Tp2e:T波顶点至终点间期(图1),心电图走速100mm/s、放大倍数40倍,多导记录仪体表心电图连接胸前导联V1-V6比标准导联低一肋间。
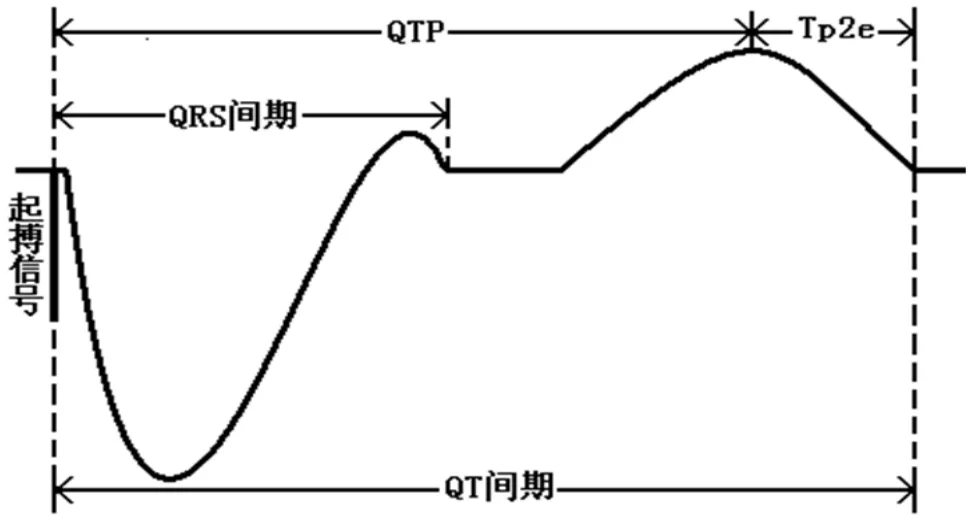
图1 示起搏心脏图QRS间期、QTP、Tp2e、QT间期的测量
2 结果
2.1 RVA和RVS结果判定 心尖部起搏的体表心电图表现为左束支阻滞、Ⅱ、Ⅲ、aVF导联QRS主波向下,间隔部起搏表现为Ⅱ、Ⅲ、aVF导联QRS主波向上。结果显示RVS组及RVA组S1S1500ms均能完全起搏心室,达到同频率电重构。
2.2 S1S2刺激QRS间期比较 右室RVS刺激组比RVA刺激组QRS间期明显缩窄(P<0.01);随着S1S2刺激间期缩短,组内比较QRS间期无统计学差异(表1)。
2.3 S1S2刺激QTp间期比较 RVS组与RVA组比较无统计学差异;随着S1S2刺激间期缩短,与S1S2500/400ms相比,RVS组与RVA组组内QTp无统计学差异(表2)。

表1 两组心电图QRS间期比较

表2 两组S1S2刺激S2体表心电图QTp间期比较
2.4 S1S2刺激QT间期比较 RVS组与RVA组相比,RVS组QT间期较短,500/260ms和500/240ms之间差异有统计学意义(P<0.01);随着S1S2刺激间期缩短QT间期逐渐延长;同时组内500/260ms和500/240ms与S1S2500/400ms相比均有统计学差异(P<0.01,表3)。

表3 两组S1S2刺激S2体表心电图QT间期比较
2.5 S1S2刺激Tp2e间期比较 RVS组与RVA组相比,RVS组500/260ms和500/240msTp2e间期较短(P<0.05)。随着S1S2刺激间期缩短Tp2e间期逐渐延长,同时组内500/260ms和500/240ms与S1S2500/400ms相比均有统计学差异(P<0.01,表4)。

表4 两组S1S2刺激S2体表心电图Tp2e间期比较
3 讨论
除极是心肌细胞的去除极化状态,是带正电荷的阳离子(Na+、Ca2+)在0位相迅速进入心肌细胞内的结果,单个心室肌细胞动作电位的除极过程与心电图的QRS波对应[3],RVA起搏激动自右室心尖部肌细胞蒲肯耶纤维沿室间隔及周围心肌组织逆行向心底部传导使右、左心室除极,传导速度要比经希氏束传导系统缓慢而不均匀,QRS波一般较宽大,而RVS靠近希氏束,可直接实现“近希氏束起搏”[4],从而获得接近生理状态的心室激动顺序[5],至RVS起搏的QRS波较RVA要窄。本研究结果也显示,相同S1S2刺激,RVS组比RVA组QRS间期明显缩窄(P<0.01),但随着S1S2刺激间期缩短,两组内部的QRS间期无统计学差异,这可能与除极涉及的离子流种类少,除极时间短,离子通道等有关因素相对稳定有关[3]。
复极过程与ST段和T波相对应,可简单看成是带正电荷的阳离子(K+)持续不断地从细胞内经离子通道流向细胞外。90年代初,Antzelevitch等[6]发现在狗左心室壁中,除了有心内膜下和心外膜下心室肌细胞外,还有电生理特性与它们都不同的心室壁中层M细胞。随后,M细胞被发现存在于多种哺乳类动物(包括人类)的心脏中。通过对比三类细胞复极过程的差异与T波之间的关系发现,当心内膜、心外膜心室肌细胞平台和M细胞平台间出现电位差时,自T波开始,当上述复极的电位差逐步加大,T波逐渐升高,当两者的电位差最大时,T波达到顶峰(Tpeak)[7],T波的顶点对应3层心室肌中最短动作电位时限的终点,QTp间期指心电图QRS波起点至T波顶点间期,代表了心肌除极至心内膜、心外膜心室肌细胞复极与M细胞复极间最大电位差时间[8],大致等于心外膜心室肌细胞复极结束时间,Iks(缓慢延迟整流钾电流)通道主要分布在心外膜心肌细胞[3]。本研究结果中S1S2刺激QTp间期在RVS及RVA组间组内比较差异无统计学意义,提示心外膜心肌细胞Iks通道S1S1电重整后失活缓慢,使之对短暂的S1S2刺激激活加快,造成心外膜心室肌细胞复极结束时间延长不明显。
由于三类心肌细胞动作电位之间存在电位差,故近年来跨室壁复极离散受到重视,M细胞的平台电位最高最长,由于M细胞在中层,所以它和心外膜下心室肌之间的电位差可形成一个正向波,而M细胞和心内膜下心室肌细胞之间的电位差则形成一个负向波。这两个波叠加是一个正向波,与记录到的心电图T波吻合[9]。由于心内膜下心室肌细胞和M细胞的电位差与M细胞和心外膜下细胞的电位差方向相反,所以心内膜下心室肌的复极限制了T波峰幅值的高度,由于心内膜下心室肌细胞的动作电位时程长于心外膜下心室肌细胞,其复极也参与了T波降支的初期,当M细胞复极完毕,T波也结束[7],构成T波峰和末间期。QT间期指的是QRS波起始点至T波终点的时间间隔,代表心室除极和复极的总过程,但其主要成分是心室复极,包含跨室壁复极离散成份,因而QT间期受复极的影响最大,是心室复极时间的指标,也是室壁M细胞的复极时间。T波峰末间期(Tp2e)是指T波顶峰至T波终末之间的时间,因T波的顶点对应三层心室肌中最短动作电位时限的终点,而T波终点对应最长动作电位时限的终点[8],故Tp2e即3层心室肌中最长动作电位时限和最短动作电位时限的差代表了心内膜、心外膜心室肌细胞复极和M细胞复极间最大电位差至M细胞复极结束时间,也即心外膜心室肌细胞复极结束至M细胞复极结束时间。近年来研究表明,Tp2e可作为反映心室跨壁复极离散的量化指标[10]。本研究显示,RVS及RVA 的QT间期、Tp2e间期在S1S2(500/260ms、500/240ms)比较差异有统计学意义;组内(与S1S2500/400ms)QT间期及Tp2e间期逐渐延长,差异有统计学意义。随着S1S2刺激缩短500/260ms和500/240ms差异明显,与刺激是否达到心肌激动相对不应期有关,在未达心肌激动相对不应期前随着刺激间期缩短室壁离散无差异,达到心肌激动相对不应期后随着刺激间期缩短Tp2e逐渐延长,室壁离散逐渐增大。因与心肌细胞复极2相位平台相关的是Iks,主要分布于心外膜的心肌细胞,激活缓慢需较长时间才能达到稳定[3];3相位快速复极相关的是Ikr(快速延迟整流钾电流),主要分布于心室肌的中层M细胞;正常时Ikr电流比Iks电流高出数倍,提示在相对不应期前,心室肌M细胞Ikr通道随S1S1刺激电重整后对短暂的S1S2刺激激活加快,室壁离散不明显;而在相对不应期后,心室肌M细胞的主要通道Ikr逐渐失活,随着S1S2刺激间期缩短T波下降支的时程明显延长,室壁离散加大。因此,M细胞数量的多寡、分布的部位、复极电位幅度和持续时间对跨室壁复极离散都有重要影响[7]。
此外,不同个体的心室不应期差别较大和间隔部起搏部位未完全固定都可能造成结果偏倚,提示需要增加样本量,而且如果选择同一患者分别行心尖部和间隔部临时起搏进行对比可能使研究更有说服力。但目前的结果已经提示心脏电重构后RVS组比RVA组跨室壁复极离散低、心脏同步性较好、是选择起搏的较好部位。
[1]苏显明,何亚军,马奕. 心电图Tp2e/QT比值在预测心源性猝死及恶性心律失常中的意义[J]. 临床急诊杂志,2010,11(3):157-60.
[2]张燕,夏云龙,张树龙. T 波峰-末间期对肥厚型心肌病患者心室复极离散度评价的研究[J]. 大连医科大学学报第,2011,33(5):451-4.
[3]郭继鸿. 复极储备[J]. 临床心电学杂志,2010,19(4):299-312.
[4]Deshmukh P,Casavant DA,Romanyshyn M,et al. Permanent,direct hisbundle pacing:A novel approach to cardiac pacing in patients with normal His-Purkinje activation[J]. Circulation,2000,101(8):869-77.
[5]Hillock RJ,Stevenson IH,Mond HG. The right ventricular outflow tract:a comparative study of septal,anterior wall,and free wall pacing[J]. Pacing Clin Electrophysiol,2007,30(8):942-7.
[6]Antzelevitch C. Transmural dispersion of repolarization and the T wave[J]. Cardiovasc Res,2001,50(3):426-31.
[7]夏云龙,杨延宗. T波形成的心电生理机制及其争议[J]. 心血管病学进展,2010,31(4):497-50.
[8]Xia Y,Liang Y,Kongstad O,et al. In vivo validation of the coincidence of the peak and end of the T wave with full repolarization of the epicardium and endocardium in swine[J]. Heart Rhythm,2005,2(2):162-9.
[9]Yan GX,Martin J. Electrocardiographic T wave:a symbol of transmural dispersion of repolarization in the ventricles[J]. J Cardiovasc Electroph ysiol,2003,14(6):639-40.
[10]Xia Y,Liang Y,Kongstad O,et al. Tpeak-Tend interval as an index of global dispersion of ventricular repolarization:evaluation using monophasic action potential mapping of the epi-and endocardium in swine[J]. J Interv Cardiac Electrophysiol,2005,14(2):79-87.
