Meta分析系列之八:Meta分析的报告规范
2012-09-02曾宪涛李胜马钻张永
曾宪涛,李胜,马钻,张永
Meta分析不仅需要完整、客观的检索相关文献,而且要求排除有缺陷研究的标准必须是明确的、独立于试验结果的,即不能因为某个试验结果与该领域的其他试验结果不同而将其排除,Meta分析应当公开尽可能多的信息以供读者判断其证据可信度。研究表明,因缺乏报告规范,关键信息的缺失可使得系统评价或Meta分析的潜在价值大打折扣,甚至得出与实际情况完全相反的结论[1-2]。因此,要想提高Meta分析的质量有必要规范系统评价与Meta分析的报告格式及制作步骤;同理,Meta分析的制作者也只有严格遵照相应的报告格式及制作步骤,才能制作出高质量的、有价值的、得到广泛认可的Meta分析。
为了提高Meta分析的报告质量,制定了一系列相关的报告规范。最早的当推1999年由加拿大渥大华大学Moher等制定的针对随机对照试验Meta分析的报告规范QUOROM(quality of reporting of meta-analysis)[3],这一标准于2009年修订为PRISMA(preferred reporting items for systematic reviews and meta-analyses)[4]。此外,还有Cochrane协作网制定Cochrane系统评价写作的专用报告格式,当前最新版本为2011年3月份更新的5.1.0版[5];Stroup等制定的专用于观察性研究的Meta分析报告规范MOOSE(Meta-analysis Of Observational Studies in Epidemiology)[6]等多种报告规范。
国内外研究均表明,QUOROM发表之后的Meta分析报告质量较之前有所提高[7-8],且采用了这些报告规范的期刊上的系统评价或Meta分析报告质量高于未采用的期刊[9]。本文将对当前推荐使用的报告规范进行简介。
1 PRISMA声明
1999年,加拿大渥太华大学Moher领导成立了Meta分析质量制定委员会,并召开“The quality of reporting of Metaanalyses of randomized controlled trails”会议,对随机对照试验的Meta分析报告质量进行了方法学的评价,并提出了一套Meta分析的统一报告格式——QUOROM报告规范[3]。QUOROM报告规范所涉及的条目分为题目、摘要、引言、方法、结果和讨论6大部分18个条目。结果部分包括检索流程,给出了关于鉴定、纳入和排除随机对照试验数量和被排除的原因。
2005年6月,包括QUOROM制定委员会在内的系统评价作者、方法学家、临床医生、医学编辑及一名使用者在内的29名参与者在加拿大渥太华成立了PRISMA制订委员会,修订并扩充QUOROM清单条目及流程图。会议产生了PRISMA声明,包括7个方面,27个条目(表1)和一个四阶段的流程图(图1)[4]。目的在于帮助作者改进Meta分析的撰写和报告,主要针对的还是随机对照试验,但也可以作为其他类型Meta分析的基础规范。
为便于Meta分析制作者明确了解清单每个条目的内容及意义,PRISMA制定委员会还同时发表了PRISMA解释和阐述手册以便理解,降低了作者和读者适应新的规范的难度[11];委员会还建立了专用网站http://www.prisma-statement.org/index.htm,里面包括了PRISMA所有相关内容,读者亦可从网站上免费下载PRISMA清单及流程图,有“.pdf”和“.doc”两种格式,方便实用。
2 Cochrane系统评价格式
Cochrane系统评价包括了Meta分析,属于广义系统评价,主要关注随机对照试验的系统评价的方法,2003年修订时扩充到诊断试验的系统评价,非随机对照试验的系统评价指南正在进一步完善。《Cochrane Handbook for Systematic Reviews of Interventions》经过数十次修订后目前版本为5.1.0[5]。手册5.1.0版共分为3个部分,共22个章,Cochrane系统评价的格式放在第一部分第二章第二节(Format of a Cochrane review)中。Cochrane系统评价的最初格式是由Mike Clarke及其同行们共同设计的,格式较灵活,适用于各种类型的评价(包括单个比较的评价、多种干预措施比较的评价以及使用个体患者资料的评价)。后为进一步完善格式,协作网成立了系统评价用户的反馈及系统评价管理软件RevMan顾问组,现已形成了一个相对完善的、固定的格式。RevMan软件[10]用于帮助评价员按适当的格式撰写系统评价,并形成便于电子传输的文件,当前版本为5.1.6。在RevMan 5.1.6中设置了Cochrane系统评价的全文格式(具体请参阅软件及手册)。
与PRISMA声明[4]不同的是,Cochrane格式标题不用注明“是否为系统评价,Meta分析,抑或两者皆是”,在正文之前多了“计划书/全文信息”,增加了“致谢、反馈、作者贡献、计划书与全文的不同点、发表备注”等内容。
3 MOOSE声明
MOOSE(Meta-analysis of Observational Studies in Epidemiology)是以美国疾病预防与控制中心、JAMA、牛津大学等单位的流行病学家和统计学家组成的流行病学观察性研究Meta分析方法学组于2000年提出的用于提高观察性研究Meta分析质量的报告规范[6]。MOOSE声明要求观察性研究报告的内容包括6个部分,共35个条目(表2)。

表1 PRISMA声明清单
随着基因-疾病关联研究的不断进展,出现了遗传流行病学。这类研究目前主要有两种:病例-对照研究和队列研究,最多见的是病例-对照研究。同时出现了很多单核苷酸多态性及全基因组联的Meta分析[11],这类Meta分析仍可以参考MOOSE报告规范。
4 动物实验报告规范
动物实验是连接基础研究和临床试验的重要桥梁,其所获结论是循证决策的依据之一。动物实验的Meta分析已成为临床前研究的新趋势,分析恰当的Meta分析可为是否进一步开展临床试验做出很好的评估[13]。2006年,英国莱特斯大学Peters等[14]对103篇动物实验的系统评价与Meta分析进行的系统评价发现这103篇系统评价与Meta分析报告的质量普遍不高。因此,他们借鉴QUOROM[3]及MOOSE[6]的条目,设计出了动物实验的Meta分析报告规范[14],内容包括6个部分,共17个条目(详见《A systematic review of systematic reviews and meta-analyses of animal experiments with guidelines for reporting》文中表1)。
5 STARLITE声明
Meta分析要求全面、无偏倚地纳入所有相关研究。电子检索策略的不当将严重影响系统评价质量,甚至得出错误的结论,完整透明地报告电子检索策略,有助于读者从可信度和方法学的角度评估系统评价质量[15],并可为同类研究的检索策略的制定提供参考。为了规范Meta分析检索策略的报告,2006年,Booth等[16]通过检索分析系统评价与Meta分析,提出了对于制定检索策略报告规范的建议,即STARLITE(Standards for Reporting Literature searches)声明,包括8个条目(表3),为Cochrane协作网所推荐。

表2 MOOSE声明清单
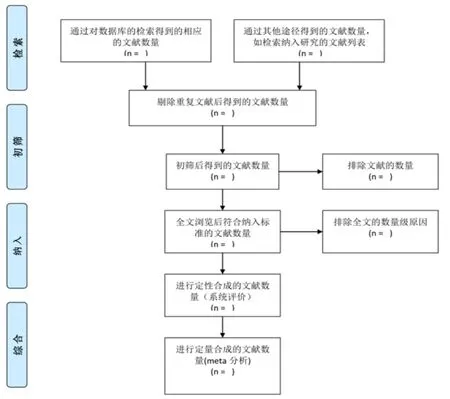
图1 PRISMA声明文献筛选4阶段流程图
6 小结
高质量的证据是循证医学实践的重要支撑,高质量的Meta分析是生产高质量证据的重要保证,报告规范则是制作高质量Meta分析的重要保证。尽管当前针对Meta分析的报告规范正处于起步阶段,仍需不断完善,但毫无疑问,遵照这些报告规范制作得到的Meta分析将大大提升其可信度。对于实验性临床研究的Meta分析,我们建议遵照PRISMA声明[4]或Cochrane系统评价格式[5];对于观察性研究设计,建议选用MOOSE声明[6];对于动物实验,建议选用动物实验报告规范[14];遗传相关性的研究及诊断试验的Meta分析,可以根据条目进行相应的修改,也可以直接遵照PRISMA声明。所有研究设计的Meta分析,我们均建议其检索策略遵照STARLITE声明[16]。

表3 STARLITE声明清单
[1]Jadad AR,Cook DJ,Browman GP. A guide to interpreting discordant systematic reviews[J]. CMAJ,1997,156(10):1411-6.
[2]Dixon E,Hameed M,Sutherland F,et al. Evaluating meta-analyses in the general surgical literature: a critical appraisal[J]. Ann Surg,2005,241(3):450-9.
[3]Moher D,Cook DJ,Eastwood S,et al. Improving the quality of reports of meta-analyses of randomised controlled trials:the QUOROM statement. Quality of Reporting of Meta-analyses[J]. Lancet,1999,354(9193):1896-900.
[4]Moher D,Liberati A,Tetzlaff J,et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement[J]. J Clin Epidemiol,2009,62(10):1006-12.
[5]Higgins JPT,Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011[J]. http://www.cochrane-handbook.org.
[6]Stroup DF,Berlin JA,Morton SC,et al. Meta-analysis of observational studies in epidemiology:a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) group[J]. JAMA,2000,283(15):2008-12.
[7]Delaney A,Bagshaw SM,Ferland A,et al. A systematic evaluation of the quality of meta-analyses in the critical care literature[J]. Crit Care,2005,9(5):R575-82.
[8]Wen J,Ren Y,Wang L,et al. The reporting quality of meta-analyses improves: a random sampling study[J]. J Clin Epidemiol,2008,61(8):770-5.
[9]Mrkobrada M,Thiessen-Philbrook H,Haynes RB,et al. Need for quality improvement in renal systematic reviews[J]. Clin J Am Soc Nephrol,2008,3(4):1102-14.
[10]曾宪涛,Kwong JSW,田国祥,等. Meta分析系列之二:Meta分析的软件[J]. 中国循证心血管医学杂志,2012,4(2):89-91.
[11]曾宪涛,冷卫东,郭毅,等. Meta分析系列之一:Meta分析的类型[J].中国循证心血管医学杂志,2012,4(1):3-5.
[12]Liberati A,Altman DG,Tetzlaff J,et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions:explanation and elaboration[J].PLoS Med,2009,6(7):e1000100.
[13]Pound P,Ebrahim S,Sandercock P,et al. Where is the evidence that animal research benefits humans[J]? BMJ,2004,328(7438):514-7.
[14]Peters JL,Sutton AJ,Jones DR,et al. A systematic review of systematic reviews and meta-analyses of animal experiments with guidelines for reporting[J]. J Environ Sci Health B,2006,41(7):1245-58.
[15]Jadad AR,Moher D,Klassen TP. Guides for reading and interpreting systematic reviews:II. How did the authors find the studies and assess their quality[J]? Arch Pediatr Adolesc Med,1998,152(8):812-7.
[16]Booth A. "Brimful of STARLITE":toward standards for reporting literature searches[J]. J Med Libr Assoc,2006,94(4):421-9,e205.
