抗蓝舌病病毒VP6和VP7蛋白单克隆抗体的制备及鉴定
2012-08-30孙恩成刘霓红徐青元秦永丽冯瑜菲王文世张翠云吴东来
魏 鹏,孙恩成,刘霓红,杨 涛,2,徐青元,秦永丽,赵 晶,冯瑜菲,2,王文世,张翠云,3,吴东来*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部兽医公共卫生重点开放实验室,黑龙江哈尔滨 150001;2.东北农业大学动物医学学院,黑龙江哈尔滨 150030;3.湖南农业大学动物医学学院,湖南长沙 410128)
蓝舌病(Bluetongue,BT)是由呼肠孤病毒科环状病毒属蓝舌病病毒(BTV)引起的经媒介昆虫(如库蠓、伊蚊等)传播的动物传染病。易感动物主要为山羊、绵羊、牛、骆驼等反刍动物,病畜有高烧、黏膜水肿和糜烂等症状。该病致死率为20%~30%,有时甚至高达90%。BTV血清型众多,已鉴定有24个血清型存在。近年来又发现了两个新的血清型,BTV25(瑞士,2008年)和 BTV26(科威特,2011年)[1]。根据不同血清型的Seg-2序列不同,可以将这些血清型又分为若干个核酸亚型(核酸A型到 L 型)[1]。
BTV是迄今为止发现的分子量最大的RNA病毒[2],其基因组由10个双股正链RNA组成;3个大节段(L1~L3),3个中节段(M 4~M 6)和4个小节段(S7~S10),10个节段基因组分别编码7种结构蛋白(VP1~VP7)和 4种非结构蛋白(NS1、NS2、NS3a、NS3b)[3]。VP6蛋白由S9基因编码,被认为是BTV的解旋酶[4],全长328个氨基酸。VP6蛋白具有高度的免疫原性,可以诱导高滴度的特异性抗体产生[5]。VP7蛋白由S7基因编码,是BTV群特异性抗原蛋白,由349个氨基酸组成,约占核心蛋白总量的36%[6-7]。制备针对VP6和VP7蛋白的单克隆抗体(MAb)对研究这两种蛋白的生物学特性和建立BT的检测方法具有重要意义。
1 材料和方法
1.1 病毒株、细胞、重组质粒及实验动物 BTV血清型1~24型病毒株、BHK-21细胞和SP2/0骨髓瘤细胞由本实验室保存;以pCI-neo质粒为载体的分别含有BTV1 10个蛋白(VP1、VP2、VP3、VP4、VP5、VP6、VP7、NS1、NS2、NS3)编码基因的真核表达重组质粒由本实验室构建;6周龄~8周龄BALB/c雌性小鼠购自本研究所实验动物中心。
1.2 主要试剂 预染蛋白Marker购自Fermentas公司;邻苯二胺(OPD)购自哈尔滨博瑞生物技术有限公司;二氨基联苯胺(DAB)显色试剂盒、HRP标记的山羊抗鼠IgG抗体(HRP-IgG)购自北京中杉金桥生物技术有限公司;PEG 4000、HAT、HT、FITC标记羊抗鼠IgG抗体(FITC-IgG)购自Sigma公司;转染试剂Lipofectam ineTM2000、MAb亚型鉴定试剂盒购自Invitrogen公司。
1.3 动物免疫 腹腔注射BTV1(TCID50=10-6.675/0.1m L)于6周龄~8周龄的BALB/c雌鼠5只,1 ML/只。每两周进行一次腹腔免疫,共免疫4次。在三免后一周断尾采血,采用BTV1病毒包被的ELISA板检测血清效价。选取血清效价最高的小鼠在融合前3 d腹腔注射加强免疫。
1.4 ELISA检测方法的建立 按常规间接ELISA操作步骤,分别用灭活的BTV1全病毒和BHK-21作为抗原包被,经方阵滴定试验确定抗原最佳包被浓度、待检抗体最佳工作浓度及判定标准。
1.5 杂交瘤细胞株的建立及MAb的制备 将对数生长期的SP2/0细胞与效价最高小鼠的脾淋巴细胞以1∶4~1∶10比例混合,加入融合剂PEG 4000进行融合,分别经过选择性培养基HAT、HT进行培养。选择BTV1-ELISA阳性细胞克隆纯化,筛选出稳定分泌特异性MAb的杂交瘤细胞株。
1.6 MAb亚类的鉴定 按照Invitrogen公司的亚类试剂盒说明书用ELISA方法进行检测。
1.7 Western blot鉴定 将离心收获感染BTV1的细胞沉淀和BHK-21细胞沉淀处理后进行SDSPAGE电泳,经电转印将蛋白转移到硝酸纤维素膜上,用5%脱脂奶粉封闭液4℃封闭过夜。以MAb上清为一抗,山羊抗鼠HRP-IgG(1∶4 000)为二抗进行western blot鉴定。
1.8 MAb抗BTV1不同蛋白的间接免疫荧光(IFA)鉴定 按照转染试剂的操作说明,将表达BTV1的10种蛋白编码基因的真核表达重组质粒分别转染BHK-21细胞,转染48 h后,以MAb上清为一抗,山羊抗鼠FITC-IgG(1∶200)为二抗进行IFA鉴定。
1.9 与BTV反应性的IFA鉴定 将BTV 1~24型病毒株分别接种于单层BHK-21细胞中,待CPE出现时,弃去培养液,75%预冷的乙醇,4℃固定30 Min。分别加入鼠阳性、阴性血清和MAb上清,以山羊抗鼠FITC-IgG(1∶200)为二抗进行IFA鉴定。
2 结果与讨论
2.1 ELISA检测方法的建立 经方阵试验测得BTV1全病毒和BHK-21 1∶50稀释,4℃反应过夜。5%脱脂乳37℃封闭2 h,阴阳性血清1∶3 200稀释;一抗(MAb上清)和山羊抗鼠二抗(1∶4 000稀释)作用最佳时间均为37℃孵育1 h,底物显色时间为10min。
2.2 MAb的制备 细胞融合后,检测为阳性的细胞克隆经过3次细胞克隆纯化后,共获得3株稳定分泌抗BTV1 MAb的阳性杂交瘤细胞株,分别命名为2B10、3D4、4H8。经MAb亚型鉴定,3株MAb均为IgG1/κ。
2.3 Western blot鉴定 3株杂交瘤细胞培养上清经western blot鉴定结果表明,4H8与BTV1的VP7蛋白反应,3D4与BTV1的VP6蛋白反应,而2B10没有与变性的病毒蛋白发生反应,而后的IFA显示2B10与pCI-neo质粒表达的VP7以及BTV发生反应,推测2B10针对的是VP7蛋白上的构象表位。所有MAb均不与对照BHK-21细胞发生反应(图1)。
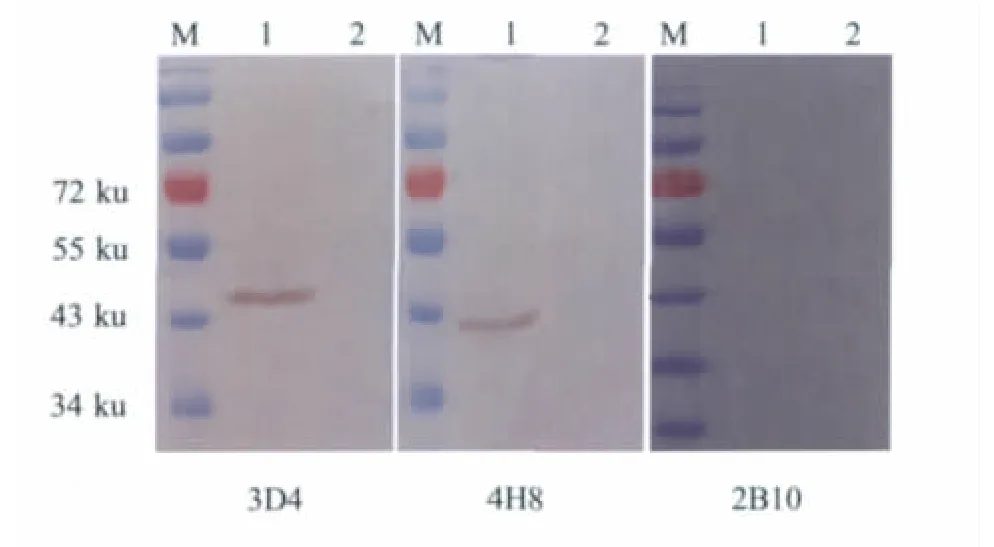
图1 Western blot鉴定结果Fig.1 Western blot analysis ofmonoclonal antibodies
2.4 MAb抗BTV1不同蛋白的IFA鉴定 将连有10种蛋白基因的pCI-neo真核表达质粒转染于BHK-21细胞,用制备的MAb上清分别与其做IFA。2B10和4H8与VP7蛋白反应,3D4与VP6蛋白反应(图 2)。
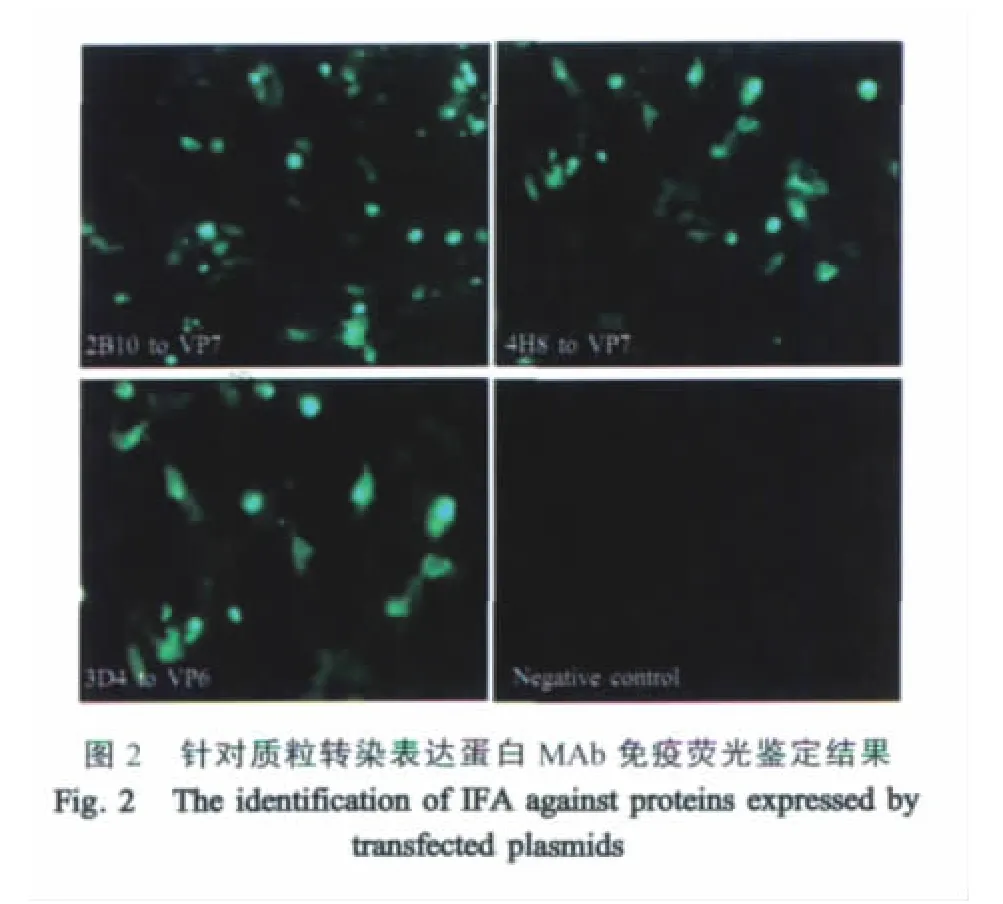
2.5 与BTV反应性的IFA鉴定 用2B10、3D4、4H8 3株杂交瘤细胞培养上清对接种BTV 1~24型病毒株的单层BHK-21细胞以及未接种病毒的BHK-21细胞进行IFA,结果显示这3株MAb与不同血清型的BTV均可以反应。
VP7蛋白具有群特异性抗原决定簇,可以刺激机体产生群特异性抗体,在BT的群特异性血清抗体检测中,首选是和VP7蛋白反应的MAb[8]。和VP7蛋白一样,VP6蛋白也是高度保守的,本研究制备的3D4同样可以与BTV1~24型血清型发生反应,表明VP6蛋白也可以产生群特异性MAb,同时证明Schwartz-Cornil等的观点VP6在不同血清型中是相对保守的[9],这为VP6蛋白的相关功能性研究奠定了一定基础。
综上所述,本研究制备的抗BTV特异性MAb,为建立一种高效快速的检测方法提供实验依据,并为BTV分子生物学特性研究及建立BTV免疫学检测方法奠定了基础。
[1]Maan S,Nom ikou K.Complete genome characterisation of a novel 26th bluetongue virus serotype from Kuwait[J].PLoS One,2011,6(10):e26147.Epub 2011 Oct 21.
[2]Roy P.Bluetongue virus genetics and genome structure[J].Virus Res,1989,13(3):179-206.
[3]Mertens P P C,Brown F,Sangar D V.Assignment of the genome segments of bluetongue virus type 1 to the proteins which they encode[J].Virology,1984,135(1):207-217.
[4]Polly Roy.Bluetongue virus:dissection of the polymerase complex[J].J General Virology,2008,89:1789-1804.
[5]Roy P,Marshall J J,French T J.Structure of the bluetongue virus genome and its encoded proteins[J].Curr Top in Microbiol Immunol,1990,162:43-87.
[6]Y u Y,Fukusho A,Ritter D G,et al.Complete nucleotide sequence of the group-reactive antigen VP7 gene of bluetongue virus[J].Nucleic Acids Res,1988,16(4):16-20.
[7]Hosamani M,Shim izu S,Hirota J,et al.Expression and characterization of bluetongue virus serotype 21 VP7 antigen:C-term inal truncated protein has significantly reduced antigenicity[J].J Vet Med Sci,2011,73(5):609-613.
[8]Le Blois H,Fayard B,Urakawa T,et al.Synthesis and characterization of chimeric particles between epizootic hemorrhagic disease virus and bluetongue virus:functional domains are conserved on the VP3 protein[J].JVirol,1991,65(9):4821-4831.
[9]Schwartz-Cornil I,Mertens P P,Contreras V,et al.Bluetongue virus:virology,pathogenesis and immunity[J].Vet Res,2008,39(5):46.
